Введение. Современные принципы лечения пациентов с агрессивными формами рака мочевого пузыря (РМП) характеризуются стремлением к радикальному удалению пораженного опухолью мочевого пузыря с последующим формированием резервуаров из различных отделов кишечника [1]. До недавнего времени радикальная цистэктомия (РЦЭ) рассматривалась как инвалидизирующая операция, сопряженная с высокой летальностью и риском развития тяжелых послеоперационных осложнений.
Сегодня цистэктомия в радикальном объеме включает удаление единым блоком вместе с мочевым пузырем прилежащей брюшины и паравезикальной клетчатки. У мужчин удалению вместе с мочевым пузырем подлежат предстательная железа и семенные пузырьки с прилегающей жировой клетчаткой, проксимальные части семявыносящих протоков и 1–2 см проксимальной уретры; у женщин – матка с придатками и уретра с передней стенкой влагалища. Операция сочетается с тазовой лимфаденэктомией (ЛАЭ) [1–3]. К основным вариантам отведения мочи на сегодняшний день относятся методики орто- и гетеротопической деривации мочи в изолированные сегменты тонкой кишки [4–6]. Естественно, что такой объем оперативного вмешательства чреват различными интра- и послеоперационными осложнениями.
Наиболее частыми интраоперационными осложнениями РЦЭ служат кровотечения, травмы прямой кишки и запирательного нерва. С развитием знаний по анатомии малого таза и усовершенствованием хирургической техники выполнения РЦЭ частота вышеуказанных осложнений сведена к минимуму. Однако даже в клиниках с опытом выполнения более 100 РЦЭ в год осложнения в ходе этих операций по-прежнему встречаются и считаются одной из актуальных проблем онкоурологии [6–8].
Цель работы: изучить частоту, характер и факторы риска развития интраоперационных осложнений у больных РМП, перенесших РЦЭ.
Материалы и методы. С августа 2008 по декабрь 2017 г. в отделении онкоурологии Национального центра онкологии Минздрава Азербайджанской Республики выполнено 257 цистэктомий с различными вариантами отведения мочи. Среди прооперированных мужчин было 241 (93,8%), женщин – 16 (6,2%). Средний возраст пациентов составил 58,5 (37–81) лет. Объем оперативного вмешательства в 246 (95,7%) случаях соответствовал всем принципам радикализма. В остальных 11 (4,3%) операции по определенным причинам были выполнены без тазовой ЛАЭ. Все операции проведены тремя хирургами, работавшими в одной бригаде, с одинаковым опытом выполнения РЦЭ.
Для оценки частоты, характера и факторов риска интраоперационных осложнений был проведен анализ с использованием блока статистических программ SPSS 18.0 for Windows. Сравнительный анализ результатов и статистически значимую взаимосвязь оценивали по критериям Пирсона. Были проанализированы следующие переменные: метод отведения мочи и удаления мочевого пузыря, характер операций, стадия опухолевого процесса – рТ и рN, индекс массы тела (ИМТ) и число РЦЭ, выполненных хирургической бригадой (см. таблицу).
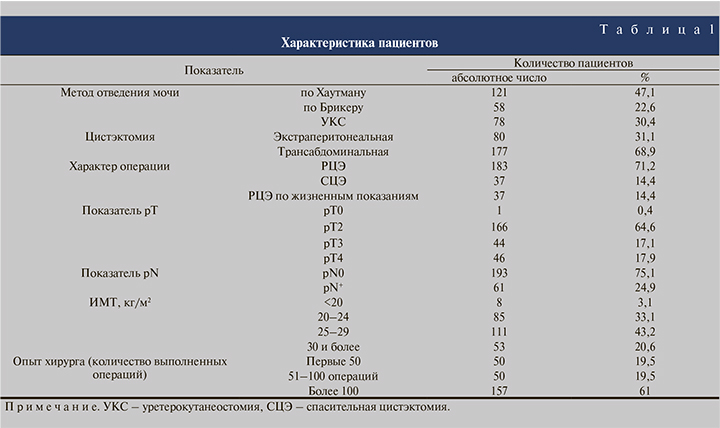
Среди интраоперационных осложнений оценивали объем интраоперационной кровопотери, частоту ранений кровеносных сосудов, прямой кишки и запирательного нерва. Также изучены длительность оперативного вмешательства, средний объем кровопотери и гемотрансфузий.
Результаты. Под интраоперационными понимали осложнения, которые наблюдались на операционном столе и были связаны непосредственно с хирургическим вмешательством. Осложнения, связанные с введением анестезии, в данной работе не рассматривались. Опыт хирурга был условно разделен на 3 периода: первые 50 операций, 51–100 и более 100 операций. В соответствии с общепринятыми стандартами кровопотеря больше 1000 мл считалась осложнением [9, 10].
Средняя продолжительность РЦЭ независимо от метода отведения мочи составила 256 мин (от 85 до 430), среднее время пребывания в отделении реанимации и интенсивной терапии – 2,8 (1–18) сут.
Интраоперационная летальность (смерть на операционном столе) констатирована в 1 (0,4%) случае: пациенту была выполнена цистэктомия по жизненным показаниям на фоне некупируемого кровотечения из распадающейся опухоли мочевого пузыря. В данном случае причиной смерти стала острая коронарная недостаточность.
Интраоперационные осложнения зарегистрированы у 34 (13,2%) пациентов. Наиболее часто встречаемыми интраоперационными осложнениями оказались кровотечения из вен дорсального комплекса и магистральных сосудов. Средний объем кровопотери при этом составил 597 мл (от 100 до 2500), средний объем интраоперационной гемотрансфузии – 950 мл. В раннем послеоперационном периоде средний объем гемотрансфузии составил 310 мл. Кровотечение из вен дорсального комплекса наблюдалось в 14 (5,4%) случаях. Основными факторами риска развития данного осложнения стали ИМТ и опыт хирурга (р=0,001 и р=0,004 соответственно). Статистически значимой связи между стадией заболевагия рТ, методом удаления мочевого и кровотечением из вен дорсального комплекса не установлено (р=0,239 и р=0,558 соответственно). Кровотечения вследствие повреждения магистральных сосудов зарегистрированы у 10 (3,9%) пациентов, все – при выполнении тазовой ЛАЭ. Из них в 2 (0,8%) и 3 (1,2%) наблюдениях имело место ранение наружных подвздошных артерий и вен соответственно, в 4 (1,6%) и 1 (0,4%) – внутренних подвздошных вен и артерии соответственно. При этом важно отметить, что основная часть этих осложнений пришлась на момент активного внедрения РЦЭ в клинике. Установлена статистически значимая связь между частотой ранений магистральных сосудов, опытом хирурга (р=0,028) и наличием метастатически пораженных лимфатических узлов – N+ (р=0,033). Результаты оказались недостоверными при анализе таких предикторов повреждений магистральных сосудов, как стадия рТ, способ удаления мочевого пузыря и ИМТ (р>0,05).
В 4 (1,6%) случаях при выполнении ЛАЭ констатировали полное пересечение запирательного нерва, целостность которого восстановлена путем сшивания концов. Несмотря на то что ни с одним из анализируемых факторов не установлена статистически значимая связь (р>0,05), следует отметить, что все травмы запирательного нерва произошли в период выполнения первых 100 операций.
Ранение прямой кишки также зарегистрировано в 4 (1,6%) наблюдениях. Дефекты были восстановлены путем наложения двухрядных швов без выведения превентивной колостомы.
В 1 (0,4%) случае данное осложнение стало причиной смерти пациента в раннем послеоперационном периоде (30 дней). В остальных 3 (1,2%) случаях осложнений не наблюдалось. При анализе предикторов данного осложнения статистически значимым оказался лишь один фактор – стадия рТ4 (р=0,028).
Среди прочих особый интерес представляют 2 (0,8%) осложнения, связанные непосредственно с опытом хирургической бригады и отведением мочи. Так, в 1 (0,4%) случае – это реанастомозирование тонкой кишки вследствие нарушения трофики ранее наложенного энтероэнтероанастомоза, обнаруженное к концу хирургической операции. Второе осложнение – некроз дистальных концов, так называемых ушек, сформированного модифицированного ортотопического резервуара, что стало причиной резекции «ушек» и имплантации мочеточников в заднюю стенку резервуара по методике Le-Duc. Оба осложнения имели место в период внедрения ортотопической илеоцистопластики. Интраоперационных осложнений, связанных с гетеротопическим отведением мочи, не зарегистрировано.
Также проведен анализ причин возникновения интраоперационных осложнений в зависимости от предшествовавшей терапии. Из 257 пациентов, которым выполнена РЦЭ, 47 (18,3%) больных ранее получали комплексное органосохраняющее лечение по поводу мышечно-инвазивного РМП. Интраоперационные осложнения у этой категории больных развились в 6 (2,33%) случаях. Сравнительный анализ полученных данных не выявил статистически значимой взаимосвязи по критерию Пирсона (χ2=0,011, р=0,917).
Обсуждение. Наиболее частыми интраоперационными осложнениями РЦЭ являются кровотечения и ранения прямой кишки. В нашем исследовании зарегистрировано 24 (9,3%) случая кровотечений по объему более 1000 мл, что превышает аналогичные показатели, представленные в литературе. Мы согласны с мнением М. И. Волковой, согласно которому интраоперационное кровотечение – это редко регистрируемое хирургом осложнение, как правило не входящее в список анализируемых и публикуемых желательных явлений [11]. Этим и объясняется разница между собственными результатами и данными, представленными в литературных источниках. А. Shabsigh et al. [12], проведя тщательный анализ большой серии РЦЭ, установили, что одним из достоверных предикторов частоты ранних тяжелых послеоперационных осложнений является уровень интраоперационной кровопотери (р=0,04). Объем интраоперационной кровопотери, по данным различных авторов, варьируетcя от 200 до 2500 мл. Средний объем при этом колеблется от 600 до 1700 мл [13–17]. В нашей серии наблюдений рассматриваемый показатель составил 597 (100–2500) мл, что согласуется с данными литературы. При этом хотелось бы отметить, что основная часть осложненных кровотечением РЦЭ выпала на период выполнения первых 100 операций (р<0,05).
Одним из важных показателей интраоперационной кровопотери является объем гемотрансфузий. Считается, что объем интра- и периоперационной гемотрансфузии негативно влияет на выживаемость, что, по мнению авторов, связано с иммуносупрессивным воздействием компонентов переливаемой крови [18, 19]. По данным литературы, средний объем гемотрансфузии в периоперационном периоде у пациентов, перенесших открытую РЦЭ, составляет 500–1700 мл [8, 19], а при эндоскопических РЦЭ – 250–800 мл. В нашей работе средний объем интраоперационной гемотрансфузии и гемотрансфузии в раннем послеоперационном периоде составил 950 и 310 мл соответственно, что сопоставимо с результатами, представленными в литературе.
Частота повреждений дорсального комплекса при мобилизации предстательной железы составляет 0,9–25% [6, 8, 22, 23]. В нашей работе она была равна 5,4%, причем в большинстве случаев данное осложнение возникало у пациентов с высоким показателем ИМТ, прооперированных в период выполнения первых 50 операций. На сегодняшний день частота кровотечений из вен дорсального комплекса даже у пациентов с ИМТ более 35 кг/м2 сведена к нулю.
Повреждения магистральных сосудов при РЦЭ, по данным литературы, отмечаются не часто и составляют 0,2–2% [19, 20, 24, 25], тогда как в нашем исследовании их констатировали в 3,9 % случаев. По нашему мнению, высокие показатели частоты повреждений магистральных сосудов связаны прежде всего с опытом хирурга и наличием метастатически измененных лимфатических узлов, что было доказано статистически.
Не менее грозным осложнением при выполнении ЛАЭ является травма запирательного нерва, данные о частоте которого в литературе представлены довольно скудно.
В нашей серии наблюдений зафиксировано 4 (1,6%) случая травмы запирательного нерва.
Одной из наиболее важных проблем интраоперационного и раннего послеоперационного периодов является повреждение прямой кишки. По данным литературы конца ХХ столетия, частота повреждений прямой кишки при выполнении РЦЭ достигала 10% при неосложненных формах РМП и 27% – у пациентов, перенесших до РЦЭ химиолучевую терапию [26]. В работах последнего 10-летия частота указанного осложнения варьируетcя в пределах от 0,2 до 1,5% [27]. При этом важно отметить, что травмы прямой кишки при выполнении лапароскопической и робот-ассистированной цистэктомии встречаются в 4,2 и 4,0% случаев соответственно [19, 24]. По нашему мнению, снижение частоты рассматриваемого показателя в настоящее время, вероятнее всего, связано с усовершенствованием хирургической техники. В проведенном нами исследовании зарегистрировано всего 4 (1,6%) случая травмы прямой кишки, основным предиктором которой в нашей серии явился критерий рТ4. На сегодняшний день определена тактика устранения ранений прямой кишки и профилактика связанных с ними осложнений. При своевременно распознанном повреждении прямой кишки рекомендуется освежить края дефекта и ушить рану двухрядным швом. Тактика лечения пациентов, получивших лучевую терапию по радикальной программе, иная. В подобных ситуациях рекомендуется выведение колостомы, что достоверно снижает частоту осложнений, связанных с травмой прямой кишки [3, 28, 29].
Резюмируя вышеизложенное, хотелось бы отметить, что оценка осложнений во время операции служит результатом субъективного восприятия каждого хирурга и исследователя. Результаты нашего исследования подчеркивают тот факт, что основным предиктором возникновения интраоперационных осложнений являются технические причины. По нашему мнению, все значимые факторы, выявленные в нашей серии наблюдений, определяют частоту развития интраоперационных осложнений посредством именно этого механизма.
Заключение. Радикальная цистэктомия с кишечной деривацией мочи – одна из сложнейших операций в онкоурологии. Прогнозировать и оценить риски возникновения интраоперационных осложнений РЦЭ не всегда представляется возможным. Согласно полученным нами данным, основными предикторами интраоперационных осложнений являются опыт хирурга (не менее 50 операций), высокий показатель ИМТ и стадия болезни рТ. Результат данного исследования позволяет нам предоставить довольно простые практические рекомендации: для снижения числа интраоперационных осложнений РЦЭ больные с повышенным ИМТ должны оперироваться наиболее опытными хирургами. Данный подход позволит минимизировать частоту интраоперационных осложнений, обеспечить скорейшее восстановление и уменьшение сроков пребывания в стационаре пациентов после РЦЭ.



