Введение. Радикальная цистэктомия (РЦ) является основным методом лечения мышечно-инвазивного рака мочевого пузыря (РМП). Также она показана при рецидивирующих поверхностных новообразованиях с высоким риском прогрессирования, T1G3, при BCG-резистентном раке in situ [1–4].
Экстирпация мочевого пузыря (МП) в сочетании с регионарной лимфаденэктомией демонстрирует низкую степень местных рецидивов и лучшие показатели отдаленной выживаемости [3–6]. За последнее время частота осложнений и смертность после РЦ значительно снизились [2, 3]. Частота ранних послеоперационных осложнений находится в диапазоне 30–60%, поздних – 30–40%, летальность составляет 1–4% [1–4]. Лучевая терапия и системная химиотерапия имеют худшую отдаленную выживаемость и большую частоту местных рецидивов по сравнению с РЦ [1, 4, 7]. Важно также, что после удаления МП мы получаем объективное патогистологическое стадирование РМП и регионарных лимфатических узлов (ЛУ). Это позволяет определять больных, которым показана адъювантная химиотерапия [4, 7].
Выживаемость после РЦ определяется рядом клинических и патогистологических характеристик: степени дифференцировки новообразования, наличия предыдущих трансуретральных резекций новообразования, степени инвазии первичной опухоли, метастатического поражения регионарных ЛУ и сеансов неоадьювантной химиолучевой терапией [7–11]. Как правило, рецидив развивается в течение 2–3 лет после экстирпации МП: локальный – в 4–29% и отдаленный – в 22–38% случаев [7, 8, 12–16].
Цель исследования: изучить отдаленные результаты больных раком мочевого пузыря после радикальной цистэктомии.
Материалы и методы исследования. Нами изучены результаты хирургического лечения 404 больных РМП, которые были оперированы и наблюдались в урологической клинике СЗГМУ им И. И. Мечникова МЗ РФ на базе урологического отделения городской многопрофильной больницы № 2 с 1997 по 2020 г. Всем пациентам была произведена РЦ различными методами отведения мочи. Ортотопическая цистопластика выполнена 299 (72,8%) больным. Из них артифициальный МП из сегмента желудка по методу Mitchell–Hauri сформирован у 13 (3,4%), в собственной модификации – у 11 (2,9%) пациентов. Илеоцистопластика произведена 245 (58,7%), сигмоцистопластика – 30 (7,7%) больным. Континентная накожная деривация мочи была выполнена 13 (3,2%) пациентам. В качестве эфферентных механизмов удержания мочи в подавляющем большинстве случаев использовался червеобразный отросток (у 12), у одного больного был сформирован инвагинированный подвздошный клапан. Пересадка мочеточников в сигмовидную кишку выполнена 42 (11,2%), уретерокутанеостомия – 50 (12,8%) пациентам.
Всем пациентам выполнены клинико-лабораторные, рентгенологические, радионуклидные, ультразвуковые, инструментальные, эндоскопические, патоморфологические, иммуногистохимические и уродинамические методы исследования. Также проводилась оценка качества жизни. Была исследована общая раково-специфическая выживаемость, частота рецидивирования. Контрольное обследование в послеоперационном периоде проводилось с частотой 1 раз в 6 мес. в течение первых 2 лет, затем ежегодно.
Результаты исследования. Мужчин было 342 (86,4%), женщин 62 (13,6%). Возраст мужчин колебался от 32 до 78 лет и в среднем составил 57,7±7,3 года. Возраст оперированных женщин находился в диапазоне от 24 до 78 лет, в среднем – 51,2±4,7 года. У 22 (5,4% от общего числа больных 404) больных послеоперационная стадия соответствовала pT0N0, поверхностная форма опухоли (pT1N0) выявлена у 23 (5,6% от обшего числа больных 404). В свою очередь мышечно-инвазивный органоограниченный лимфонегативный РМП (pT2N0) диагностирован у 190 (47,0%) пациентов. Экстравезикальное распространение опухоли в отсутствие метастазов в ЛУ выявлено у 88 (21,7%) больных, соответственно, стадия pT3N0 – у 38 (9,4%) и стадия pT4N0 – у 50 (12,3%). Метастазы в регионарные ЛУ были диагностированы у 81 (20,0%) больного.
Ранние послеоперационные осложнения отмечены у 136 (33,6%) больных, умерли 12 (2,9%). В позднем послеоперационном периоде (n=234) осложнения после ортотопической деривации наблюдались у 60 (25,6%) больных, после неортотопических методов отведения мочи у 27 (11,5%). Неспецифические осложнения (не связаны с методом деривации мочи) выявлены у 11 (4,7%) больных. При анализе структуры послеоперационных осложнений установлено, что в отдаленном послеоперационном периоде преобладают осложнения, связанные с методом деривации мочи, отмеченных у 87 (37,1%) больных.
Локальный рецидив в малом тазу после РЦ диагностирован у 33 (8,5%) пациентов. Как правило, он выявлялся при СКТ или МРТ в виде образования тканевой плотности размером ≥2 см, расположенного ниже бифуркации аорты. Среди таких больных мужчин было 27 (82,0%), женщин – 6 (18,0%). Возраст мужчин колебался от 43 до 73 лет, средний возраст – 58,7±11,7 года. Средний возраст женщин составил 50,0±7,8 года, возрастной диапазон от 24 до 65 лет. Медиана времени с момента операции до возникновения местного рецидива составила 7,0 (1,5–45,7) мес. Метастатическое поражение печени одновременно было выявлено у 6 (18,0%) пациентов, при этом симультанное поражение кожи, легких или костей имело место у 3 (9,0%) больных. У 27 (82,0%) пациентов отдаленных метастазов выявлено не было. У 19 (57,6%) больных выявлено экстрапузырное распространение опухоли или метастатическое поражение ЛУ. У 14 (42,4%) больных РМП был органоограниченный, лимфонегативный. Кроме того, медиана времени с момента РЦ до тазового рецидива существенно коррелировала с патоморфологической стадией. Она составила 14,9 и 5,3 мес. в стадиях ≤pT2, pN0 и стадии >pT2, N+ соответственно. Из 33 пациентов у 20 (60,5%) тазовые рецидивы диагностированы на основании клинической симптоматики и у 13 (39,5%) по результатам методов визуализации. Стоит отметить, что частота тазовых рецидивов не коррелировала со способами деривации мочи. Локальный тазовый рецидив после РЦ чаще возникал у лимфоположительных больных экстравезикальным распространением первичной опухоли градации G2-G3, при этом выживаемость существенно снижалась.
Результаты изучения общей выживаемости наших больных в зависимости от степени инвазии (pT), наличия или отсутствия метастатического поражения регионарных ЛУ (pN), степени дифференцировки опухоли (pG) представлены в табл. 1. Общая 10-летняя выживаемость составила 43,4%. По степени инвазии больные были распределены в пять групп: pT0-T1, pT2a, pT2b, pT3, T4. Пятилетняя общая выживаемость больных патоморфологической стадией pT0-T1 составила 85,9%, pT2a – 65,7, pT2b – 55,0%, pT3 – 35,3 и pT4 – 20,8%. Выживаемость в течение 10 лет для стадии pT0-T1 составила 80,6%, pT2a – 61,1, pT2b – 35,7, pT3 – 20,7 и для pT4 – 4,6%. Таким образом, подтвержден факт, согласно которому при увеличении степени инвазии РМП выживаемость больных снижается.

Отдельно были изучены группы пациентов с различным статусом регионарных ЛУ. В отсутствие метастазов в регионарные ЛУ 2-летняя общая выживаемость составила 81,2%, 5-летняя – 67,2%. В группе лимфопозитивных больных общая 2- и 5-летняя выживаемость составила соответственно 46,9 и 13,9%. Метастатическое поражение регионарных ЛУ существенно снижает выживаемость больных РМП после РЦ (рис. 1). Степень дифференцировки опухоли также оказывает заметное влияние на выживаемость больных после РЦ. Общая 5-летняя выживаемость больных, у которых отсутствовала опухоль в препарате после РЦ, составила 83,2%, в группах со степенью дифференцировки G1, G2 и G3 составила соответственно 82,2%, 49,9 и 21,9%. Общая 10-летняя выживаемость больных без опухоли в послеоперационном препарате составила 78,2%, в группах с G1 и G2 соответственно 73,8 и 31,8%. Больные с низкой степенью дифференцировки или гистопатологической градацией G3 не дожили до десятилетнего срока наблюдения (рис. 2). У 3 (0,7%) женщин и 19 (4,7%) мужчин при патоморфологическом исследовании послеоперационных препаратов уротелиальный рак не был верифицирован, что соответствует стадии pT0N0. На этапе верификации диагноза этим больным была выполнена ТУР, при патоморфологической оценке выявлена мышечно-инвазивная форма заболевания, что в свою очередь стало показанием к РЦ. Таким образом, у 22 (5,4%) пациентов послеоперационная стадия соответствовала pT0N0. Отсутствие доказательств резидуальной опухоли в послеоперационных препаратах объясняется радикальной ТУР, воздействием неоадъювантной терапии и возможными патоморфологическими трудностями верификации небольших участков раковых клеток.

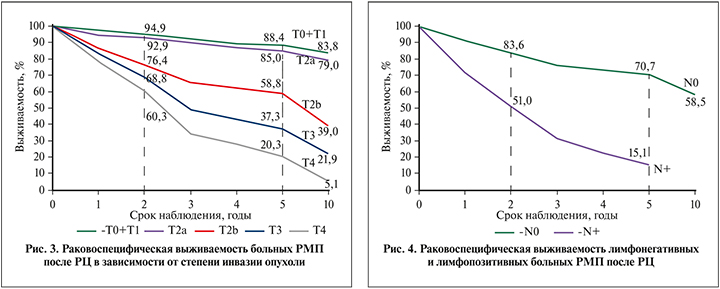
Данные раковоспецифической выживаемости в зависимости от степени инвазии опухоли, статуса ЛУ, гистопатологической градации опухоли представлены в табл. 2. В стадиях pT0-T1, pT2a, pT2b, pT3 и pT4 5-летняя раковоспецифическая выживаемость составила соответственно 88,4%, 85,0, 58,8, 37,3 и 20,3%. Десятилетняя раковоспецифическая общая выживаемость всех оперированных нами больных составила 47,2%. В зависимости от стадии она составила 83,8%, 79,0, 39,0, 21,9 и 5,1% соответственно при pT0-T1, pT2a, pT2b, pT3 и pT4. Эти данные представлены на рис. 3. Раковоспецифическая 2-летняя выживаемость при лимфонегативном статусе составила 83,6%, 5-летняя – 70,7%. При лимфопозитивном статусе 2- и 5-летняя выживаемость составила соответственно 51,0 и 15,1%. Эти данные представлены на рис. 4. Также отмечена высокая корреляция между степенью дифференцировки или гистопатологической градации и раковоспецифической выживаемостью. Так, 2-летняя раковоспецифическая выживаемость при G1, G2 и G3 составила 91,9%, 73,5 и 52,7%, 5-летняя в тех же группах составила 82,0%, 52,6 и 24,6% соответственно.
Общая 5-летняя выживаемость больных органоограниченной лимфонегативной, органонеограниченной лимфонегативной и лимфоположительной формами заболевания составила 72,6%, 48,0 и 13,8% соответственно. Общая 10-летняя выживаемость в органоограниченной лимфонегативной и органонеограниченной лимфонегативной группах составила 60,9 и 29,9% соответственно. Ни один из больных с метастатическим поражением ЛУ не дожил до десятилетнего срока. Раковоспецифическая выживаемость больных РМП после РЦ в зависимости от патоморфологической группы представлены в табл. 3. Пятилетняя раковоспецифическая выживаемость больных органоограниченной лимфонегативной, органонеограниченной лимфонегативной и лимфопозитивной формами РМП составила 77,3%, 47,7 и 15,1% соответственно. Десятилетняя раковоспецифическая выживаемость больных органоограниченной лимфонегативной, органонеограниченной лимфонегативной формами РМП равнялась 66,1 и 32,5% соответственно. Ни один из пациентов с метастазами в регионарные ЛУ не доживал до десятилетнего периода катамнестического наблюдения.


Обсуждение. Нами проанализированы отдаленные осложнения, летальность, частота местного рецидивирования и выживаемость пациентов после РЦ по поводу РМП. Общая 5-летняя выживаемость после РЦ без дополнительных методов лечения, по данным современной литературы, находится в пределах 48–58% [6, 7]. Местный рецидив в основном выявляется в течение первых 3 лет периода катамнестического наблюдения. Общепринят тот факт, что задержка оперативного вмешательства ведет к прогрессированию стадии РМП и ухудшению прогноза. Отсрочка выполнения РЦ более чем на 12 нед. после установления диагноза определяется как критический период, после которого прогноз существенно ухудшается [3 ,9, 15, 16]. Результаты данной работы показывают, что каждая последующая стадия прогрессирования снижает выживаемость.
Частота метастатического поражения регионарных ЛУ находится в диапазоне от 18 до 24% [11, 14]. Общепризнан тот факт, что степень поражения ЛУ коррелирует со стадией первичной опухоли. Больным с органоограниченной формой РМП мы выполняли стандартную, а в случае экстравезикального распространения опухоли расширенную лимфодиссекцию. В нашем исследовании частота поражения ЛУ составила 21,6%. По данным разных авторов, 5-летняя общая выживаемость лимфоположительных больных колеблется от 21 до 31% [2, 10, 13], при этом отмечено, что поражение ЛУ снижает выживаемость больных РМП после РЦ.
Существует ряд нерешенных вопросов относительно объема лимфаденэктомии и числа удаляемых ЛУ. По мнению различных исследователей, билатеральная лимфаденэктомия до середины общих подвздошных артерий является достаточной и обеспечивает удаление около 20 ЛУ [2, 9, 15–17]. Мы считаем, что лимфодиссекция в таком объеме позволяет получать информацию об их состоянии.
Заключение. Таким образом, стадия опухоли (pT), состояние регионарных ЛУ (pN), степень гистопатологической градации (pG) оказывают существенное независимое влияние на общую и раковоспецифическую выживаемость больных РМП после РЦ. В плане прогнозирования выживаемости, планирования наблюдения и дальнейших методов лечения целесообразно распределение больных на три патоморфологические группы риска: органограниченную лимфонегативную (pT0-T1N0, pT2aN0, pT2bN0), органонеограниченную лимфонегативную (pT3aN0, pT3bN0, pT4aN0, pT4bN0) и лимфопозитивную (любая pT, pN+). РЦ является сложным и травматичным оперативным вмешательством с высокой частотой послеоперационных осложнений и летальности. Выявление РМП на ранних стадиях, совершенствование техники вмешательства с более широким использованием лапароскопических и роботических методов и выполнение ее в крупных хорошо оснащенных и имеющих достаточный опыт таких операций клиниках позволит улучшить результаты данной операции.



