Рентгенэндоваскулярная эмболизация артерий простаты (ЭАП) – относительно новый и перспективный метод лечения ДГПЖ. Данный метод применяется в России с 2004 г., а с 2019 г. он включен в клинические рекомендации Министерства здравоохранения РФ в качестве варианта выбора лечения пациентов с отягощенным соматическим статусом. О высокой эффективности ЭАП свидетельствуют работы отечественных и зарубежных авторов [1–4]. ЭАП – малоинвазивное оперативное вмешательство, не требующее много времени для восстановления пациента.
Однако преимущества ЭАП не исключают риска развития осложнений. По литературным данным, к наиболее часто встречающимся осложнениям относятся острая задержка мочи (2–17%), выраженная боль в промежности, связанная с фокальным некрозом паренхимы простаты (5–13%), трофические изменения прямой кишки, мочевого пузыря, головки полового члена, кожи мошонки, ягодиц (0–5%), гематомы в области артериального доступа (1–3,2%) [1, 5, 6]. Нам удалось найти в литературе только одно наблюдение развития некроза в стенке мочевого пузыря, потребовавшего выполнения хирургического лечения в объеме резекции мочевого пузыря [7].
Мы также впервые столкнулись с ситуацией, требующей срочного оперативного вмешательства в объеме лапаротомии, цистпростатэктомии и двусторонней чрескожной нефростомии, возникшей в результате развития некроза мочевого пузыря после выполнения рентгенэндоваскулярной ЭАП.
Клиническое наблюдение
С 11.05.2021 по 18.06.2021 в урологическом отделении ГБУЗ МО МОНИКИ им. М.Ф. Владимирского на стационарном лечении находился пациент 62 лет с основным диагнозом «доброкачественная гиперплазия предстательной железы» (ДГПЖ).
Из анамнеза известно, что с 2015 г. пациента беспокоило учащенное и затрудненное мочеиспускание малыми порциями. Диагноз «доброкачественная гиперплазия предстательной железы» был подтвержден гистологически. Пациенту выполнялась биопсия предстательной железы по поводу повышения общего ПСА до 6,2 нг/мл. Пациент длительно принимал альфа-адреноблокаторы с положительным эффектом, но в течение 2021 г. стал отмечать усиление ирритативных и обструктивных симптомов. Был госпитализирован в урологическое отделение ГБУЗ МО МОНИКИ им. М.Ф. Владимирского в плановом порядке с целью проведения оперативного лечения.
При поступлении состояние удовлетворительное. Количество баллов по Международной системе суммарной оценки заболеваний предстательной железы (IPSS [International Prostate Symptom Score]) составляло 20; индекс качества жизни (QoL) – 4. По данным УЗИ органов мочеполовой системы, объем предстательной железы составил 145 см3, объем остаточной мочи – 110 мл. Показатели урофлоуметрии: максимальная скорость потока мочи (Qmax) – 6 мл/с, средняя скорость (Qave) – 3,8 мл/с. По результатам клинического анализа крови от 11.05.2021: гемоглобин – 150 г/л, эритроциты– 4,9•1012/л, тромбоциты– 214•109/л, лейкоциты–9,6•109/л; биохимического анализа крови от 11.05.2021: общий белок – 68 г/л, глюкоза – 5,9 ммоль/л, мочевина – 6,3 ммоль/л, креатинин – 102 мкмоль/л.
С учетом большого размера предстательной железы и отсутствия технической возможности осуществления лазерной энуклеации пациенту предложена лапароскопическая аденомэктомия. Однако пациент отказался от данного вида оперативного вмешательства. Основываясь на накопленном в урологическом отделении ГБУЗ МО МОНИКИ им. М.Ф. Владимирского опыте, в качестве альтернативной тактики хирургического лечения пациенту предложено выполнение рентгенэндоваскулярной эмболизации артерий простаты с целью уменьшения ее размеров и проведения последующей трансуретральной резекции предстательной железы.
13.05.2022 выполнена рентгенэндоваскулярная эмболизация артерий простаты. Установлен уретральный катетер Foley № 22 Ch, баллон которого раздут на 15 мл раствором NaCl 0,9%. Пунктирована правая бедренная артерия по Сельдингеру (Seldinger), в ее просвет установлен интродьюсер 5F. Произведена катетеризация правой внутренней подвздошной артерии. По проводнику 0,014'' микрокатетером «Progreat» катетеризирована правая нижнепузырная артерия. Микроэмболами Embozene 500/м (использован 1 флакон) и микросферами Contur 355–500/м выполнена селективная эмболизация артерий, питающих предстательную железу. При рентгенологическом контроле с использованием рентгенконтрастного препарата Омнипак контрастирования эмболизированных сосудов выявлено не было. По проводнику 0,014'' микрокатетером Progreat катетеризирована левая нижнепузырная артерия. Микроэмболами LifePearl 400/м (использована 1/2 флакона) выполнена селективная эмболизация артерий, питающих предстательную железу. При рентгенологическом контроле с использованием рентгенконтрастного препарата Омнипак контрастирования эмболизированных сосудов выявлено не было.
В течение раннего послеоперационного периода состояние пациента стало прогрессивно ухудшаться. Возникла нарастающая тупая боль в надлобковой области. На четвертые сутки после операции присоединились симптомы общей интоксикации и олигурия. Диурез за сутки составил 350 мл мутной мочи. По результатам клинического анализа крови от 15.05.2021: гемоглобин – 159 г/л, эритроциты – 5,87•1012/л, тромбоциты – 208•109/л, лейкоциты – 15,59•109; биохимического анализа крови от 15.05.2021: общий белок – 69,6 г/л, глюкоза – 8,4 ммоль/л, мочевина – 8,6 ммоль/л, креатинин – 141,6 мкмоль/л. При выполнении ультразвукового исследования брюшной полости 17.05.2021 выявлены признаки кишечной непроходимости: масса жидкого содержимого в расширенных до 40 мм петлях тонкого кишечника. Данные мультиспиральной компьютерной томографии (МСКТ) от 17.05.2021, выполненной после введения 100 мл внутривенно болюсно и 30 мл ретроградно в мочевой пузырь по катетеру Foley контрастного препарата Ультравист 370, свидетельствовали о развитии некроза мочевого пузыря (рис. 1). В стенке мочевого пузыря, околопузырной клетчатке и в паренхиме увеличенной в размерах до 66х62 мм предстательной железы визуализировались множественные пузырьки газа. Определялся небольшой участок затека контрастного вещества в правую стенку мочевого пузыря. Четкого отображения ветвей обеих внутренних подвздошных артерий и кровотока в них, в том числе в обеих пузырных артериях, получено не было. При ретроградном введении контрастного препарата распространения последнего за пределы стенок мочевого пузыря не определялось. В тонкой кишке визуализировалась масса воздушного и жидкостного содержимого, в отдельных ее петлях присутствовали горизонтальные уровни на границе сред.
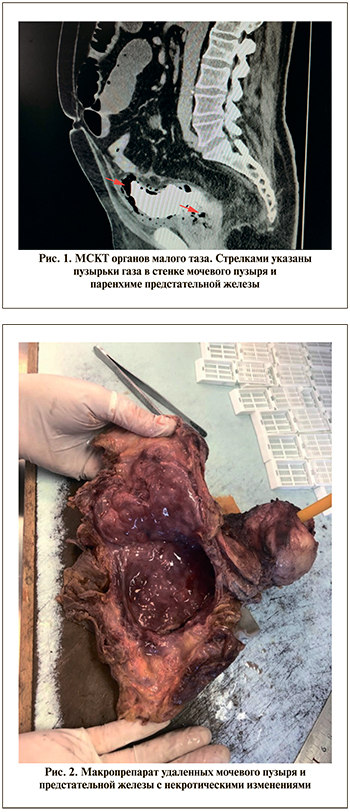
На основании полученных данных установлен диагноз «гангрена мочевого пузыря. Динамическая кишечная непроходимость» и принято решение о выполнении экстренного оперативного вмешательства.
17.05.2021 выполнена нижне-срединная лапаротомия. При ревизии: в брюшной полости серозный выпот, петли тонкой кишки резко раздуты, гиперимированы, на некоторых участках отечны, покрыты фибрином. Паравезикальная клетчатка инфильтрирована, отечна. Мочевой пузырь мобилизован, стенки его синюшно-багрового цвета с резким запахом, отечны. Мочеточники лигированы в нижней трети, пересечены. Предстательная железа мобилизована. Вены дорзального комплекса прошиты, лигированы и пересечены. Выполнена цистпростатэктомия (рис. 2). Произведена назоинтестинальная интубация кишечника. На выявленные участки десерозации последнего наложены серо-серозные швы. Выполнена санация и дренирование малого таза и правого бокового канала через контрапертуру. Рана послойно ушита. Выполнена двусторонняя чрескожная пункционная нефростомия.
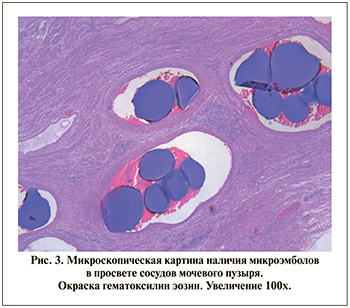
Заключение патолого-анатомического исследования операционного материала, полученного при выполнении цистпростатэктомии, от 04.06.2021: диффузная железисто-стромальная гиперплазия предстательной железы, морфологическая картина субтотального ишемического некроза ткани предстательной железы, язвенно-некротического цистита, пельвиоперитонита (рис. 3).
На фоне проведенного хирургического лечения отмечена положительная динамика в виде снижения уровня креатинина крови с 284 до 146 мкмоль/л, увеличения диуреза до 2000 мл в сутки. Однако в раннем послеоперационном периоде, а именно 20.05.2021, у пациента возникла интенсивная режущая боль в левой половине живота. При осмотре выявлено поступление тонкокишечного содержимого по отводящему дренажу из малого таза, что пслужило основанием для выполнения релапаротомии, ревизии брюшной полости, ушивания перфорации тонкой кишки, ушивания предперфорации тонкой кишки, санации и дренирования брюшной полости в экстренном порядке. Послеоперационные дренажи были удалены на 15-е сутки после операции. Рана заживала вторичным натяжением. Снятие послеоперационных швов произведено на 20-е сутки после операции.
18.06.2021 пациент выписан в удовлетворительном состоянии на амбулаторное лечение. Общий анализ крови на момент выписки из стационара: гемоглобин – 96 г/л, эритроциты – 3,26•1012/л, тромбоциты – 466•109/л, лейкоциты – 10,30•109. Биохимический анализ крови: общий белок – 66 г/л, глюкоза – 5,5 ммоль/л, мочевина – 7,4 ммоль/л, креатинин – 116 мкмоль/л.
Спустя 8 мес. после выписки, 02.02.2022, в ФГАОУ ВО «Первый МГМУ им. И. М. Сеченова» МЗ РФ пациенту успешно выполнена операция Брикера с целью создания альтернативного пути отведения мочи. Из протокола операции: левый мочеточник проведен под сигмовидной кишкой, выведен в правую подвздошную область. Отсечение терминального отдела подвздошной кишки около 20 см на расстоянии около 10–15 см от илеоцекального угла с использованием сшивающего аппарата в бессосудистой зоне с сохранением 1–2 сосудистых аркад для создания резервуара мочи по Брикеру. Формирование анастомоза «бок-в-бок» между пересеченными концами подвздошной кишки с использованием сшивающего аппарата. Создание анастомоза между мочеточниками и проксимальным отделом изолированной подвздошной кишки по Wallece-1 (рассечение каждого из мочеточников по медиальной поверхности на протяжении, несколько превышающем диаметр подвздошной кишки, сшивание задних поверхностей мочеточников между собой, формирование уретероилеостомы) непрерывным швом с использованием 2 ниток Викрил 4–0. Предварительно перед непосредственным завершением анастомоза по струне произведена установка 2-мочеточниковых катетеров № 7 в верхние мочевыводящие пути с обеих сторон. Дистальный конец изолированной подвздошной кишки выведен на переднюю брюшную стенку и подшит к коже узловыми швами с использованием ниток Викрил 2–0.
Несмотря на высокоэффективность и малоинвазивность эндоваскулярной эмболизации артерий предстательной железы, метод не лишен риска грозных, порой жизнеугрожающих осложнений.
По нашему мнению, к столь грозному осложнению мог привести неправильный выбор размера микрочастиц или раннее введение эмболов при катетеризации сосудов простаты, что в свою очередь привело к тотальной эмболизации пузырных артерий.
Таким образом, вопрос о выборе эмболизационного материала, технике эмболизации, подбора микрокатетеров и размеров эмболов для выполнения ЭАП остается открытым и дискутабельным [1, 3, 4]. Для более четкого определения показаний и противопоказаний к выполнению данного оперативного вмешательства требуется большее количество наблюдений и оценка отдаленных результатов. Безусловно эмболизация артерий простаты должна проводиться только в центрах, в которых обследованием и лечением пациентов занимаются урологи, работающие в сотрудничестве с опытными рентгенэндоваскулярными хирургами для отбора подходящих пациентов для выполнения эмболизации артерий простаты.



