Введение. Одним из частых встречающихся заболеваний в практике врача-уролога, которое требует персонализированного подхода к тактике лечения, является хронический простатит (ХП) категории III/синдром хронической тазовой боли (СХТБ). В соответствии с классификацией 1995 г.
Национального института здравоохранения (NIH) США III категория простатита обозначается как хронический абактериальный простатит (ХАП)/СХТБ и подразделяется на две подкатегории: IIIA (воспалительная форма) и IIIБ (невоспалительная форма). Сложность в ведении пациентов с ХАП/СХТБ обусловлена несколькими причинами: неясной этиологией, отсутствием единых критериев диагностики и терапии [1–4].
В современных клинических рекомендациях ХАП/СХТБ не входит в перечень причин мужского бесплодия, однако совокупные данные показывают, что у пациентов с ХАП/СХТБ регистрируются неоднозначные результаты спермограммы. В одних исследованиях не удалось выявить существенные различия основных параметров спермограммы при ХАП/СХТБ [5, 6]. В то же время недавно проведенные мета-анализы обнаружили более низкие концентрации сперматозоидов у пациентов с ХАП/СХТБ [7, 8].
Наиболее изученные причины ХАП/СХТБ объединены в ведущее патогенетическое звено нарушения микроциркуляции в предстательной железе (ПЖ), которое возникает в сосудистом русле органов малого таза [9]. У ряда больных в развитии ХАП/СХТБ существенную роль играют врожденные особенности кровоснабжения. Наличие множества сообщающихся венозных сосудистых анастомозов между венами ПЖ и венозной системой органов малого таза приводит к застойным явлениям, а недостаточность притока артериальной крови к ПЖ значимо усугубляет клиническое течение ХАП/СХТБ, что в свою очередь оказывает отрицательное воздействие на сперматогенез [10, 11].
Поскольку мужской фактор обусловливает до 50 % случаев бесплодия, состояние фертильности при ХАП является важным предметом изучения и не менее важен поиск перспективных методов лечения.
Цель исследования: оценить влияние базисной терапии ХАП\СХТБ\хронический простатит категории IIIА в сочетании с эффектом гиперкапнической гипоксии на параметры спермограммы, а также охарактеризовать гемодинамические и микроциркуляторные изменения в ПЖ.
Материалы и методы. В исследовании приняли участие 30 пациентов мужского пола в возрасте от 25 до 45 лет с жалобами на трудности в достижении беременности в браке в течение 1 года и более.
Для диагностики ХАП/СХТБ использовали опросник NIH-CPSI. В диагностический комплекс входили пальцевое ректальное исследование, микроскопический и бактериологический анализ секрета простаты, бактериологический посев и ПЦР-исследование эякулята на наличие инфекционных возбудителей воспалительного процесса, ультразвуковое исследование предстательной железы и органов мошонки.
Критерии включения: пациенты с жалобами на отсутствие зачатия в браке в течение 1 года и более; клиническая симптоматика ХАП/СХТБ (средневыраженные и тяжелые симптомы по данным анкетирования NIH-CPCI (более 10 баллов по доменам «боль» и «мочеиспускание»); болезненность ПЖ по данным пальцевого ректального исследования; отсутствие инфекционного агента по данным бактериологического исследования секрета ПЖ на стандартных питательных средах; наличие воспалительных изменений по данным микроскопического исследования секрета ПЖ (более 10–15 лейкоцитов в поле зрения при 100-кратном увеличении); отрицательный ПЦР-анализ эякулята на клинически значимые ИППП (Neisseria gonorrhoeae, Ureaplasma urealyticum, Trichomonas vagіnalis, Mycoplasma genitalium, Chlamydia trachomatis).
Критерии исключения: хронические заболевания в стадии обострения; миофасциальный синдром, нейропатия полового нерва и другие неврологические причины, связанные с возникновением СХТБ; онкологические заболевания; постоянный прием любых лекарственных препаратов; наличие вирусов гепатита В и С, ВИЧ; гормональный дисбаланс, связанный с изменениями показателей тестостерона, ЛГ, ФСГ, пролактина, гормонов щитовидной железы; варикоцеле; женский фактор бесплодия.
В качестве контроля использовались данные 15 здоровых мужчин, не имевших нарушений фертильности и признаков ХАП/СХТБ.
Анализ параметров спермограммы осуществлялся путем общеклинического исследования эякулята по стандартам ВОЗ-2010. Использовали диагностический набор «Spermac Stain» для окрашивания сперматозоидов с последующей возможностью дифференцировки морфологически нормальных и ненормальных спермальных клеток. Нормативы морфологии оценивали по Крюгеру (4%). Определение уровня фрагментации ДНК сперматозоидов было основано на принципе хроматиновой дисперсии (SCD-test) при помощи тест-набора «HALOSPERM» (HALOTECH DNA S.L., Испания).
Оценку микроциркуляторных свойств осуществляли при помощи накожной записи ЛДФ-граммы в области промежности в зоне проекции ПЖ. Поскольку анатомическое расположение ПЖ не позволяет проводить непосредственное измерение микроциркуляторных показателей, ряд авторов предлагает использовать метод лазерной допплеровской флоуметрии (ЛДФ) для накожной регистрации кровотока в зоне проекции ПЖ, исходя из представления о том, что состояние микроциркуляции в этой зоне отражает соответствующие процессы в органе [1, 3].
Накожный датчик аппарата ЛАКК-02 (НПП «ЛАЗМА», Россия) располагали в точке между мошонкой и задним проходом по срединной линии и регистрировали особенности микроциркуляции [12, 13]. При обработке ЛДФ-грамм с использованием программного обеспечения определяли средний поток крови (М, перф.е.), индекс эффективности микроциркуляции (ИЭМ, у.е.) и показатель шунтирования (ПШ, у.е.).
М – среднее арифметическое значение показателя микроциркуляции, измеряемое в перфузионных единицах (рис. 1, 2). Изменение М (увеличение или уменьшение) характеризует соответственно повышение или снижение перфузии. Немаловажным показателем служит ИЭМ, который определяется как соотношение активного и пассивного механизмов регуляции кровотока и отражает поступление кислорода и питательных веществ в ткани. Вычисляют ИЭМ по формуле: ИЭМ = АmaxLF/АmaxCF + AmaxHF, где Аmax – максимальная амплитуда; LF – низкочастотные колебания кровотока; CF – пульсовые волны; HF – высокочастотные колебания кровотока.
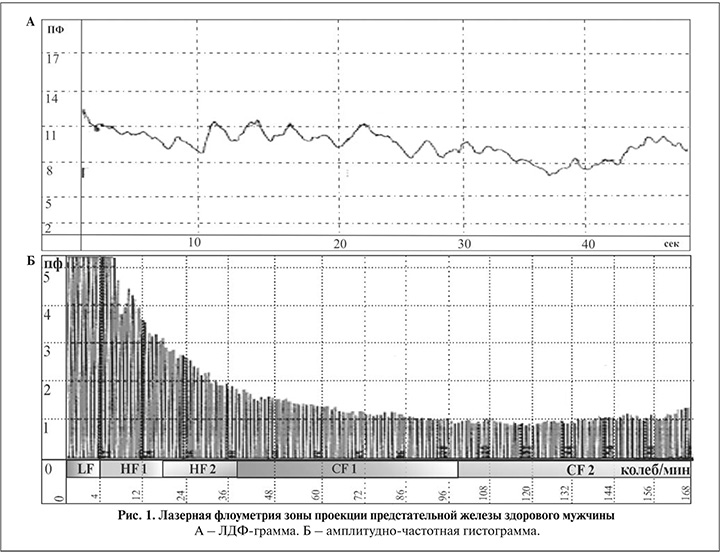
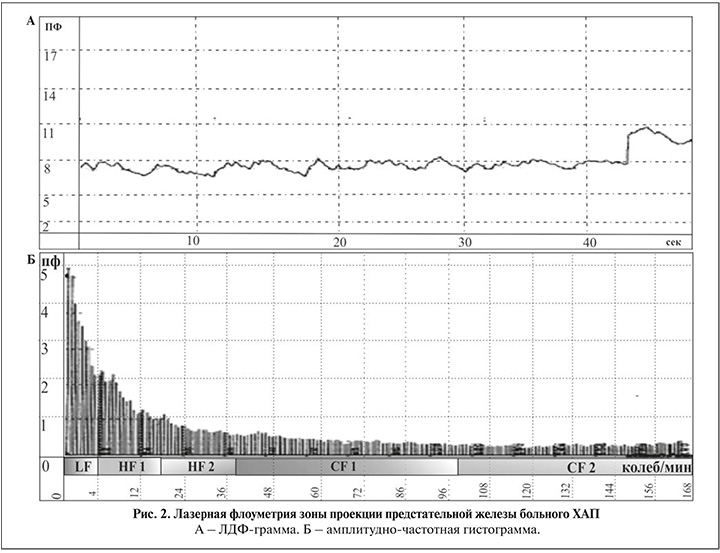
Показатель шунтирования – соотношение миогенного и нейрогенного тонусов – отражает степень шунтирования кровотока и ишемию ткани [12, 13].
Исследование гемодинамики ПЖ осуществляли при помощи ультразвуковой допплерографии в импульсно-волновом режиме. При динамическом исследовании в режиме цветного сканирования выбирали сосуд с оптимальными визуальными параметрами, которые позволяли определить этот сосуд как один из магистральных и произвести запись допплеровского спектра с качеством, пригодным для анализа. Такими параметрами служили крупный диаметр сосуда (в среднем 0,072±0,004 см), наличие в проксимальном его отделе более мелких ветвей, отсутствие извитости сосуда и расположение его под острым углом (менее 70°) к оси сканирования. В качестве критериев оценки особенностей ультразвуковой допплеровской гемодинамики были выбраны линейная систолическая скорость (Vp, см/с) и индекс резистентности (RI, у.е.) [14].
Распределенные на 2 группы по 15 человек пациенты получали одинаковую лекарственную терапию, направленную на купирование воспалительного процесса и нивелирование дизурической и болевой симптоматики. В качестве средства для нормализации мочеиспускания был выбран препарат альфузозин по 10 мг 1 раз в день, курс – 30 дней. На фоне приема данного препарата не развивается ретроградная эякуляция, что определяет его как лекарственное средство выбора для пациентов, реализующих свою репродуктивную функцию. В качестве обезболивающего использовали ректальные свечи с диклофенаком по 100 мг 1 раз в день. С учетом возможного негативного влияния НВПС на сперматогенез [15] курс лечения не превышал 5–7 дней. При выраженном болевом синдроме допускался ситуационный прием НПВС. Всем пациентам был назначен длительный (28 дней) прием антибактериального препарата левофлоксацина по 500 мг 1 раз в день. Для коррекции параметров сперматогенеза использовали препараты L-карнитина по 2000 мг в сутки и α-липоевой кислоты по 600 мг/сут. Дополнительно назначали «Селцинк Плюс» по 1 таблетке 1 раз в день. Курс лечения составил 3 мес. с дальнейшей перспективой продолжить прием лекарственных средств до 6 мес.
В дополнение к вышеуказанной терапии пациенты 2-й группы выполняли дыхательные упражнения при помощи аппарата «Карбоник». Суть метода заключается в создании гиперкапнической гипоксии путем повышения парциального давления СО2 и снижения давления О2 во вдыхаемом воздухе. В этих условиях происходит стимуляция микроангиогенеза в органах и тканях, а следовательно, активизация микроциркуляции [16]. Дыхательные тренировки проводились в течение 3 мес. 4 раза в неделю. Продолжительность одного сеанса – 20 мин.
Через 90 дней всем пациентам, которые были включены в выборку, выполнялись контрольные обследования.
С целью оценки динамики клинико-лабораторного течения ХАП проводилось анкетирование NIH-CPSI и микроскопия секрета простаты. Изменение в репродуктивной функции оценивалось по данным спермограммы с определением уровня фрагментации ДНК сперматозоидов. Контрольный анализ микроциркуляторных и гемодинамических показателей предстательной железы осуществлялся при помощи лазерной флоуметрии и ультразвуковой допплерографии.
Статистическую обработку данных выполняли в программах IBM SPSS Statistics, 23 и Excel, 2007 for Windows с определением медианы (Ме), верхнего и нижнего квартилей (Q1–Q3). Межгрупповые различия оценивали при помощи U-критерия Манна–Уитни, различия в рамках группы до и после лечения – W-критерия Вилкоксона. Для исследования связей качественных признаков использовался критерия χ2.
Результаты. Степень выраженности симптомов ХАП, по результатам опросника NIH-CPSI в обеих группах, выглядела следующим образом. На контрольном осмотре через 30 дней большинство пациентов отмечали положительную динамику, уменьшение болевого синдрома, выраженности расстройств мочеиспускания. В 1-й группе до лечения сумма баллов по домену «Боль» составляла 9 (7,5–11,5), через 30 дней – 3 (3–4,5) (p=0,001), во 2-й группе – 10 (6,5–11,5) и 3 (3–4,5) соответственно (p=0,001). На очередном осмотре через 90 дней результаты анкетирования показали, что у пациентов 1-й группы болевая симптоматика возвращалась (6 [6–7,5] баллов), тогда как у пациентов 2-й группы сохранялась стойкая ремиссия 2 (2–3) (p<0,001).
Исходная балльная оценка по домену «Мочеиспускание» у пациентов 1-й и 2-й групп составила 4 (2–4,5) и 3 (3–4) соответственно, после лечения – 2 (1–2) и 1 (1–2) соответственно. Статистической значимости различий между группами не выявлено (p=0,056).
У всех пациентов на этапе включения в исследования по результатам микроскопии секрета ПЖ было подтверждено наличие воспалительного процесса. Через 90 дней в 1-й группе количество пациентов с нормальным содержанием лейкоцитов в секрете ПЖ (до 10 в п/зр) составило 26% (4 из 15), тогда как во 2-й группе – 46% (7 из 15) (p>0,05, критерий χ2).
Анализ результатов лечения пациентов с ХАП/СХТБ показал, что медикаментозная терапия положительно влияет на параметры спермограммы. До лечения у пациентов 1-й группы олигозооспермия отмечалась у 8 пациентов, в результате лечения только 2 пациентам не удалось достичь нормализации показателя. Медиана концентрации сперматозоидов до лечения в 1-й группе составила 14 (9,5–17) млн/мл, после лечения – 17 (15,5–21) млн/мл, показатель увеличился на 17% (121% исходного уровня, p=0,001). Во 2-й группе, где использовался эффект гиперкапнической гипоксии, прослеживалась аналогичная динамика. До лечения олигозооспермия наблюдалась у 8 пациентов, после лечения – только у двоих. Медиана концентрации сперматозоидов во 2-й группе до лечения составила 12 (10,5–17,5) млн/мл и 25 (18–30) млн/мл после лечения, увеличение показателя на 52% (208% исходного уровня, p=0,002) (табл. 1).
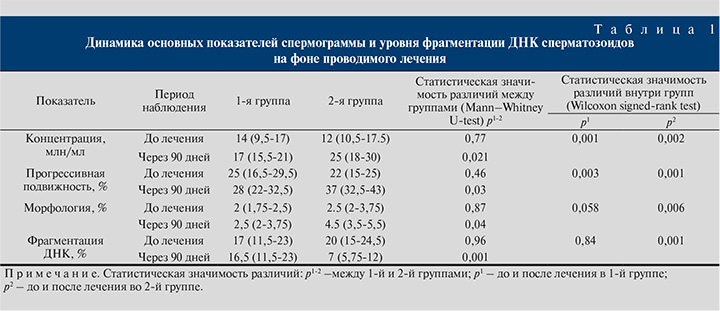
Что касается прогрессивной подвижности (ПП) сперматозоидов, то только у 3 пациентов с астенозооспермией из 12 удалось достичь нормального значения. Медиана доли ПП сперматозоидов в 1-й группе до лечения составила 25 (16,5–29,5)%, после лечения – 28 (22–32,5)%, увеличение показателя на 3% (112% исходного уровня, p=0.003). Во 2-й группе у 10 мужчин из 13 данный параметр нормализовался. Медиана доли прогрессивно подвижных сперматозоидов во 2-й группе до лечения составила 22 (15–25)% и 37 (32,5–43)% после лечения, увеличение показателя на 15% (168%, p=0.001) (табл. 1).
Сниженный процент морфологически нормальных сперматозоидов (МНС) по Крюгеру в 1-й группе до лечения наблюдался у 14 мужчин. В результате медикаментозного лечения лишь у 3 пациентов данный параметр принял нормальное значение (более 4%). Медиана доли МНС в 1-й группе до лечения составила 2 (1,75–2,5), после лечения – 2,5 (2–3,75)%, увеличение показателя – 0,5% (125% исходного, p=0,058). Во 2-й группе у 8 из 13 мужчин данный параметр соответствовал норме. Медиана доли МНС во 2-й группе до лечения составила 2 (1,75–2,75)%, после лечения – 4,5 (3,5–5,5)%, увеличение показателя на 2,5 (225%, p=0,006)% (табл. 1).
У 20 обследованных мужчин выявлено умеренное повышение фрагментации ДНК сперматозоидов: в 1-й группе у 9 пациентов, во 2-й – у 11. У 3 пациентов 1-й группы под влиянием исключительно медикаментозной терапии удалось достичь нормального значения фрагментации ДНК сперматозоидов. Медиана фрагментации ДНК сперматозоидов в 1-й группе до лечения составила 17 (11,5–23)%, после лечения – 16,5 (11.5–23)%, уменьшение показателя на 1,5% (97% исходного, p=0,84). Во 2-й группе у 10 мужчин из 11 данный параметр стал соответствовать норме. Медиана фрагментации ДНК сперматозоидов во 2-й группе до лечения составила 20 (15–24,5)%, после лечения – 7 (5,75–12)%, уменьшение показателя на 13% (35%, p=0,001) (табл. 1).
При сравнении параметров спермограммы после лечения между 1-й и 2-й группами выявлено статистически значимое различие в пользу 2-й группы, что указывает на более высокую эффективность применения медикаментозной терапии в сочетании с воздействием гиперкапнической гипоксии. Изменение медиан значений показателей выглядело следующим образом: концентрация сперматозоидов – 3 против 12 млн/мл (р=0,021), ПП – 3 против 15% (р=0,03), нормальная морфология – 0,5 против 25% (р=0,04), фрагментация ДНК сперматозоидов – 0,5 против 13% (р=0,001).
Основные изменения параметров микроциркуляции в зоне проекции ПЖ касались потока крови (М, перф.е.), индекса эффективности микроциркуляции (ИЭМ, у.е.) и показателя шунтирования (ПШ, у.е.). До лечения данные показатели статистически значимо отличались от показателей группы контроля, что расценено как микроциркуляторная недостаточность у больных ХАП (табл. 2).
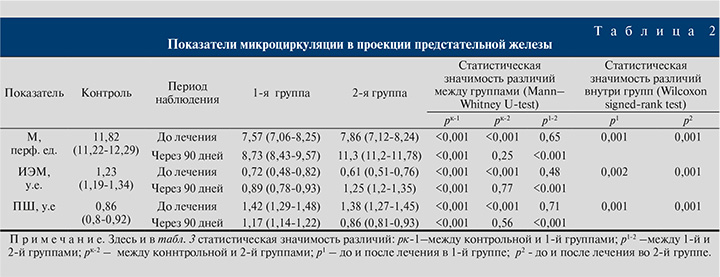
Через 90 дней после лечения в обеих группах произошли статистически значимые изменения показателей микроциркуляции, однако по сравнению с контрольной группой здоровых мужчин пациенты, получавшие исключительно медикаментозную терапию, не достигли нормальных значений, тогда как у пациентов, в лечении которых использовался эффект гиперкапнической гипоксии, параметры микроциркуляции соответствовали контрольным цифрам (см. табл. 2). Изменение медиан значений показателей выглядело следующим образом: средний поток крови – 1,16 перф. ед. против 3,44 перф. ед. (p<0,001), ИЭМ – 0,17 у.е. против 0,64 у.е. (p<0,001), ПШ – 0,25 у.е. против 0,52 у.е. (p<0,001).
Результаты допплерографического исследования гемодинамики в области ПЖ демонстрировали похожую зависимость. До лечения отмечено снижение пиковой систолической скорости кровотока и повышение индекса резистентности в обеих группах, что говорит о недостаточности перфузии области ПЖ. Через 90 дней после лечения показатели гемодинамики во 2-й группе приблизились к показателям группы контроля, тогда как у пациентов 1-й группы достоверно сохранялись признаки перфузионной недостаточности (табл. 3). Изменение медиан значений показателей выглядело следующим образом: пиковая систолическая скорость кровотока – 0,8 см/с против 3,62 см/с (p<0,001), индекс резистентности – 0,08 у.е. против 0,12 у.е. (p<0,001).

Обсуждение. В настоящее время диагноз «хронический абактериальный простатит» все чаще подвергается сомнению. Расширенное микробиологическое исследование секрета ПЖ выявляет в нем полимикробные аэробно-анаэробные ассоциации. В 39,4% случаев выявляются типичные патогены, наиболее часто вызывающие простатит, в 19,4% – преимущественно анаэробы, в 41,2% – аэробы и анаэробы примерно в равном соотношении. В экспериментальном исследовании было доказано, что и аэробы, и анаэробы способны индуцировать острый простатит со своими морфологическими особенностями [17].
Клинический опыт показывает, что границы между различными формами простатита размыты. Нарушение дренажной функции ПЖ, закупорка протоков ацинусов ПЖ гнойным секретом, снижение выделенного объема секрета после массажа ПЖ в отсутствие увеличения в нем количества лейкоцитов «симулируют» ХП категории IIIВ. Восстановление оттока секрета в результате лекарственных и физиотерапевтических воздействий позволяет устанавливать воспалительную природу ХП (категория IIIА), а применение адекватных методов выявления инфекций (не только посев, но и методы амплификации генов) – его истинную инфекционную природу (категория II) [18]. Следовательно, полученные в настоящем исследовании данные не исключают бактериальной природы ХП, так как бактериологические исследования проводились на стандартных питательных средах, не позволявших идентифицировать вероятную анаэробную инфекцию. Этим можно объяснить эффективность антибактериальной терапии.
Несмотря на отсутствие очевидного влияния ХАП/СХТБ на фертильную функцию мужчин, в исследовании E. Berg et al. [6] каждый пятый пациент демонстрировал концентрацию сперматозоидов ниже нормы ВОЗ, что подтверждает результаты Schagdarsurengin et al. [19], которые регистрировали олигозооспермию у 21,9% больных ХАП/СХТБ. В исследовании [6] общая и прогрессивная подвижность сперматозоидов, а также доля сперматозоидов с нормальной морфологией у пациентов с ХАП/СХТБ были значительно снижены по сравнению со здоровыми мужчинами. Однако данные параметры находились в пределах референтных значений ВОЗ в обеих группах. Также отмечено, что у каждого десятого пациента была выявлена астенозооспермия, у каждого пятого пациента – тератозооспермия. Эти результаты в основном подтверждают более ранние выводы Condorelli и соавт. и Fu и соавт. [7, 8], которые наблюдали снижение доли сперматозоидов с нормальной морфологией и прогрессивной подвижностью сперматозоидов у пациентов с ХАП/СХТБ, тогда как Schagdarsuregin и соавт. обнаружили негативное влияние на все три параметра [19].
Повышение фрагментации ДНК сперматозоидов при ХАП/СХТБ выявляется довольно часто, причем как при нормальных показателях спермограммы, так и при наличии отклонений в ней [20].
В нашем исследовании патоспермия в различных ее проявлениях у пациентов с ХАП отмечалась у всех 30 пациентов: олигозооспермия у 54% мужчин (16 из 30), снижение процента прогрессивно-подвижных сперматозоидов у 75% (25 из 30), тератозооспермия у 90% (27 из 30), повышение фрагментации ДНК сперматозоидов у 66 % (20 из 30), олигоастенотератозооспермия у 46% (14 из 30). В ходе исследования проанализирована динамика основных параметров спермограммы на фоне проводимого лечения и выявлена зависимость от характера терапии (см. табл. 1). Под влиянием исключительно медикаментозной терапии статистически значимо удалось воздействовать на концентрацию и прогрессивную подвижность сперматозоидов, тогда как морфология и фрагментация ДНК сперматозоидов значимо не изменились. Благодаря сочетанию медикаментозной терапии с эффектом гиперканической гипоксии удалось не только положительно влиять на морфологию сперматозоидов и индекс фрагментации ДНК, но и значимо повышать концентрацию и ПП сперматозоидов.
Распространена точка зрения [21–24], согласно которой увеличение концентрации лейкоцитов в секрете простаты и сперме сопровождается снижением доли подвижных и морфологически нормальных форм сперматозоидов. В то же время имеются работы, в которых оспаривается взаимосвязь ХП и лейкоцитоспермии, с одной стороны, и параметрами спермограммы – с другой [25]. Так как наличие лейкоцитов в секрете ПЖ являлось критерием включения в исследование, оценка влияния этого параметра на основные показатели спермограммы не входила в задачи исследования. Однако после лечения наличие лейкоцитов у пациентов 2-й группы наблюдалось в 1,7 раза меньше, чем в 1-й.
Имеются данные о независимых клинико-анамнестических факторах риска нарушения фертильности при ХП. Это длительность заболевания более 2,5 года, частота рецидивов более 2 раз в год, фиброзная и микролитиазная эхоструктура ПЖ, повышенная вязкость эякулята, нарушение опорожнения семенных пузырьков, снижение антиинфекционной резистентности семенной плазмы [25]. Микроциркуляторные и гемодинамические нарушения возможно также расценивать как фактор риска нарушения фертильности при ХП. У пациентов с ХАП/СХТБ в 1,5 раза по сравнению со здоровыми мужчинами снижается пиковая систолическая скорость кровотока и повышается индекс резистентности сосудов в артериальном русле ПЖ [14]. Результаты нашего исследования демонстрируют похожую зависимость. До лечения отмечалось снижение пиковой систолической скорости кровотока и повышение индекса резистентности в обеих группах, что говорит о недостаточности перфузии области ПЖ. Через 90 дней после лечения показатели гемодинамики во 2-й группе приблизились к показателям группы контроля, тогда как у пациентов 1-й группы сохранялись признаки перфузионной недостаточности.
Данные, полученные в исследовании, соответствуют основной теории патогенеза хронического абактериального простатита. Ряд авторов рассматривает в качестве главной причины развития ХАП/СХТБ нарушение локальной гемодинамики в ПЖ (как артериального, так и венозного генеза), приводящее к активации и поддержанию воспалительного процесса [10, 13].
Формирование патологической микроциркуляции при ХАП/СХТБ приводит к недостаточности антиоксидантной защиты, что ведет к чрезмерному влиянию окислительного стресса. Свободные радикалы играют немалую роль на фертильность мужчин с воспалительным процессом простат-везикулярного комплекса. Участие окислительного стресса к патогенетической цепочке ХАП/СХТБ стала предметом пристального внимания. Тщательное изучение и многочисленные исследования указывают на роль окислительного стресса в патогенезе ХП независимо от этиологической основы ХАП/СХТБ [26–28].
Все вышеуказанное формирует клиническую симптоматику ХАП/СХТБ, ухудшение функционального состояния полового тракта, приводящее к нарушению репродуктивной функции. Особенно важно, что нарушенный кровоток значительно затрудняет проникновение лекарственных средств в зону интереса, что ухудшает результаты лечения. В связи с этим базовая лекарственная терапия должна быть дополнена методом лечения, улучшающим микроциркуляторную гемодинамику ПЖ.
Заключение. Базисное медикаментозное лечение ХАП/СХТБ/хронического простатита категории IIIА в сочетании с эффектом гиперкапнической гипоксии способно не только положительно влиять на клиническое течение ХАП, но и значимо улучшать фертильные свойства эякулята за счет коррекции микроциркуляторной и гемодинамической недостаточности.



