Введение. Малоинвазивные методы, альтернативные традиционному хирургическому вмешательству, лечения доброкачественной гиперплазии и онкологических заболеваний предстательной железы прочно заняли место в арсенале современного уролога. Тем не менее, специфичность показаний и противопоказаний к использованию данных методов, а также высокая стоимость оборудования и подготовки специалистов существенно ограничивают их клиническое использование. В cвязи с этим минимально инвазивные методы лечения заболеваний простаты, характеризующиеся локальным воздействием на таргетные участки, такие как криохирургия, брахитерапия, дистанционная лучевая терапия, по-прежнему вызывают значительный интерес у клиницистов.
Одним из таких активно развивающихся полностью неинвазивных методов является облучение опухолевых тканей фокусированным ультразвуком высокой интенсивности (HIFU — High Intensity Focused Ultrasound). Механизм действия HIFU состоит в термической абляции, которая применяется для лечения различных доброкачественных и злокачественных опухолей, включая миому матки [1], рак предстательной железы [2], опухоли почек [3], печени [4], заболеваний мозга [5], а также некоторых видов метастатического поражения костей скелета [6].
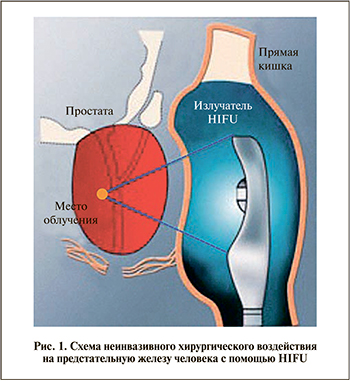 Воздействие на ткани простаты мощным ультразвуковым пучком обычно осуществляется трансректально, с фокусировкой на опухолевом очаге (рис. 1). В фокусе излучателя, где интенсивность ультразвукового поля максимальна, происходит поглощение энергии ультразвука, что вызывает локальный нагрев ткани выше 60ºС и термический коагуляционный некроз. Размеры каждого такого разрушения относительно невелики, порядка размеров рисового зерна, однако путем перемещения фокуса можно разрушить патологический очаг объемом до нескольких кубических сантиметров. Данный хирургический метод уже более 20 лет используется в научно-исследовательских и клинических центрах по всему миру и c его помощью пролечено более 70 тыс. человек [7]. Полученный опыт подробно освещен в медицинской литературе, а также суммирован в ряде содержательных обзоров [2, 8–11].
Воздействие на ткани простаты мощным ультразвуковым пучком обычно осуществляется трансректально, с фокусировкой на опухолевом очаге (рис. 1). В фокусе излучателя, где интенсивность ультразвукового поля максимальна, происходит поглощение энергии ультразвука, что вызывает локальный нагрев ткани выше 60ºС и термический коагуляционный некроз. Размеры каждого такого разрушения относительно невелики, порядка размеров рисового зерна, однако путем перемещения фокуса можно разрушить патологический очаг объемом до нескольких кубических сантиметров. Данный хирургический метод уже более 20 лет используется в научно-исследовательских и клинических центрах по всему миру и c его помощью пролечено более 70 тыс. человек [7]. Полученный опыт подробно освещен в медицинской литературе, а также суммирован в ряде содержательных обзоров [2, 8–11].
Например, в обзоре, основанном на результатах наблюдений за 625 пациентами с локализованным раком простаты, проходивших фокальную терапию с использованием HIFU в ряде ведущих европейских клиник, указаны показатели 5-летней безрецидивной, безметастатической, раковоспецифической и общей выживаемости, составившие 88, 98, 100 и 99 % соответственно [12].
Несмотря на несомненные достоинства метода традиционного трансректального HIFU с термоабляцией, при его клиническом использовании был выявлен ряд недостатков. Во-первых, тепловой режим воздействия приводит к относительно медленному нагреванию заданного объема ткани и сопровождается диффузией тепла вокруг патологического очага, что увеличивает вероятность сопутствующих повреждений мочевого сфинктера и нервно-сосудистых пучков. Это может стать причиной недержания мочи и сексуальной дисфункции [13]. Во-вторых, при тепловом нагреве практически невозможно осуществлять визуальный контроль лечения в режиме реального времени с помощью ультразвука, поскольку участок облучения, нагретый до температуры 60–80ºС, не отличается от окружающих тканей при визуализации в B-режиме.
Таким образом, HIFU-терапия является методом с доказанной клинической эффективностью, при этом обладающим некоторыми недостатками, такими как ограниченность визуального контроля за воздействием в режиме реального времени и недостаточно точный контроль границы получаемого термического разрушения.
В наших предыдущих исследованиях был предложен альтернативный подход, названный гистотрипсией с кипением, основанный на механической дезинтеграции ткани с использованием ультразвука высокой амплитуды, который изучается в рамках грантовых проектов и договоров между Университетом штата Вашингтон в Сиэтле (UW) и Московским государственным университетом (МГУ) в России [14]. При применении традиционного термического HIFU используется непрерывный режим облучения ткани гармоническими волнами относительно невысокой интенсивности (характерная амплитуда давления в фокусе – 2–8 МПа) в течение нескольких секунд. В то же время метод гистотрипсии с кипением реализуется посредством облучения опухоли короткими (до 10 мс) и редкими (время повторения импульсов примерно в 100 раз больше их длительности), но очень мощными импульсами (пиковое давление больше 60 МПа), в профиле которых в таргетной зоне за счет нелинейных эффектов формируются ударные фронты. Было показано, что такое воздействие приводит к механическому разрушению контролируемого объема ткани до состояния мелкодисперсной взвеси (суспензии) с фрагментами субклеточных размеров и резкой переходной зоной к неповрежденной ткани (менее 40 мкм) практически без проявления тепловых эффектов в зоне разрушения и вокруг нее. Кроме того, была показана специфическая чувствительность тканей к такому воздействию. Наименее чувствительными оказались ткани с наибольшим содержанием коллагена, такие как сосуды и соединительная ткань в зоне разрушения [15, 16]. Применительно к опухолям простаты это обеспечивает потенциальную возможность эвакуации продуктов разрушения путем их попадания в мочеиспускательный канал через отверстия выводных протоков железок предстательной железы и значительное сокращение восстановительного периода после лечения.
Отметим, что исследования по механическому разрушению тканей простаты мощным импульсным ультразвуком проводились ранее в Мичиганском университете. Был разработан метод гистотрипсии с использованием кавитационного облака, на основе которого исследовалась возможность чрескожного воздействия на предстательные железы животных [17, 18], а также проведены успешные доклинические испытания по разрушению предстательной железы собак при облучении через переднюю брюшную стенку [19]. Тем не менее, при проведении клинических испытаний на созданной системе (VortX, Histosonics) значимых изменений в предстательной железе добиться не удалось. Сложность реализации такого чрескожного метода на человеке была связана с малым размером трансперинеального акустического окна при значительной глубине фокусировки. Это не позволило использовать излучатели с большим углом схождения, требуемые в данной технологии. Кроме того, необходимость использования очень высокой пиковой мощности преобразователя исключала трансректальное применение метода.
Протокол облучения для гистотрипсии с кипением по сравнению с гистотрипсией, основанной на образовании кавитационного облака, не предусматривает столь высоких пиковых мощностей ультразвукового излучателя (1–2 кВт в первом случае и более 10 кВт во втором), что приводит к менее жестким конструктивным требованиям. Преобразователь может быть более компактным и менее фокусированным. Это делает гистотрипсию с кипением потенциально более пригодной для трансректального применения. В настоящее время ведутся работы по созданию доклинической установки для проведения таких исследований на собаках c использованием трансректального источника ультразвука [20].
Целью данной работы было показать принципиальную возможность неинвазивного механического разрушения тканей простаты человека методом гистотрипсии с кипением с помощью высокомощного импульсного фокусированного ультразвука.
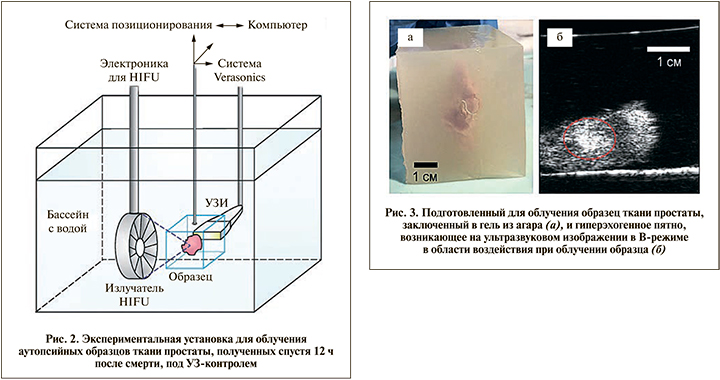
Материалы и методы. Экспериментальная установка по облучению образцов ткани предстательной железы человека показана на рис. 2. Облучение проводили в бассейне с дегазированной водой, по акустическим свойствам близкой к мягким тканям человеческого тела и имеющей малый коэффициент поглощения ультразвука, что делает ее идеальной проводящей средой между излучателем и образцом. В качестве источника мощного сфокусированного ультразвука использовали фокусирующий пьезокерамический излучатель с частотой 1,5 МГц, фокусным расстоянием 56 мм, апертурой (поперечным размером) 73 мм и углом фокусировки 81º (штриховые линии на рис. 2). Излучатель был подключен к электронной системе для управления облучением, состоящей из генератора, усилителя мощных импульсов и персонального компьютера. Регулировка величины входного электрического напряжения на усилителе позволяла увеличивать или уменьшать пиковое давление в фокусе излучателя.
Аутопсийные образцы ткани предстательной железы человека были получены при вскрытии через 8–12 ч после внезапной смерти. Затем без какой-либо фиксации образцы были перенесены в 0,1 М фосфатный буфер для транспортировки к месту облучения. Перед облучением были визуально определены и отделены наиболее однородные участки простаты в стороне от мочеиспускательного канала. Отдельное внимание обращали на то, чтобы в случае невозможности их полного удаления участки семявыносящих протоков находились на периферии образца и не создавали помех прохождению ультразвука из-за оставшихся после вскрытия пузырьков воздуха. Далее отделенные участки простаты размером от 2 до 4 см дегазировали в буферном растворе в течение 1,5 ч при остаточном давлении 0,1 атм. После этого образец ткани переносили в 5%-ный раствор агара с температурой около 39ºС. При остывании до температуры примерно 30ºС раствор агара переходил в состояние плотного желе и фиксировал участок ткани простаты для облучения (рис. 3, а), не влияя на распространение ультразвуковой волны.
Образец ткани простаты, заключенный в гель из агара (см. рис. 3, а), помещали в держатель и крепили к трехмерной системе позиционирования, позволяющей контролируемо перемещать образец внутри бассейна с водой во всех направлениях относительно излучателя HIFU (см. рис. 2), тем самым смещать положение фокуса и создавать разрушения в разных точках образца под УЗ-контролем (рис. 3, б).
Было проведено облучение четырех образцов тканей от трех аутопсийных органов. После воздействия два образца были использованы для проведения гистологического исследования фокальной области облучения, два других образца были рассечены на две части по условно серединной линии с целью визуальной оценки полученного эффекта.
Для гистологического анализа образцы фиксировали в 10%-ном забуференном формалине, обезвоживали в возрастающих концентрациях спиртов и заключали в парафин. Дополнительно для сравнения отдельно был зафиксирован контрольный участок ткани простаты, не подвергнутый облучению. Депарафинированные срезы окрашивали гематоксилином и эозином для оценки общей структуры, а также по Маллори на соединительную ткань и по Вейгерту с целью выявления эластических волокон.
Результаты. Первые эксперименты были направлены на определение параметров облучения, которые следует использовать для деструкции ткани простаты. В двух образцах были созданы одиночные очаги разрушения при использовании импульсов с различной длительностью, частотой следования и пиковой мощностью излучателя. При этом факт разрушения ткани определяли по появлению гиперэхогенного участка на ультразвуковом изображении при облучении (рис. 3, б) и визуально после рассечения образца. В ходе этих предварительных экспериментов был определен режим облучения, обеспечивший повторяемость получения разрушений: электрическое напряжение на излучателе – 240 В, длительность одного импульса – 5 мс, частота повторения импульсов – 2 Гц (2 импульса в 1 с), 200 импульсов на точку.
Один из образцов при наводке был условно разделен на две части (рис. 4, а). В каждой части было проведено облучение 16 точек на глубине около 7 мм внутри образца. При этом точки располагались на сетке размером 4×4 точки, а расстояние между соседними точками составляло 2 мм (рис. 4, а). Контроль процесса облучения образца (рис. 2) проводился при помощи линейного ультразвукового датчика L7-4, работающего в B-режиме под управлением исследовательской ультразвуковой системы с открытой архитектурой (V1, Verasonics, LTD., Kirkland, США) и расположенного на расстоянии 0,5–1,5 мм от образца. На рис. 3, б показано ультразвуковое изображение, полученное в данном эксперименте во время облучения. На снимке хорошо различимы неизмененная ткань простаты по периферии образца на фоне гипоэхогенного геля из агара и гиперэхогенные паровые пузырьки в месте воздействия в центре образца.
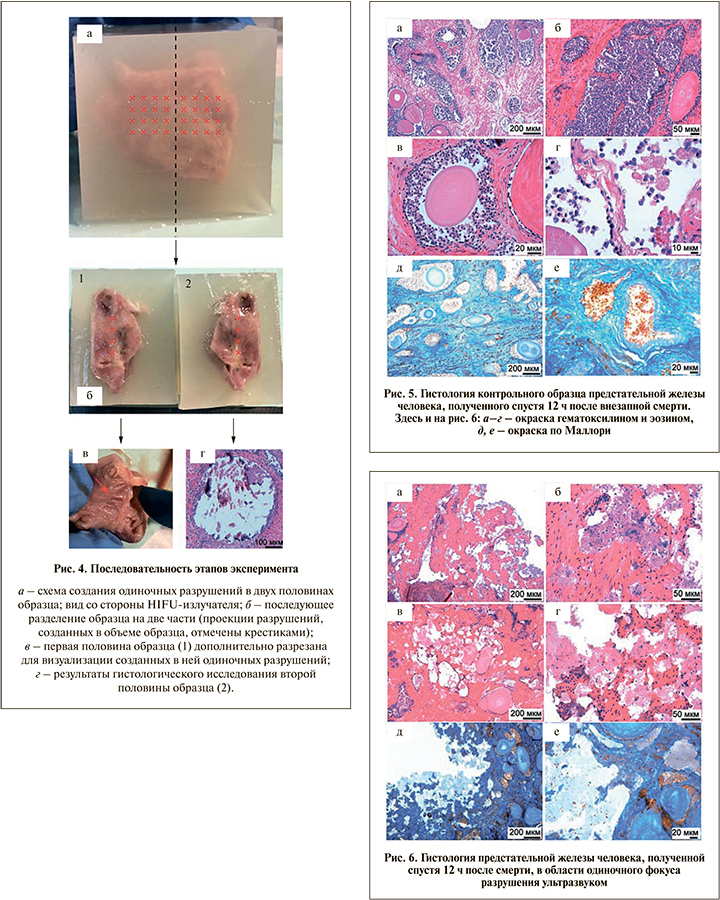
После воздействия две половины были разделены между собой. Половина образца (1) была дополнительно рассечена вдоль вертикальной оси для визуализации созданных в ней однофокусных разрушений, положение которых отмечено на рис. 4, б крестиками. Эти разрушения хорошо видны на рис. 4, в в виде четырех насечек размером примерно 1×2 мм каждая. После облучения половину образца (2) использовали для проведения гистологического анализа (рис. 4, г).
На снимках контрольного участка простаты, представленных на рис. 5, отмечена гиперплазия эпителия трубчато-альвеолярных желез. Внутри просвета виден накопленный секрет. Вокруг железистой ткани располагались гладкомышечные волокна с элементами соединительной ткани. При окраске по Маллори заметна нормальная структура желез и окружающей соединительной и мышечной ткани. Соединительная ткань окрашена в различные оттенки синего, гладкомышечные элементы и клетки крови в сосуде (рис. 5, в) – в красно-коричневый цвет. В целом гистологическое исследование контрольного образца не выявило нарушений целостности клеток. При анализе участка простаты, находящегося в фокусе разрушения (рис. 6), выявлены существенные изменения. Основная масса разрушенной ткани удалилась при гистологической проводке, однако в оставшемся содержимом визуализировались неразрушенные ядра клеток. Слабое эозинофильное окрашивание свидетельствует о том, что основным содержимым фокуса разрушения является гомогенная субстанция из цитоплазматических остатков клеток. При окраске по Маллори на соединительную ткань ее фрагменты в фокусе повреждения обнаружены не были. Таким образом, ткань в области фокуса была разрушена на субклеточные фрагменты до состояния мелкодисперсной жидкой суспензии.
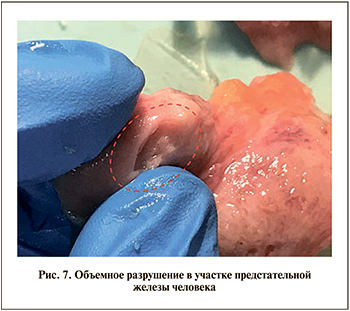
В данной группе одиночных разрушений гистологическое исследование подтвердило, что результатом воздействия ультразвуком в таргетной зоне является механическое разрушение ткани. Однако полученные разрушения (рис. 4, в) малы по размеру, их объем не превышает 2 мм3. Для создания разрушения большего размера один из образцов был облучен с использованием большего количества импульсов большей длительности. Фокус находился на глубине 5 мм внутри ткани простаты; облучение велось 900 импульсами длительностью 10 мс с частотой повторения 1 Гц при электрическом напряжении на излучателе 240 В. После рассечения образца разрушение было хорошо различимо визуально (рис. 7) и представляло собой полость объемом около 50 мм3 в неповрежденной ткани простаты, из которой при рассечении вытекло жидкое розоватое и полупрозрачное содержимое.
 Обсуждение. Результаты проведенных экспериментов ex vivo демонстрируют принципиальную возможность неинвазивного механического разрушения тканей простаты человека методом гистотрипсии с кипением под УЗ-контролем в режиме реального времени. Получено две серии одинаковых малых разрушений размером примерно 1×2 мм на двух образцах. Рассечение одного из них позволило наглядно визуализировать форму и размер разрушений. Гистологический анализ другого образца показал, что метод обеспечивает деструкцию ткани простаты на субклеточные фрагменты.
Обсуждение. Результаты проведенных экспериментов ex vivo демонстрируют принципиальную возможность неинвазивного механического разрушения тканей простаты человека методом гистотрипсии с кипением под УЗ-контролем в режиме реального времени. Получено две серии одинаковых малых разрушений размером примерно 1×2 мм на двух образцах. Рассечение одного из них позволило наглядно визуализировать форму и размер разрушений. Гистологический анализ другого образца показал, что метод обеспечивает деструкцию ткани простаты на субклеточные фрагменты.
Еще в одном образце было получено разрушение с суммарным объемом около 50 мм3, которое было хорошо видно при визуальном изучении образца и представляло собой полость в неповрежденной ткани простаты, заполненную жидкостью. В процессе облучения за счет образования парогазовых пузырьков в ткани простаты при УЗ-контроле выявлялся отчетливый гиперэхогенный локус, соответствовавший зоне воздействия. Через несколько минут после окончания процедуры эхогенность данной зоны менялась на пониженную за счет деструкции ткани простаты и образования жидкой суспензии.
Полученные результаты показывают, что предложенный метод потенциально может преодолеть основные недостатки традиционного термического режима HIFU. Изменение эхогенности ткани простаты в зоне воздействия позволяет корректировать положение фокуса в режиме реального времени в отличие от традиционного термического HIFU. Еще одним преимуществом предлагаемой методики является подбор адекватной акустической мощности воздействия по появлению гиперэхогенного локуса в заданной точке. Кроме того, разрушение не сопровождается тепловыми эффектами и диффузией тепла, которая может нанести вред здоровью пациента в виде перегрева тканей вокруг фокуса.
Отметим, что результаты данной работы были получены в неблагоприятных условиях с точки зрения наличия в образцах пузырьков воздуха, препятствовавших прохождению ультразвука. Несмотря на то что перед погружением в жидкий раствор агара образцы проходили дегазацию в буферном растворе, при перемещении между растворами в образец успевал попадать воздух. Это стало причиной значительного ослабления интенсивности ультразвука в фокусе и требовало использования большего количества импульсов для достижения разрушения.
Данной проблемы можно избежать при использовании в эксперименте других гелей, компоненты которых растворимы в воде при комнатной температуре, в отличие от порошка агара, который растворяется только в кипящей воде.
В таком случае дегазацию можно проводить непосредственно в растворе компонентов геля без переноса ткани из одного сосуда в другой. В последующих экспериментах планируется использовать раствор акриламида, который после добавления инициаторов полимеризации и сшивателя превращается в полиакриламидный гель при комнатной температуре.
Заключение. Использование метода гистотрипсии с кипением, основанного на механическом разрушении ткани, демонстрирует возможность узкофокусной деструкции ткани простаты с минимальным повреждающим воздействием на окружающие участки. Это позволяет надеяться на то, что в скором времени в арсенале клиницистов, занимающихся фокальной терапией и хирургией, появится новый альтернативный метод лечения заболеваний предстательной железы.



