В эпоху прецизионной хирургии использование малоинвазивных доступов при лечении большей части онкологических заболеваний мочеполовой системы стало возможным благодаря широкому распространению робот-ассистированных и лапароскопических технологий [1]. Оптимальным методом лечения локализированного и местнораспространенного рака простаты является радикальная простатэктомия (РПЭ). Для стадирования рака простаты наиболее информативным методом служит мультипараметрическая магнитно-резонансная томография (мпМРТ) [2]. Правильное стадирование заболевания влияет на выбор метода лечения (дистанционная лучевая терапия, радикальная простатэктомия, брахитерапия, криодеструкции), вида РПЭ (нервосберегающая РПЭ или РПЭ без сохранения сосудисто-нервных пучков) и на отдаленные онкологические результаты.
С целью планирования хода радикальной простатэктомии, а также для интраоперационной навигации хирурги по-прежнему нуждаются в оптимальном методе визуализации. В связи с этим широкую популярность стала набирать трехмерная виртуальная реконструкция, построенная на основании двухмерных изображений мпМРТ [1]. Объемная, напечатанная на 3D-принтере модель предстательной железы предоставляет дополнительную легко интерпретируемую информацию для предоперационного планирования оперативного пособия [3]. Следующим шагом в развитии виртуальных технологий стала возможность выполнения радикальной простатэктомии с применением дополненной реальности [4]. В данной статье представлен краткий обзор актуальных данных литературы в отношении использования 3D-моделирования при планировании радикальной простатэктомии.
Нами проведен несистематический обзор литературы в базах данных Medline, PubMed, Cochrane Database и Embase. После анализа были отобраны публикации, касающиеся использования 3D-моделирования при планировании радикальной простатэктомии. В данную работу отобраны исследования на английском языке с детальным описанием техники выполнения 3D-моделей, оценки влияния на оперативное планирование или интраоперационную навигацию при РПЭ.
Первые публикации по использованию 3D-виртуального моделирования в урологии относятся к 3D-моделям почек с опухолями. В Институте урологии и репродуктивного здоровья человека Сеченовского Университета с 2010 г. рутинно выполняется виртуальное трехмерное моделирование почки с опухолью на основе данных МСКТ с внутривенным контрастированием [5, 6]. Преимущество 3D-моделирования при опухолях почек по сравнению с данными МСКТ заключается в возможности совмещения всех четырех фаз исследования (нативная, артериальная, венозная, экскреторная) в единое изображение. Полученная виртуальная модель, которая в последующим может быть напечатана на 3D-принтере, содержит детальную информацию касательно особенностей почечного кровоснабжения, локализации, размеров и глубины проникновения опухолевого узла, расстояния опухолевого узла от синуса почки и крупных сосудов. Таким образом, 3D-моделирование почки с опухолью играет важную роль в планировании органосохраняющих пособий.
При предоперационном планировании РПЭ хирург руководствуется такими клиническими, лабораторными и инструментальными данными, как пальцевое ректальное исследование, уровень общего ПСА, ISUP по данным биопсии простаты, количество пораженных столбиков, их локализация и % поражения каждого столбика. Остеосцинтиграфия, мпМРТ, ПЭТ-КТ являются единственными визуализационными методами с широким применением в клинической практике. Более информативным, легкоинтерпретируемым исследованием может является 3D-моделирование предстательной железы.
Роль МРТ в планировании радикальной простатэктомии
Наиболее информативным методом визуализации местного распространения рака предстательной железы (РПЖ) остается мпМРТ. Согласно de Rooij и соавт., мпМРТ имеет чувствительность 61% и специфичность 88% в определении экстрапростатического распространения рака простаты. Недостатком метода является невозможность определения микроскопического экстракапсулярного распространения. [7] В случае экстракапсулярного распространения менее чем на 1 мм (по данным гистологического заключения) специфичность мпМРТ составляет 14%. При распространении более чем на 3 мм специфичность увеличивается до 100%. [8] Опыт врача лучевой диагностики играет большую роль в стадировании РПЖ. Futterer и соавт. установили, что чувствительность выявления экстракапсулярного распространения опытным специалистом лучевой диагностики составила 83% по сравнению с менее опытными коллегами, у которых чувствительность составила только 79% [9]. Крайне важно оценивать объем подозрительного участка, а также длину контакта подозрительного участка с капсулой простаты, так как они являются важным предиктором экстракапсулярного распространения РПЖ. Rosenkrantz и соавт. было отмечено, что длина контакта подозрительного участка с капсулой простаты сильнее коррелирует с экстрапростатическим распространением по данным планового гистологического исследования, чем объем подозрительного участка [10]. Согласно Baco и соавт., в случае наличия подозрительного участка по данным МРТ с длиной контакта с капсулой более 2 см (рис. 1, 2) вероятность выявления экстрапростатического распространения составляет 79% [11].

Важность оценки объема подозрительного участка, согласно МРТ, представлена в исследовании Knoedler и соавт. в 2014 г. Морфологическое исследование 18 916 предстательных желез после радикальной простатэктомии установило значимую корреляцию между объемом опухоли и клинической стадией, частотой инвазии в семенные пузырьки и метастатическим поражением лимфатических узлов. Большой объем опухоли значимо повышает риск локального и биохимического рецидива при медиане наблюдения 9,4 года [12]. При объеме подозрительного участка более 2,1 см3 увеличивается вероятность экстрапростатического распространения (чувствительность – 78,4%, специфичность – 73,5%) [13].
Для стандартизации методики проведения исследования и протокола мпМРТ малого таза в 2012 г. принята унифицированная система PI-RADS (Prostate Imaging – Reporting and Data System). Выполнение мпМРТ, согласно протоколу PI-RADS (рис. 3), позволило увеличить чувствительность и специфичность метода [14].
Такой метод исследования, как мпМРТ, несомненно имеет ряд не только преимуществ, но и ограничений. При использовании мпМРТ невозможно оценить форму простаты, точную локализацию подозрительного участка, расстояние от капсулы и площадь прилежания к капсуле предстательной железы.
Роль 3D-моделирования в планировании радикальной простатэктомии
Первый опыт использования 3D-моделирования предстательной железы для интраоперационной навигации во время лапароскопической РПЭ описан О. Ukimura и соавт. в 2008 г. [16]. Авторы разработали трехмерную модель предстательной железы, уретры и сосудисто-нервных пучков на основе данных ультразвукового исследования (УЗИ), МРТ и данных планового гистологического исследования. Режим дополненной реальности с наложением 3D-изображения простаты на операционное поле во время лапароскопической РПЭ позволил хирургу локализовать в реальном времени подозрительный участок, выявленный при биопсии. В 2014 г. О. Ukimura и соавт. предоставили новые результаты использования 3D-модели предстательной железы при робот-ассистированной нервосберегающей РПЭ [17]. Авторы отметили следующие ключевые особенности новой виртуальной модели: смоделирована поверхность простаты, выделен подозрительный очаг по данным УЗИ или МРТ (подтвержденный гистологически), контурированы сосудисто-нервные пучки и уретра, промаркирована локализация участков, откуда производился забор биопсионного материала. Использование 3D-модели сыграло важную роль в интраоперационной навигации, позволив выполнить деликатное рассечение тканей в непосредственной близости от пораженных участков. Согласно представленным данным, отрицательный хирургический край получен от 9 из 10 пациентов. Сравнив объем пораженной ткани предстательной железы при гистологическом исследовании с исходными данными 3D-модели предстательной железы, авторы отметили совпадение объемов в 82% случаев [17].
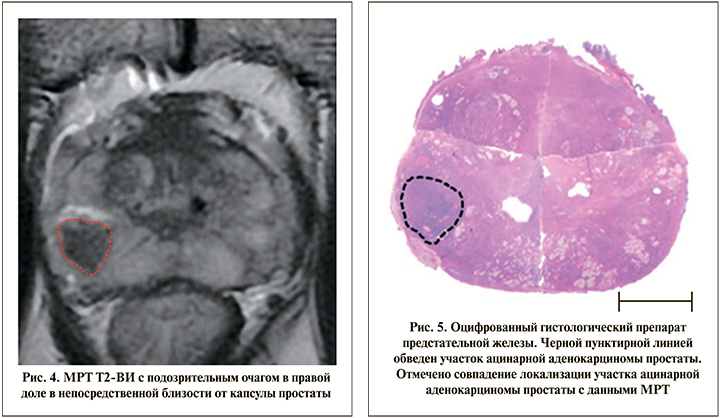
Shin и соавт. в 2016 г. описали преимущества трехмерной напечатанной модели предстательной железы при предоперационном планировании РПЭ, а также интраоперационной навигации [3]. На основе данных мпМРТ авторами напечатана индивидуальная трехмерная полупрозрачная модель предстательной железы реальных размеров с сосудисто-нервными пучками и подозрительным очагом (рис. 4–6). Локализация формы и размеры подозрительного очага соответствовали данным мпМРТ (наиболее высокий PI-RADS) и результатам фьюжн-биопсии. Таким образом, авторы отметили, что напечатанная 3D-модель позволила моделировать нервосберегаюшую РПЭ, выполнив более широкую диссекцию в области подозрительного участка. Во всех пяти случаях получен отрицательный хирургический край [3]. К недостаткам данного исследования стоит отнести небольшую выборку пациентов и отсутствие контрольной группы.

В 2018 г. Jomoto и соавт. разработали 3D-модель предстательной железы на основе данных 3T МРТ с контрастным усилением с акцентом на локализацию сосудистно-нервных пучков и добавочных и/или аберрантных пудендальных артерий [18]. На основе данных МРТ выполнена трехмерная виртуальная модель с вышеуказанными структурами. Всем пациентам выполнена робот-ассистированная РПЭ с использованием 3D-модели предстательной железы для интраоперационной навигации. Согласно данным авторов, 3D-модель позволила хирургам оценить форму предстательной железы, выполнить прецизионную диссекцию шейки мочевого пузыря, выявить ход сосудисто-нервных пучков. Результаты схожего исследования в 2018 г. предоставили Dasgupta и соавт. [19]. Авторы провели пилотное исследование с использованием 3D-модели предстательной железы пациентов с раком простаты высокого риска рецидива с наличием экстракапсулярного распространения. Трехмерные модели были созданы на основе данных МРТ, хирург руководствовался 3D-моделью при выполнении диссекции сосудисто-нервного пучка в зоне пораженного участка предстательной железы. Согласно опубликованным результатам, положительный хирургический край выявлен только в одном случае с патоморфологической стадией pT3b (1 из 10 пациентов).
В том же, 2018 г. Porpiglia и соавт. сделали огромный шаг в сторону прецизионной хирургии – выполнили робот-ассистированную РПЭ в режиме дополненной реальности. [4] При помощи функции TilePro при проведении робот-ассистированной РПЭ внутри хирургической консоли da Vinci произведено виртуальное совмещение 3D-модели предстательной железы с интраоперационной эндоскопической картиной в режиме дополненной реальности. Виртуальные модели были построены командой биоинженеров совместно с урологами на основе изображений мпМРТ высокого разрешения. В данном исследовании 16 пациентам с раком простаты cT2 выполнена интрафасциальная нервосберегающая РПЭ, остальным 14 пациентам со стадией cT3 проведена стандартная нервосберегающая техника с дополнительным забором ткани для оценки хирургического края на уровне предполагаемого, по данным мпМРТ, экстракапсулярного распространения. Процент положительного хирургического края в группе cT3 составил 30%, в группе сT2 положительных хирургических краев не обнаружено. Экстракапсулярное распространение рака простаты, по данным 3D-моделирования, подтверждено в 78%. Полученные данные свидетельствуют о том, что робот-ассистированная РПЭ в режиме дополненной реальности может повышать точность операции, что улучшит баланс между онкологическими и функциональными результатами.
В начале 2019 г. группа авторов во главе с Porpiglia и соавт. предоставили обновленные данные о своем опыте использования программного обеспечения M3DICS для выполнения трехмерной реконструкции предстательной железы [20]. В данном исследовании 30 пациентам (11 пациентов имели стадию cT2, 19 пациентов имели стадию cT3, по данным мпМРТ) выполнена робот-ассистированная РПЭ с дополненной реальностью. Для оценки соответствия локализации подозрительного очага на виртуальной модели с макропрепаратом в области предполагаемого подозрительного участка, а также в области предполагаемого экстракапсулярного распространения рака простаты интраоперационно были наложены металлические клипсы. При оценке корреляции отмечено, что во всех образцах (n=30) подтверждено расположение подозрительного участка в месте металлической клипсы, а также в 79% случаев (у 15 из 19 пациентов) подтверждено экстракапсулярное распространение. К недостаткам данного исследования можно отнести отсутствие контрольной группы.
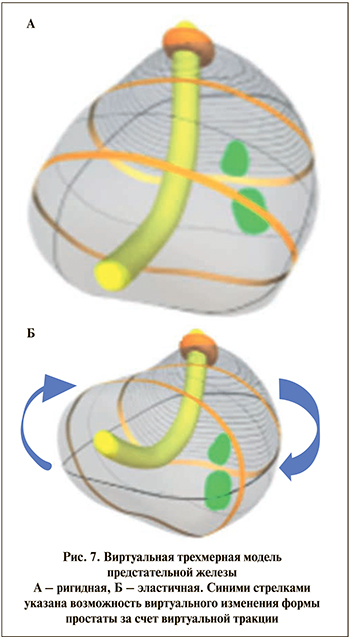
В середине 2019 г. Porpiglia и соавт. представили обновленную эластичную виртуальную 3D-модель простаты (рис. 7а и 7б) [21]. Особенностью обновленной модели являлась возможность модифицировать форму для лучшего сопоставления с интраоперационной картинкой при тракции простаты. При анализе и сопоставлении данных 3D-моделей и гистологических препаратов отмечено совпадение локализации подозрительного очага в 95,4% случаев (у 21 из 22 пациентов). Небольшое количество включенных в исследование пациентов не позволяет достоверно оценить значимость данного исследования.
Выводы. Технология 3D-виртуального моделирования и 3D-печати предстательной железы является важным шагом в развитии персонифицированной медицины. Она воспринимается как полезный инструмент для предоперационного планирования РПЭ, обучения врачей и консультирования пациентов. Согласно уже проведенным исследованиям, 3D играет важную роль в понимании перипростатической анатомии, локализации патологического очага, степени вовлечения сосудисто-нервного пучка, локализации положительных столбиков при биопсии. Возможность использования 3D-виртуальной модели предстательной железы в режиме дополненной реальности при выполнении робот-ассистированной РПЭ является ключевым моментом развития данной технологии, целю которой является снижение частоты положительного хирургического края.
Несмотря на последние технологические достижения, 3D-виртуальная модель простаты не используется в повседневной практике главным образом потому, что необходимы дальнейшие исследования с большим количеством пациентов и наличием контрольной группы. Проведение дальнейших исследований позволит расширить область применения методики и повысить эффективность оперативного лечения пациентов с раком простаты.



