Введение. Одной из наиболее частых причин симптомов нижних мочевыводящих путей (СНМП) у мужчин является доброкачественная гиперплазия предстательной железы (ДГПЖ). Известно, что более 30% мужчин в возрасте старше 80 лет не менее 1 раза в течение жизни подвергаются оперативному лечению по поводу данного заболевания [1–2]. При этом, согласно данным патоморфологических исследований, представленным в литературе, у мужчин моложе 40 лет ДГПЖ встречается крайне редко, а после 80 лет выявляется у 88% мужчин [3].
СНМП в среднем встречаются у 62,5% мужчин, при этом ирритативные симптомы встречаются у 51%, обструктивные – у 26%, а постмиктурические симптомы – у 17%. Согласно представленным в литературе данным, умеренные и выраженные СНМП наблюдались у 13% мужчин в возрасте до 50 лет и у 28% – после 70 лет [4–6]. Однако важно отметить, что СНМП не являются специфичными для ДГПЖ. Различные типы дисфункции мочевого пузыря и другие структурные или функциональные изменения мочевыводящих путей и окружающих тканей могут проявляться симптомами нарушенного мочеиспускания [4]. По некоторым данным, у половины пациентов с СНМП нет ДГПЖ, тогда как у 50% пациентов с ДГПЖ нет СНМП [7].
В настоящее время основными задачами лечения пациентов с ДГПЖ является устранение СНМП, а также предотвращение прогрессирования заболевания и развития серьезных осложнений, требующих хирургического вмешательства [1, 2]. Кроме того, современному урологу важно учитывать наличие сопутствующих заболеваний пациентов, так как большинство из них – мужчины старше 55 лет, а в этом возрасте, по статистике, чаще всего встречаются пациенты, имеющие сердечно-сосудистые заболевания. Выбор тактики лечения таких пациентов должен быть осознанным по причине высокого риска возникновения нежелательных явлений [8, 9].
Известно, что ДГПЖ, сопровождающаяся инфравезикальной обструкцией (ИВО), приводит к развитию выраженной гипертрофии детрузора, увеличению массы и ухудшению функционального состояния мочевого пузыря со снижением его контрактильной активности и развитием признаков детрузорной гиперактивности, и эти изменения сопровождаются ухудшением кровоснабжения мочевого пузыря [10]. Резко выраженная гипертрофия детрузора может негативно влиять на результаты лечения СНМП и ДГПЖ, в том числе и на функциональные результаты оперативного лечения. По некоторым данным, несмотря на ликвидацию ИВО, у 15–30% после трансуретральной резекции предстательной железы (ТУР ПЖ) сохраняются симптомы накопления, негативно влияющие на качество жизни этих больных [11, 12]. При этом доля больных с неудовлетворительным результатом операции (качество жизни по опроснику QoL>3 баллов) при толщине стенки мочевого пузыря 2,0–4,9 мм составила 9%, а при толщине стенки 5 мм и более – 39% [13].
Таким образом, помимо стандартных исследований, таких как определение объема предстательной железы, объема мочевого пузыря и остаточной мочи, оценка таких параметров, как масса мочевого пузыря и толщина детрузора, также важна [14, 15].
Во всех клинических рекомендациях в качестве препаратов выбора для лечения больных данной категории указаны α-адреноблокаторы (α-АБ); далее, терапия может преду-сматривать добавление ингибитора 5-α-редуктазы [1, 2]. Назначение α-АБ приводит к расслаблению гладкомышечных элементов предстательной железы и как следствие – к снижению степени обструкции [5]. Препараты данной группы, как правило, являются первой линией лекарственной терапии СНМП у мужчин благодаря быстрому началу действия, хорошей эффективности, а также высокому профилю безопасности [6]. Кроме того, в литературе представлен ряд работ, результаты которых свидетельствуют о возможности уменьшения гипертрофии мочевого пузыря на фоне терапии препаратами этой группы [16–18]. Тем не менее при назначении терапии α-АБ необходимо учитывать и минимизировать риски кардиоваскулярных осложнений.
Целью нашего ретроспективного анализа стало изучение влияния препарата Алфупрост® МР на уродинамические показатели, а также влияние проведенной терапии на толщину детрузора (ТД) и индекс массы мочевого пузыря (ИММП) у пациентов с гипертрофией детрузора и ИВО, вызванной ДГПЖ.
Материалы и методы. Нами были отобраны и изучены амбулаторные карты 30 пациентов с СНМП, вызванными ДГПЖ, которые получали лечение в течение 6 мес. препаратом Алфупрост® МР в виде монотерапии.
В ретроспективный анализ были включены карты пациентов, амбулаторные карты которых соответствовали следующим критериям:
- • мужчины с расстройством мочеиспускания умеренной степени выраженности (8–19 баллов по Международному индексу симптомов при заболеваниях простаты (IPSS, International Prostate Symptoms Score);
- • возраст 55–75 лет;
- • объем предстательной железы (УЗИ) от 40 до 70 см3;
- • объем остаточной мочи по данным ультразвукового исследования (УЗИ) <100 мл;
- • толщина детрузора по данным трансабдоминального УЗИ мочевого пузыря >5 мм (выраженная гипертрофия детрузора);
- • максимальная скорость потока мочи (Qmax) по данным урофлоуметрии 6–13 мл/с;
- • уровень простатспецифического антигена в крови (ПСА) <4 нг/мл;
- • прием препарата Алфупрост® МР в суточной дозе 10 мг на протяжении 24 нед.;
- • наличие записи повторного приема через 4, 12 и 24 нед. после начала приема препарата Алфупрост® МР.
Критерии невключения: подозрение на рак простаты или мочевого пузыря, конкременты мочевого пузыря или мочеточников, гематурия, оперативные вмешательства на органах малого таза, инфекции мочевыводящих путей, острый простатит, нейрогенная дисфункция мочевого пузыря, отягощенный аллергический анамнез, тяжелые сопутствующие заболевания.
На основании дневников отобранных амбулаторных карт у пациентов оценивали суммарный общий балл по шкале IPSS, суммарный балл по шкале IPSS по вопросам, касающимся симптомов опорожнения (вопросы № 1, 3, 5 и 6) и симптомов накопления (вопросы № 2, 4 и 7), Qmax, объема предстательной железы и объема остаточной мочи, удовлетворенности лечением по шкале оценки качества жизни (QOL, Quality of life), динамики изменения ТД и ИММП. ТД и ИММП определялись на основании данных трансабдоминального ультразвукового исследования мочевого пузыря при его наполнении не менее 150 мл. ИММП вычислялся путем определения объема мочевого пузыря, измеренного по наружному контуру, с вычитанием объема полости мочевого пузыря [19–22]. Также был проанализирован профиль безопасности применения препарата Алфупрост® МР, в том числе влияние на артериальное давление (АД) и частота сердечных сокращений (ЧСС), зафиксированные данные в картах нежелательные реакции через 4, 12 и 24 нед. терапии.
Математическая и статистическая обработка полученных данных проводилась с использованием стандартных пакетов программ Statistica (V7.0) и SPSS Statistics (V17.0). Для обработки данных использованы методы описательной статистики. Проверку выборок на нормальность осуществлялась при помощи теста Колмогорова–Смирнова. Сравнение выборок производилось с применением t-критериев Стьюдента, U-критерия Манна–Уитни и Т-критерия Уилкоксона. Взаимосвязь параметров выявлялась с помощью методов корреляционного анализа Пирсона и Спирмена. Анализ различия частот признаков в группах производился с использованием критерия Хи-квадрат с поправкой Йеитса. Отношение шансов (OR) и доверительного интервала (CI) производилось путем сопоставления частоты бинарного признака в группах с помощью четырехпольных таблиц.
Результаты. Средний возраст пациентов составил 64,7 (±4,96) года. Анализ результатов ретроспективного исследования показал улучшение СНМП уже начиная с 4-й недели лечения с последующей положительной динамикой, сохранившейся до 24-й недели терапии препаратом Алфупрост® МР (см. таблицу).
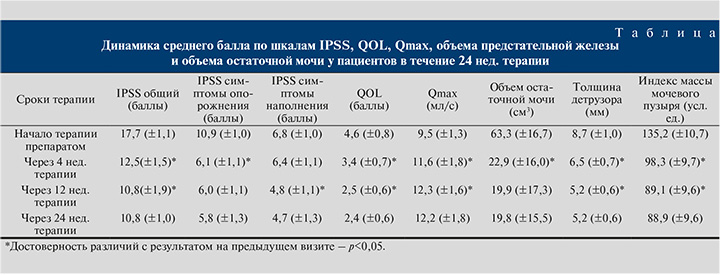
Общий средний балл по шкале IPSS через 4 нед. терапии достоверно (p<0,05) улучшился на 5,2 балла (рис. 1). Далее, положительная динамика сохранилась, и уже к 12-й неделе терапии общий средний балл по шкале IPSS статистически значимо (p<0,05) улучшился на 6,9 балла. За последующий период с 12-й по 24-ю неделю средний балл по шкале IPSS статистически значимо не изменился (p<0,05) и составил 5,8 балла. Таким образом, общий средний балл по шкале IPSS к 24-й неделе терапии улучшился на 39,0%.
При анализе результатов заполнения шкалы по вопросам, касающимся симптомов опорожнения (вопросы № 1, 3, 5 и 6), также выявлена значимая (p<0,05) положительная динамика (рис. 1). Уже к 4-й неделе терапии средний балл симптомов опорожнения по шкале IPSS статистически значимо (p<0,05) улучшился на 4,8 балла. Позитивная динамика по симптомам опорожнения продолжилась до 24-й недели терапии. Таким образом, симптомы опорожнения к 24-й неделе терапии улучшились на 46,8%.
При анализе результатов заполнения шкалы по вопросам накопления шкалы IPSS (вопросы № 2, 4 и 7) в первые 4 нед. терапии изменения были статистически не значимыми (p>0,05) (рис. 1). Положительная динамика сохранялась на протяжении последующих недель терапии. Таким образом, симптомы наполнения к 24-й неделе терапии улучшились на 30,9%.
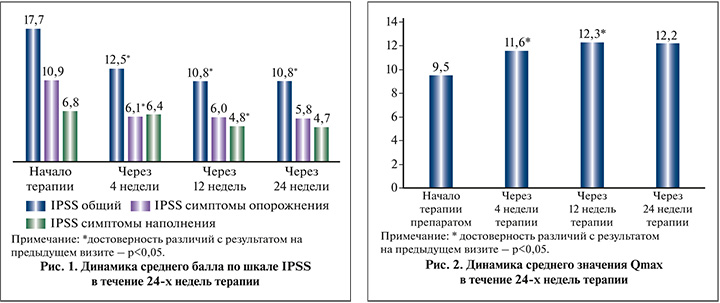
Средний показатель максимальной скорости потока мочи (Qmax) через 4 нед. терапии достоверно (p<0,05) увеличился на 2,1 мл/с (рис. 2). Среднее значение Qmax, зафиксированное через 12 нед. терапии, также было статистически значимо (p<0,05) выше по сравнению с результатом на предыдущем визите. Однако между результатами, полученными через 12 и 24 нед. терапии, достоверных различий не было выявлено. Таким образом, Qmax к 24-й неделе терапии улучшились на 22,1%.
Объем остаточной мочи терапии статистически значимо (p<0,05) уменьшился на 40,4 см3 уже через 4 нед. и в дальнейшем достоверно не изменялся (рис. 3).
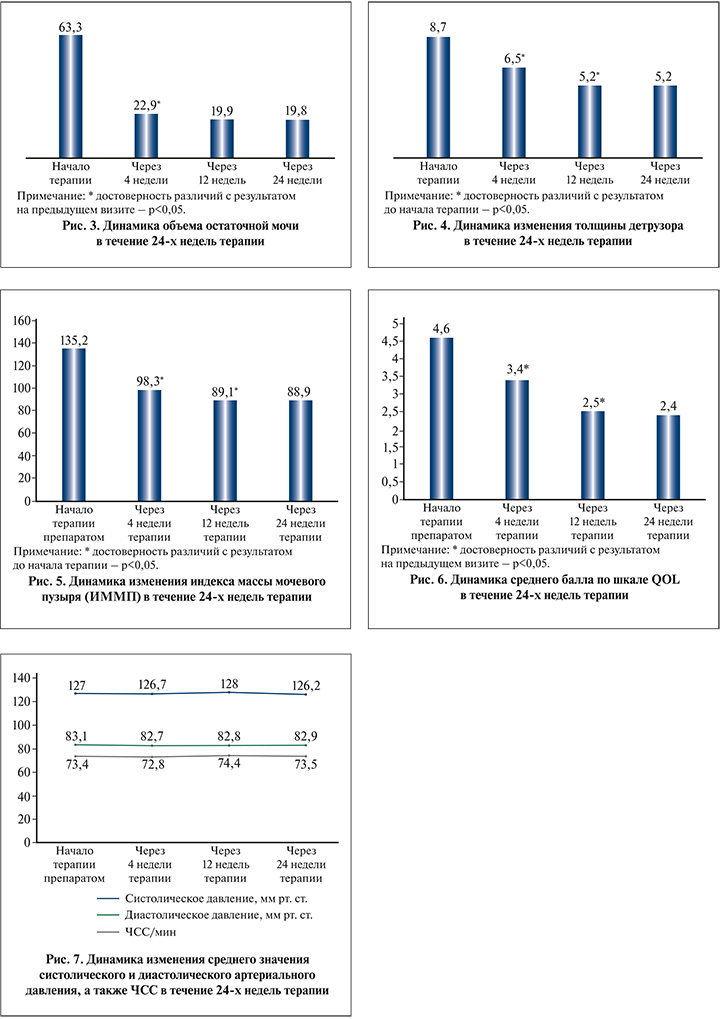
Среднее значение ТД через 24 нед. терапии уменьшилось на 3,5 мм (уменьшилась на 40,2%). Указанные изменения были статистически значимыми (p<0,05) (рис. 4).
ИММП через 24 нед. терапии статистически значимо (p<0,05) уменьшился в среднем на 46,3 усл. ед. (уменьшился на 34,3%) (рис. 5).
Качество жизни (QoL) через 24 нед. терапии достоверно (p<0,05) улучшилось на 2,2 балла (рис. 6).
По результатам оценки профиля безопасности за 24 нед. терапии, согласно данным, зафиксированным в картах, не было выявлено статистически значимого изменения АД и ЧСС (p>0,05) (рис. 7).
Также в амбулаторных картах пациентов не было зарегистрировано нежелательных реакций, оцененных нами как связанные с приемом препарата Алфупрост® МР.
Обсуждение. Ультразвуковая оценка степени гипертрофии детрузора может проводиться 2 методами: путем определения толщины стенки мочевого пузыря и путем расчета массы мочевого пузыря.
Известно, что толщина стенки мочевого пузыря и масса мочевого пузыря значительно выше у пациентов с инфравезикальной обструкцией, вызванной доброкачественной гиперплазией предстательной железы [23, 24]. Гипертрофия детрузора мочевого пузыря у данной категории больных в течение многих лет оценивалась эндоскопически (уретроцистоскопия) или рентгенологически (внутривенная урография с нисходящей цистографией или ретроградная цистография) по наличию трабекулярности стенки мочевого пузыря, образования ложных дивертикулов. Однако в течение последних десятилетий были описаны методики, позволяющие относительно легко оценивать изменения толщины детрузора и массы мочевого пузыря с помощью ультразвукового исследования [14–19].
Oelke и соавт. [25] измерили толщину стенки мочевого пузыря трансабдоминальным методом и представили результаты связи ИВО у мужчин и увеличение толщины стенки мочевого пузыря. Кроме того, в ходе своего исследования они проводили измерение при максимальной цистметрической емкости мочевого пузыря и отметили, что толщина детрузора остается неизменной даже при повторном наполнении >50% емкости мочевого пузыря. В дальнейших исследованиях была подчеркнута важность проведения измерений в трех точках по передней стенке мочевого пузыря при трансабдоминальном ультразвуковом исследовании [19, 20].
По данным ряда авторов, толщина стенки мочевого пузыря при его физиологическом наполнении в норме составляет порядка 2 мм, при умеренной гипертрофии детрузора она возрастает до 4 мм, а при резко выраженной гипертрофии увеличивается до 5 мм и более [14, 15]. Эта градация степени гипертрофии детрузора использовалась нами в нашей работе.
Более точным методом оценки степени гипертрофии мочевого пузыря является определение ИММП, для расчета которого многие авторы используют метод, описанный Кодзимой и соавт. в 1996 г., основанный на измерении толщины детрузора, расчете объема мочевого пузыря по наружному контуру с последующим вычитанием объема полости мочевого пузыря [19–22]. Именно этот метод мы и использовали в своей работе. Ранее проведенные исследования показали, что в норме показатель массы мочевого пузыря (ПММП) составляет 40–70 усл. ед. [13].
За последние годы появились работы, изучающие обратимость гипертрофии детрузора и влияние на нее различных терапевтических схем и лекарственных препаратов [16–18, 27]. Согласно представленным в литературе данным, выраженная гипертрофия детрузора является фактором, негативно влияющим на восстановление функции мочевого пузыря после ликвидации ИВО, а терапия α-АБ способствует более полному восстановлению функции мочеиспускания.
Так, в своем исследовании S. Milicevic и соавт. в 2012 г. изучили влияние терапии α-АБ на изменение массы мочевого пузыря у пациентов с гипертофией детрузора и ИВО на фоне ДГПЖ [16]. Согласно представленным авторами данным, в течение 24 нед. терапии масса мочевого пузыря уменьшилась на 56,9%, это сопровождалось уменьшением среднего балла по шкале IPSS, уменьшением объема остаточной мочи и повышением качества жизни пациентов по данным шкалы QOL. При этом наиболее значимые изменения показателей были зафиксированы уже через 4 нед. терапии, тогда как дальнейшая динамика была менее выраженной. Тем не менее необходимо отметить, что среднее значение объема предстательной железы у пациентов в исследовании было относительно небольшим и составило 35 см3. Таким образом, результаты пациентов с высоким риском прогрессии заболевания и с объемом предстательной железы 40 см3 и более могут различаться.
Профессор В. И. Кирпатовский и соавт. опубликовали серию работ, посвященных сравнительному анализу влияния противоишемической терапии и α-АБ на состояние мочевого пузыря, в том числе на толщину детрузора и массу мочевого пузыря [10, 18, 27]. Так, в статье 2020 г. представлены данные клинико-экспериментального исследования [27], в ходе которого авторы оценивали изменение толщины детрузора и ИММП после 1–1,5 месяцев терапии α-АБ больных ДГПЖ после ТУР ПЖ. Согласно опубликованным результатам, толщина детрузора уменьшилась на 23,2%, а ИММП – на 32,4% на фоне терапии α-АБ. При этом у этих пациентов были зафиксированы значимое снижение СНМП и более высокий уровень качества жизни по сравнению с контрольной группой.
Полученные в ходе нашего ретроспективного анализа результаты в целом соответствуют данным, представленным в литературе. Выраженность СНМП, согласно результатам заполнения шкалы IPSS, через 24 нед. терапии уменьшилась на 39,0%, но в большей степени за счет симптомов опорожнения, что, на наш взгляд, в первую очередь связано с устранением обструкции за счет действия α-АБ.
У всех пациентов была выявлена выраженная гипертрофия детрузора: ТД составила более 8,7 мм, а ИММП – 135,2 усл. ед. Согласно данным амбулаторных карт, через 24 нед. терапии Алфупрост® МР ТД уменьшилась на 40,2%, а ИММП – на 34,3%. На наш взгляд, полученные результаты могут быть связанными с восстановлением трофики детрузора и постепенным восстановлением функционального состояния мочевого пузыря. Блокада α-адренорецепторов, с одной стороны, снижает сопротивление выходного отдела уретры, которое может оставаться высоким при выраженной гипертрофии детрузора, а с другой – может улучшать микроциркуляцию в стенке мочевого пузыря за счет влияния на α-адренорецепторы интраорганных сосудов [28].
Главным показателем безопасности применения α-АБ является отсутствие риска развития ортостатической гипотензии и падения пациента. Альфа-блокаторы различаются по «индексу простатотропности». Чем выше значения индекса простатотропности α-АБ, тем активнее препарат поступает в орган-мишень и меньше риск развития побочных эффектов. Алфузозин обладает самым высоким объемом распределения в тканях предстательной железы среди уроселективных препаратов, таким образом препарат быстрее поступает в орган-мишень, минимизируя побочные эффекты [29]. Таким образом рекомендуется использование алфузозина (Алфупрост® МР) в лечении СНМП обусловленных ДГПЖ, у пациентов с гипертонической болезнью или без нее, практически исключив вероятность возникновения нежелательных реакций со стороны сердечно-сосудистой системы. Данная концепция была подтверждена многочисленными клиническими исследованиями, где продемонстрирована высокая клиническая и функциональная уроселективность алфузозина.
На протяжении всего периода наблюдения в амбулаторных картах пациентов не было зарегистрировано каких-либо нежелательных реакций, в том числе и со стороны сердечно-сосудистой системы, оцененных нами как связанные с приемом препарата Алфупрост® МР, что подтверждает высокий профиль безопасности применения препарата в клинической практике и соответствует данным, представленным в литературе [9].
Полученные результаты могут быть связаны в том числе и с особенностями фармакокинетического профиля препарата Алфупрост® МР, лекарственная форма которого производится по запатентованной технологии модифицированного высвобождения. Таблетка матричного типа препарата Алфупрост® МР cостоит из гидрофильного матрикса, куда погружено действующее вещество алфузозин. Гипромеллоза, входящая в состав таблетки, используется как гидрофильный матричный агент, благодаря которому обеспечивается пролонгированное высвобождение действующего вещества. При попадании таблетки в жидкую среду, гидрофильный матрикс впитывает большое количество воды без растворения с образованием гидрогеля. Модифицированное высвобождение алфузозина находит отражение в фармакокинетическом профиле препарата: максимальная концентрация алфузозина в плазме достигается через 9 ч после приема препарата по сравнению с тамсулозином в форме таблеток с контролируемым высвобождением (максимальная концентрация в плазме достигается в среднем через 6 ч) и силодозином (максимальная концентрация в плазме достигается в среднем через 2 ч 30 мин) [30–32]. Сбалансированные фармакологические свойства матричной таблетки Алфупрост® МР обеспечивают равномерное поступление алфузозина в сыворотку в течение 24 ч и отсутствие пиков концентрации препарата в сыворотке, оказывая тем самым минимальное и клинически незначимое воздействие на колебания как систолического, так и диастолического АД.
Заключение. В ходе нашего ретроспективного анализа было изучено влияние препарата Алфупрост® МР на уродинамические показатели, а также ТД и ИММП пациентов с гипертрофией детрузора и ИВО, вызванной ДГПЖ.
В течение 24-недельного лечения пациентов с ДГПЖ препарат Алфупрост® МР продемонстрировал не только клиническую эффективность в уменьшении симптомов нарушенного мочеиспускания и улучшении качества жизни пациентов, но и позитивное влияние в отношении уменьшения гипертрофии детрузора, о чем свидетельствует динамика изменения ТД и ИММП. Отсутствие каких-либо нежелательных явлений, в том числе клинически значимого влияния на артериальное давление и ЧСС, связанных с приемом препарата, позволяет нам рекомендовать Алфупрост® МР как эффективное средство для лечения СНМП при ДГПЖ, позволяющее уменьшать гипертрофию детрузора и обладающее высоким профилем безопасности и минимальными вазодилатирующими эффектами.



