Введение. Уротелиальный рак занимает 4-е место по распространенности злокачественных опухолей после рака предстательной железы (у мужчин), молочных желез (у женщин), легкого и колоректального рака [1]. В 90–95% случаев уротелиальный рак локализуется в мочевом пузыре [2]. При первоначальном диагнозе рака мочевого пузыря у 75–85% пациентов он ограничен слизистой (стадия Ta, карцинома in situ) или подслизистой оболочкой (стадия T1) [3]. Цистоскопия в белом свете (White light cystoscopy, WLC) по-прежнему остается «золотым» стандартом для выявления патологических поражений мочевого пузыря и обычно сопровождается биопсией или трансуретральной резекцией (ТУР) всех тканей, подозреваемых в злокачественных новообразованиях. Однако, используя только WLC, уротелиальные поражения, которые не являются четко видимыми макроскопически, могут быть пропущены, также не всегда четко видны границы распространения опухоли. Кроме того, при стандартной цистоскопии различие между доброкачественной и злокачественной уротелиальной тканью может быть затруднено, в особенности у пациентов с плоскими поражениями и воспалением в анамнезе. Для преодоления этих недостатков в клиническую урологическую практику были внедрены новые эндоскопические технологии – микроцистоскопия, фотодинамическая и узкоспектровая диагностика, компьютерная хромоэндоскопия, оптическая когерентная томография, Рамановская спектроскопия. Ряд из них широко применяется в клинической практике, другие по-прежнему являются экспериментальными [4].
Проблема надежного и всеобъемлющего распознавания опухолей существует в клинической онкологии с давних пор. Для более точной диагностики опухолей мочевыводящих путей необходима визуализация уротелия в деталях. Установка окончательного диагноза непосредственно во время проведения эндоскопического исследования зачастую является сложной и порой неразрешимой задачей. Обнаружение патологических изменений уротелия в большинстве случаев требует гистологического исследования фрагментов ткани измененных участков, что ведет к значительным временным и финансовым затратам. Таким образом, сохраняется потребность в увеличении разрешающей способности и новых возможностях современной эндоскопической аппаратуры.
Разработкой последних лет является конфокальная лазерная эндомикроскопия на основе зонда (Probe-based confocal laser endomicroscopy – pCLE) – это новая технология, которая дополняет стандартную эндоскопию в белом свете для обеспечения динамической визуализации клеточных структур уротелия in vivo в ходе проведения эндоскопического исследования и позволяет получать гистологическое изображение слизистой с возможностью оценки степени дифференцировки опухоли, что повышает возможности ранней диагностики. Клеточная морфология и тканевая микроархитектура уротелия могут быть исследованы с разрешением в микронном масштабе [5, 6]. На основе хорошо зарекомендовавших себя принципов конфокальной микроскопии и волоконной оптики pCLE позволяет проводить оптическую «биопсию» поражений слизистой оболочки в реальном времени с изображениями, сопоставимыми со стандартным гистопатологическим анализом. На сегодняшний день pCLE применяется для диагностики патологических изменений желудочно-кишечного тракта, дыхательных путей, желчных протоков и позволяет, например, отличить пищевод Барретта и неоплазию толстой кишки от доброкачественной ткани [7–14].
В настоящее время проведение конфокальной лазерной эндомикроскопии для диагностики уротелиальных образований мочевыводящх путей выполняют при помощи аппарата Cellvizio® (Mauna Kea Technologies; Франция). Первые работы были выполнены в 2009 г. [15–16]. В нашем исследовании рассматриваются результаты диагностики 38 пациентов с первично диагностированной опухолью мочевого пузыря.
Цель исследования: оценить диагностические возможности конфокальной лазерной эндомикроскопии (рCLE) при папиллярных опухолях мочевого пузыря и сопоставить результаты эндомикроскопии со стандартной гистопатологией.
Материалы и методы. В период с декабря 2019 по январь 2022 г. во 2-м урологическом отделении малоинвазивных методов диагностики и лечения ГКБ им. Д.Д. Плетнёва Москвы конфокальная лазерная эндомикроскопия (pCLE) выполнена 38 пациентам (27 мужчин и 11 женщин) в возрасте 41–82 лет с первично диагностированной опухолью мочевого пузыря. Всем пациентам на догоспитальном этапе по данным компьютерной томографии и магнитно-резонансной томографии с контрастным усилением было диагностировано образование мочевого пузыря различной локализации и размеров в стадии сТа–Т2. 26 пациентов имели одиночную опухоль и 12 – множественные опухоли мочевого пузыря. От всех пациентов получено информированное согласие на проведение исследования, осуществленного через Этический комитет.
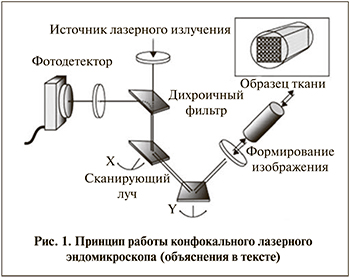
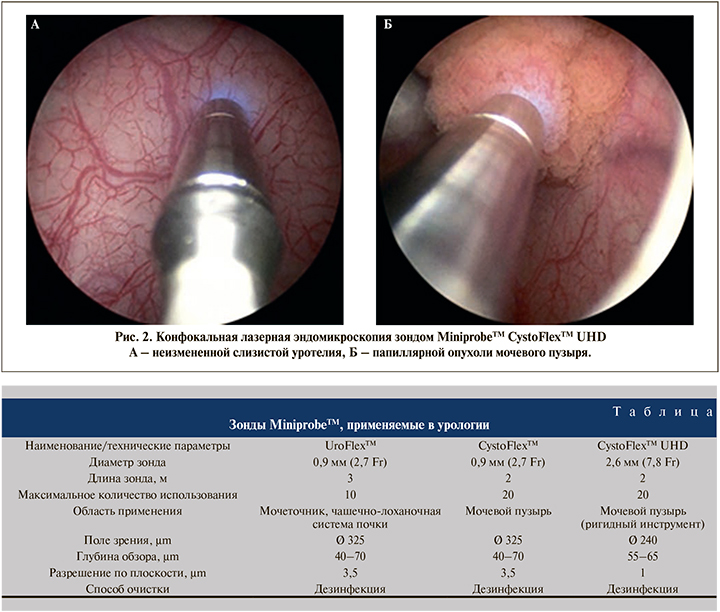
Система визуализации и принцип ее работы. Эндомикроскопия проводилась при помощи лазерного конфокального микроскопа Cellvizio® (Франция), который состоит из жидкокристаллического монитора, мини-зондов MiniprobeTM, предназначенных для диагностики опухолей мочевыводящих путей (CystoFlexTM, CystoFlexTM UHD, UroFlexTM), лазерного сканирующего блока F-400 (лазер с длиной волны 488 нм), трекблока, клавиатуры, педали дистанционного управления и конфокального процессора с программным обеспечением Mauna Kea Technologies (Франция) для получения изображений. Лазерный сканирующий блок включает лазерный источник, быструю сканирующую лазерную систему, набор линз разного вида, специальный коннектор для ввода лазерного луча в оптоволокно, детектор и несколько электронных плат, предназначенных для синхронизации и аналого-цифрового преобразования со значительным усилением и низким уровнем помех. Зонды MiniprobeTM, состоящие из тысяч оптических волокон, передают сканирующий лазерный луч в зону наблюдения и фиксируют флуоресцентный свет, отражаемый тканью. Одним концом зонд подключается к лазерному блоку, другой его конец проводится через рабочий канал эндоскопа до легкого контакта с тканью. Зонды изготовлены из пассивных биосовместимых компонентов и представлены различными моделями и типами в зависимости от предназначения и их оптических свойств (см. таблицу). Количество исследований, выполняемые 1 зондом, ограничены от 10 до 20 исследований.
Метод pCLE основан на принципе конфокальной флюо-ресцентной микроскопии. Лазер с длиной волны 488 нм, расположенный в лазерном сканирующем блоке, генерирует лазерный луч и передает его с помощью систем зеркал, качающихся во взаимоперпендикулярных направлениях. На выходе из блока лазерный луч синего цвета проходит через конфокальный мини-зонд и попадает на поверхность исследуемой ткани. Часть света поглощается, а индуцируемый лазером эффект флюоресценции вызывает желто-зеленое свечение тканей, которое идентифицируется конфокальным микроскопом, обрабатывается компьютером, что позволяет получить динамическое изображение клеток ткани на мониторе (рис. 1).
Для получения высококонтрастных эндомикроскопических изображений гистологической структуры уротелия необходимо использование контрастных средств, обладающих эффектом флуоресценции. Их можно применять как местно, так и внутривенно. Широко используется 10%-ный раствор флуоресцеина натрия, и, по данным мировой литературы, он практически не имеет серьезных побочных эффектов. Аллергические реакции составляют 1 случай на 22 тыс. больных [17].
Методика проведения конфокальной эндомикроскопии Пациентам под спинальной или общей анестезией выполнялась стандартная ригидная цистоскопия в белом свете резектоскопом 26 Fr (Karl Storz; Германия) с использованием оптики с углом обзора 12 или 300. Проводился тщательный осмотр всех подозрительных участков с применением узкоспектрового изображения или компъютерной хромоэндоскопии. После внутривенного введения 5 мл 10%-ного раствора флуоресцеина натрия выполнялась конфокальная лазерная эндомикроскопия неизмененной слизистой посредством зонда, а также эндомикроскопия выявленных папиллярных образований мочевого пузыря (рис. 2, 3). Проведение зонда MiniprobeTM CystoFlexTM UHD диаметром 2,6 мм (7,8 Fr) в тубус резектоскопа возможно при помощи телескопического мостика. Были визуализированы нормальные области уротелия, а также патологически измененная ткань. В целях минимизации артефактов, обусловленных контактной кровоточивостью и повреждением тканей, зонд во время исследования должен аккуратно соприкасаться с поверхностью уротелия без излишнего давления и травматизации тканей. Наиболее оптимальным следует считать перпендикулярное расположение зонда к поверхности слизистой/опухоли. Как только патологическая область при эндоскопическом осмотре идентифицирована, к ней подводят дистальную часть мини-зонда и, скользя по ее поверхности, выполняют процесс лазерного сканирования. Это сопровождается появлением на экране динамически меняющейся монохромной микроскопической картины структуры ткани, которая может быть записана и воспроизведена для детального анализа. Визуальная картина при конфокальной эндомикроскопии отлична от эндоскопической и в большей степени понятна специалистам-гистологам, поэтому для интерпретации полученных данных на первых этапах мы привлекали морфологов. Изображения и видео цистоскопии в белом свете были сохранены для каждого пациента отдельно. Выполнение записи видеопоследовательности эндомикроскопии и ее воспроизведение в режиме реального времени для изучения производились при помощи ножной педали дистанционного управления. Цифровые файлы эндомикроскопии пациентов были сохранены и в дальнейшем изучены.
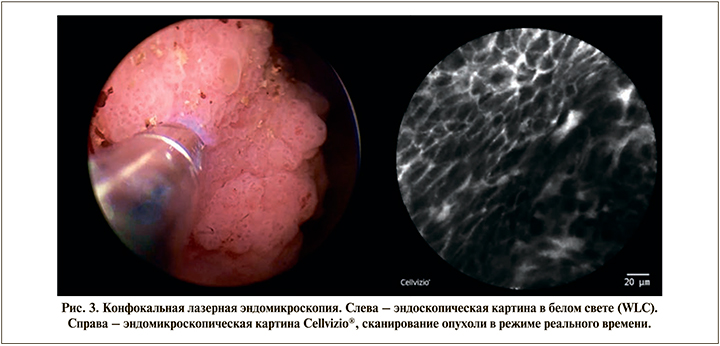
После получения эндомикроскопических изображений была выполнена стандартная или еn-block трансуретральная монополярная, биполярная или лазерная резекция мочевого пузыря. Затем образцы ткани были направлены на патоморфологическое исследование с окрашиванием гематоксилином и эозином (H&E). При патоморфологическом исследовании резецированной ткани были проанализированы и сопоставлены эндомикроскопические изображения данного материала, что позволило интерпретировать диагноз, подтвердить либо исключить наличие злокачественного роста и степень дифференцировки опухоли.
Результаты. Конфокальная лазерная эндомикроскопия (pCLE) опухолей мочевого пузыря проводилась in vivo в режиме реального времени после внутривенного введения флуоресцеина натрия 10%. Средняя продолжительность эндомикроскопии составляла 17±11 мин. Среднее время пребывание зонда в интересуемой зоне составляло 10±5 с. Системной токсичности или реакций гиперчувствительности при внутривенном введении флуоресцеина натрия не наблюдалось. Единственный побочный эффект, который наблюдался у всех больных, – это кратковременное пожелтение кожных покровов и янтарно-желтый цвет мочи, которые бесследно проходили в течение суток. Визуализацию эндомикроскопической картины можно наблюдать спустя 50 с после введения контрастного вещества.
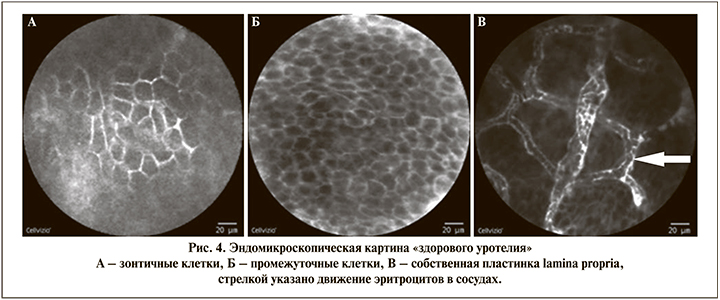
При конфокальной лазерной эндомикроскопии «здорового уротелия» (рис. 4) хорошо видны зонтичные клетки, плоские и большие по размеру, находящиеся наиболее поверхностно. Промежуточные клетки, меньшие по размеру и находящиеся более глубоко, визуализировались при более плотном контакте со слизистой мочевого пузыря. Собственная пластика (lamina propria) представлена сетью кровеносных сосудов. При эндомикроскопии «здорового уротелия» обычно хорошо видны эритроциты, движущиеся внутри сосудов собственной пластинки. Лучшее качество эндомикроскопической картины наблюдалось в первые 20 мин исследования.
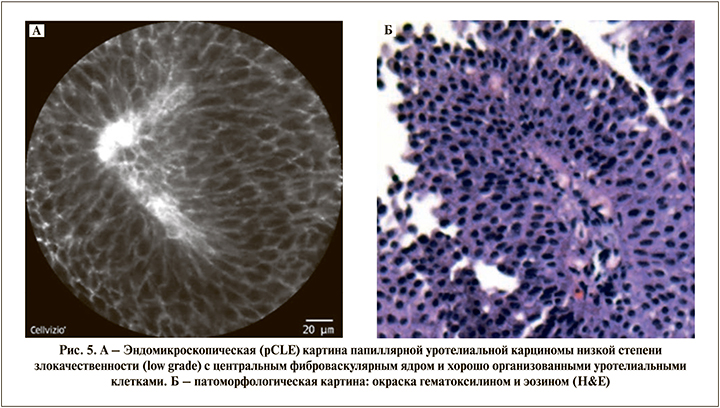
У 23 пациентов с папиллярными опухолями мочевого пузыря, видимыми при WLC цистоскопии, выявлены эндомикроскопические признаки уротелиальной карциномы низкой степени злокачественности. Высокодифференцированная уротелиальная карцинома (low grade) характеризовалась плотно расположенными мономорфными мелкими клетками и наличием фиброваскулярного ядра. Хорошо видно, что клетки располагаются кнаружи от фиброваскулярного ядра (рис. 5). Во всех случаях диагноз был подтвержден стандартным гистопатологическим исследованием.
У 12 пациентов с папиллярными опухолями мочевого пузыря, видимыми при WLC цистоскопии, выявлена уротелиальная карцинома высокой степени злокачественности. Низкодифференцированная (high grade) уротелиальная карцинома демонстрирует более искаженную микроархитектуру клеток. Определяются плеоморфные клетки неправильной формы с потерей клеточной сплоченности, нечеткими границами клеток и дезорганизованной сосудистой сетью (рис. 6). Во всех случаях диагноз был подтвержден стандартным гистопатологическим исследованием.

При карциноме in situ (CIS) эндомикроскопические изменения соответствовали наличию более крупных плео-морфных клеток, нечеткими границами клеток и обширными бесклеточными областями, что было выявлено лишь у одного пациента, которому выполнили pCLE подозрительной области и взяли ее на биопсию. Напротив, конфокальная визуализация ткани с воспалением, имевшим место у двух пациентов, показала свободно расположенные скопления более мелких мономорфных клеток в собственной пластинке слизистой. Этим пациентам также выполнили pCLE подозрительной области и взяли ее на биопсию. С учетом небольшого количества наблюдений интерпретировать возможности конфокальной лазерной эндомикроскопии при подобных изменениях уротелия не представилось возможным.
Обсуждение. В настоящее время цистоскопия в белом свете (WLC) является «золотым» стандартом в диагностике различных новообразований, в том числе и рака мочевого пузыря, а гистологическое исследование по-прежнему остается неотъемлемой частью в установке окончательного диагноза. Тем не менее WLC, как и новые эндоскопические технологии, направленные на улучшение оптической дифференциации исследуемой ткани, не может предоставлять гистопатологическую информацию и не может эффективно дифференцировать воспалительный процесс от злокачественного новообразования. Кроме того, биопсия требует сложных и трудоемких процедур и, таким образом, не всегда доступна для получения гистопатологической информации во время цистоскопии, что требует разработки новых эндоскопических методов для улучшения выявления и лечения рака мочевого пузыря.
Конфокальная лазерная эндомикроскопия (pCLE) – это метод оптической визуализации, позволяющий проводить оптическую биопсию патологической области в режиме реального времени in vivo. Данная технология позволяет генерировать динамическое гистологическое изображение ткани с 1000-кратным увеличением. pCLE в настоящее время широко используется в эндоскопии желудочно-кишечного тракта, демонстрируя высокую диагностическую точность [18].
Sonn и соавт. в 2009 г. впервые применили данную технологию в диагностике рака мочевого пузыря и охарактеризовали особенности pCLE. Было оценено применение pCLE для диагностики патологических изменений уротелия и установлены диагностические критерии измененного уротелия [15, 16].
В 2011 г. Adams и соавт. провели исследование, в котором сравнили эндомикроскопические изображения мочевого пузыря, полученные с помощью зонда 2,6 мм GastroFlexTM UHD, совместимого только с ригидным инструментом и применяемого в диагностике патологических изменений верхних отделов желудочно-кишечного тракта и зонда 1,4 мм AlveoFlexTM, совместимого с гибким инструментом и предназначенного для исследования дистальных отделов дыхательных путей. Данные эндомикроскопические зонды имеют схожие технические характеристики с теми зондами, которые на сегодняшний день разработаны для исследования мочевыводящих путей. Контрастный препарат применялся как внутрипузырно, так и внутривенно. С 1,4 мм зондом в рабочем канале гибкого эндоскопа сохранялась большая маневренность, все области мочевого пузыря были доступны для исследования, включая переднюю и боковую стенки, которые было сложнее осмотреть с помощью ригидного эндоскопа с 2,6 мм зондом. Как и ожидалось, видимость была снижена при использовании 1,4 мм зонда в гибком эндоскопе в результате уменьшения потока ирригационной жидкости. Помимо размера два зонда различались оптическими характеристиками, включая разрешение, глубину резкости и поле обзора, которые влияют на качество и интерпретируемость изображений, полученных в мочевом пузыре. Авторы отметили, что качество изображения от 2,6 мм зонда в целом было лучше, что также связано с большим количеством волоконно-оптических волокон, заключенных в зонд. С зондом 1,4 мм отдельные клетки казались меньше из-за большего поля зрения. Было доказано, что 2,6 мм зонд лучше детализирует клеточную морфологию [19].
В том же году K. Wu и соавт. из Стэндфордского университета, изучив 566 конфокальных видеопоследовательностей 66 пациентов, составили атлас эндомикроскопических изображений слизистой простатического отдела уретры, мочевого пузыря, мочеточника и чашечно-лоханочной си-стемы почки. Исследование верхних мочевыводящих путей выполняли с помощью 1,4 мм зонда ex vivo с учетом диаметра зонда и невозможности его проведения в инструмент [20].
В 2013 г. Т. С. Chang и соавт. в своем исследовании показали, что после 2-часового компьютерного обучения специалистов, состоявшего из отдельных обучающих и проверочных наборов с интерпретацией видео WLC и pCLE изображений мочевого пузыря, в дальнейшем при выполнении трансуретральной резекции опухоли мочевого пузыря и стандартной оценки патоморфологического материала при совместном применении WLC и pCLE показатель чувствительности составил 89%, а специфичность – 88% [21].
В исследовании, проведенном в 2017 г. Marien и соавт., изучали возможность использования pCLE при раке мочевого пузыря с двумя флуофорами: флуоресцеином натрия и гексиламинолевулинатом. Эндомикроскопию проводили ex vivo с помощью одинарного лазера Cellvizio® System (CVI – 488 нм) либо с помощью двойного лазера Cellvizio® Dual system (CVII – 488 нм; 660 нм). Исследование образцов ткани мочевого пузыря на CVI после введения гексиламинолевулината для получения гистологии в режиме реального времени оказалось невозможным, так как данный флуо-фор сильно окрашивает цитоплазму и дает плохие детали клеточной архитектуры. Напротив, применение флуоресцеина натрия дает хорошую внеклеточную архитектуру и информацию о ядерно-цитоплазматических аномалиях. В исследованиях на CVII четко наблюдали цитоплазму подозрительных клеток и ядер. Диагностическая точность в данном исследовании достигала чувствительности 80% и специфичности 100% [22].
В нашем исследовании мы подтвердили ранее предложенные диагностические критерии pCLE для папиллярных поражений мочевого пузыря с гистопатологической корреляцией. По всей видимости, конфокальная эндомикроскопическая диагностика воспалительных изменений и плоских опухолей мочевого пузыря может быть намного сложнее, чем ожидалось, что затрудняет точную дифференциальную диагностику между CIS и воспалительной тканью. Однако небольшое количество наблюдений ограничивает достоверность наших результатов, так как были проанализированы только один случай CIS и два случая воспалительной ткани.
Проведение рCLE требует постоянного прямого и аккуратного контакта зонда с тканью, что имеет решающее значение для полной и правильной оценки области исследования и может быть затруднено, особенно для новичков. Поэтому важен анализ записанной последовательности изображений, так как неадекватный контакт зонда с тканью может приводить к необъективному диагнозу. Тем не менее рCLE представляется многообещающей и полезной технологией, которая уже на этапе цистоскопии может влиять на тактику ведения пациентов с раком мочевого пузыря. Возможность визуализировать гистопатологические особенности уротелия в режиме реального времени во время ТУР, дифференцировать доброкачественные изменения от злокачественных, иметь информацию о степени злокачественности опухолевых клеток – вот та немалая дополнительная информация, которую может получить уролог уже на этапе первичной эндоскопии. С помощью рCLE невозможно определить стадию Т рака мочевого пузыря, однако возможно исследовать и оценить всю поверхность предполагаемого поражения, в то время как стандартная щипковая биопсия нередко может предоставлять патологическую информацию только об одной или нескольких четко определенных областях, что может приводить к ошибочному диагнозу. Представляется интересным исследование возможностей рCLE для оценки радикальности удаления опухоли при выполнении ТУР мочевого пузыря. Кроме того, рCLE также может быть использована для морфологической диагностики уротелиальных поражений, при которых стандартная биопсия по тем или иным причинам нередко бывает малоинформативной, таких как уротелиальная карцинома верхних мочевыводящих путей.
Заключение. Конфокальная лазерная эндомикроскопия является перспективным методом выявления злокачественных папиллярных образований мочевого пузыря независимо от формы опухоли, обладает высокой точностью дифференциации «здоровой» ткани от уротелиальных карцином низкой и высокой степеней злокачественности, предоставляя урологу при эндоскопическом исследовании гистологию опухоли в режиме реального времени, что также может влиять на качество выполнения ТУР мочевого пузыря. Необходимы дальнейшие исследования для получения более точных данных о диагностической ценности нового метода – лазерной конфокальной эндомикроскопии.



