Введение. Среди паразитарных заболеваний шистосомоз занимает второе место в мире, уступая только малярии. Около 95% случаев инфицирования обусловлено Schistosoma haematobium – возбудителем мочеполового шистосомоза (МШ) и Schistosoma mansoni [1]. По оценкам ВОЗ, в 2016 г. профилактическое лечение шистосомоза требовалось по меньшей мере 206,5 млн человек. Население более 52 стран подвергается высокому и среднему риску инфицирования МШ, где проблема искоренения этого заболевания до сих пор далека от разрешения [2]. По свидетельству Н. И. Брико и В. И. Покровского [3], глобализация, наблюдаемая в современном мире, способствует увеличению частоты случаев завоза «экзотических» инвазий и инфекций из стран тропического пояса на территорию нашей страны и в страны Европы [4–6]. В Российской Федерации регистрируются случаи МШ, «завезенного» туристами [7], а также описаны источники инфицирования и зарегистрированы спорадические случаи МШ [8, 9].
Возбудитель МШ, S. haematobium, проникает в кровеносную систему человека, внедряясь в кожу людей при контакте с инфицированной водой. С током крови шистосома проникает в органы малого таза. Отложенные в просвете вен яйца, минуя сосудистую стенку, располагаются в подслизистой оболочке мочевого пузыря и половых органов. При сокращении мускулатуры мочевыводящих и половых органов яйца шистосом устремляются в просвет мочевого пузыря и с мочой вымываются наружу. Покидая тело хозяина, часть яиц шистосом задерживается в тканях и вызывает абактериальное воспаление. Наличие паразитарных яиц вызывает образование специфических гранулем в тканях мочевого пузыря за счет механизма активной пролиферации иммунокомпетентных клеток [10]. В зависимости от фазы развития активность клеток шистосомных гранулем различается. Воспаление преобладает в ранней фазе, когда гранулема активно секретирует хемокины, цитокины и другие провоспалительные медиаторы. Со временем отмечается паренхиматозно-мезенхимальная трансформация клеток, и в структуре гранулемы начинают преобладать элементы фиброза с отложением кальция [11].
Таким образом, основные урологические осложнения МШ включают хроническую язву мочевого пузыря, специфические гранулемы, сморщенный мочевой пузырь, кальцификацию стенки мочевого пузыря, контрактуру шейки мочевого пузыря и стриктуру мочеточника, плоскоклеточную метаплазию (ПМ) [12]. Прогрессирование осложнений МШ может стать причиной смертельного исхода при нарастающей почечной недостаточности вследствие восходящего инфицирования верхних мочевыводящих путей и развития гидронефроза [13]. А. А. Shokeir [14] показал, что развитие МШ зачастую сопровождается хронической бактериальной суперинфекцией, что служит предрасполагающим фактором для плоскоклеточной трансформации клеток уротелия. Одним из наиболее серьезных осложнений МШ считается рак мочевого пузыря (РМП). Международным агентством по изучению рака (МАИР) S. haematobium включена в группу биологических канцерогенов [1].
Злокачественные опухоли мочевого пузыря шистосомной этиологии выявляются в запущенной стадии [15], что приводит к неудовлетворительным результатам лечения больных и их высокой смертности. Своевременная диагностика предопухолевых изменений уротелия при инвазии шистосом позволяет верифицировать начальные изменения.
Целью данного исследования было проанализировать современные возможности ранней диагностики предопухолевых изменений и злокачественных опухолей мочевого пузыря шистосомного генеза у жителей эндемичных регионов.

Материалы и методы. Проанализированы результаты наблюдения 181 больного, проживавшего в провинции Бенгела Республики Ангола, впервые обратившегося с жалобами на примесь крови в моче, в период с 2009 по 2010 г. Среди пациентов было 108 мужчин и 73 женщины, средний возраст которых составил 27,2 и 31,4 года соответственно.
Всем больным проведено комплексное обследование, включившее морфологическую: цитологическое исследование осадка мочи (ЦИОМ), лучевую (УЗИ органов малого таза) и эндоскопическую (цистоскопия) диагностику. В 142 (78,5%) наблюдениях подтвержден МШ, у 39 (21,5%) пациентов выявлен шистосомный РМП (шРМП). Все пациенты с шРМП прооперированы в урологическом отделении регионального госпиталя.
Как видно из таблицы, основной контингент пациентов с МШ составили жители сельской местности, мужчины трудоспособного возраста 25–27 лет, с продолжительностью макрогематурии от 3 до 6 мес. и наличием единичных участков измененного уротелия.
Результаты. Больные МШ (n=142) были обследованы амбулаторно. При ЦИОМ яйца шистосом выявлены у 38 (26,8%) человек, клетки ПМ – у 33,6%. По результатам УЗИ органов малого таза специфические гранулематозные изменения слизистой оболочки мочевого пузыря обнаружены у 28 (19,7%) больных, гидронефроз – у 7 (4,9%), кальцификация и утолщение стенки мочевого пузыря – у 10 (7%) и 99 (69,7%) обследованных соответственно. При эндоскопическом исследовании гранулематозные изменения мочевого пузыря выявлены у 68 (47,9%) пациентов.
 Как показало наше исследование, наиболее доступный в практике лабораторный тест мочи на шистосомоз не всегда позволяет подтвердить наличие у больного данного заболевания. Мочеполовой шистосомоз сопровождается значительными изменениями структуры стенки мочевого пузыря, и возможность их верификации довольно велика при сонографическом исследовании. Однако диагностика небольших, <2 см, гранулематозных образований с помощью данного метода может быть затруднена, поэтому цистоскопия должна проводиться всем больным МШ и при необходимости дополняться «холодной», или трансуретральной, биопсией с последующим гистологическим исследованием. При цистоскопии у 33 (23,2%) пациентов обнаружены «песчаные участки» и специфические гранулемы слизистой оболочки мочевого пузыря менее 2 см, крупные гранулематозные изменения размером свыше 2 см верифицированы у 35 (24,6%) пациентов. Плоскоклеточная метаплазия выявлена у большинства пациентов – в 101 (71,1%) случае.
Как показало наше исследование, наиболее доступный в практике лабораторный тест мочи на шистосомоз не всегда позволяет подтвердить наличие у больного данного заболевания. Мочеполовой шистосомоз сопровождается значительными изменениями структуры стенки мочевого пузыря, и возможность их верификации довольно велика при сонографическом исследовании. Однако диагностика небольших, <2 см, гранулематозных образований с помощью данного метода может быть затруднена, поэтому цистоскопия должна проводиться всем больным МШ и при необходимости дополняться «холодной», или трансуретральной, биопсией с последующим гистологическим исследованием. При цистоскопии у 33 (23,2%) пациентов обнаружены «песчаные участки» и специфические гранулемы слизистой оболочки мочевого пузыря менее 2 см, крупные гранулематозные изменения размером свыше 2 см верифицированы у 35 (24,6%) пациентов. Плоскоклеточная метаплазия выявлена у большинства пациентов – в 101 (71,1%) случае.
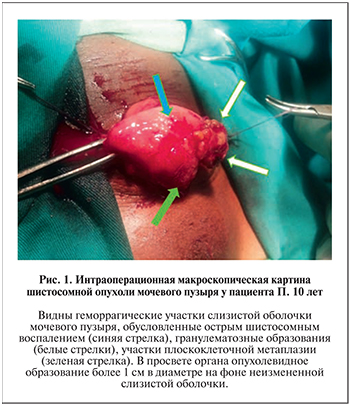
Типичная картина гранулематозных изменений слизистой оболочки мочевого пузыря при МШ представлена на рисунке, проиллюстрировавшем интраоперационную картину пациента П. 10 лет (мальчик), оперированного в связи с профузной макрогематурией, анемией II степени, ранее получавшего препарат Празиквантел (рис. 1).
По результатам обследования больные МШ были распределены в две группы с учетом объема планируемого лечения и дальнейшего динамического наблюдения. Первую группу составили 74 (52,1%) пациента с неосложненным МШ, у которых отсутствовали выраженные пролиферативные образования мочевого пузыря и верхних мочевых путей по данным УЗИ, а при цистоскопии выявлены «песчаные участки». Во 2-ю группу вошли больные МШ, страдавшие гранулематозными пролиферативными воспалительными изменениями – 68 (47,9%) человек, у 7 (4,9%) пациентов данной группы выявлен гидронефроз.
Обследование и лечение пациентов обеих групп проведены в условиях дневного стационара, развернутого на базе регионального госпиталя с входящим в его состав урологическим отделением. Подготовка больных к цистоскопии осуществлена с учетом возможного проведения трансуретральной резекции (ТУР) мочевого пузыря и использования наркоза.
Для выработки единых показаний к выполнению ТУР мочевого пузыря использованы рекомендации Европейской ассоциации урологов (ЕАU), согласно которым операция допустима в случаях:
- эндовезикальных пролиферативных воспалительных образований;
- язвенных образований (допускается выполнение коагуляции и биопсии);
- опухолевых образований (без сквозной перфорации стенки мочевого пузыря, в случаях планируемой радикальной цистэктомии).
«Песчаные пятна» могут быть подвергнуты только биопсии [6].
Пациенты 1-й группы (n=74) получали Празиквантел в стандартной дозировке (40 мг/кг) в сочетании с пероральной антибактериальной терапией, в результате которой достигнут положительный клинический эффект: купирование макрогематурии и дизурических расстройств. Контрольная цистоскопия была выполнена в 46 (32,4%) наблюдениях в среднем через 14±1,2 дня после окончания лечения, по результатам которой констатировали полный регресс патологических изменений слизистого слоя мочевого пузыря.
Во 2-й группе (n=68) 35 (24,6%) пациентам, у которых по данным цистоскопии выявлены гранулемы более 2 см в диаметре сливного либо множественного характера, выполнена ТУР мочевого пузыря, сочетавшаяся с эндоскопическим рассечением устья мочеточника в 4 (2,8%) случаях. Все больные получали Празиквантел (40 мг/кг) до операции и антибактериальную терапию в течение 7 дней антибактериальными препаратами фторхинолонового ряда. Контрольные исследования в этой группе включали ЦИОМ с тестом на МШ, УЗИ мочевого пузыря и почек. Повторная цистоскопия выполнена в среднем через 35±2,5 дня. Результаты контрольных исследований показали восстановление нормальной структуры слизистого слоя мочевого пузыря у всех больных после ТУР мочевого пузыря, умеренный гидронефроз сохранялся у 1 (0,7%) пациента. Из 33 (23,2%) больных, получавших только антибактериальную и антипротозойную терапию, гранулемы сохранялись в 7 (4,9%) случаях, в связи с чем выполнена ТУР мочевого пузыря; контрольные исследования этим больным осуществлены в том же объеме и выявлен полный регресс образований.
Средняя продолжительность пребывания в дневном стационаре составила 2,3±1,1 дня. При проведении эндоскопического лечения осложнений не зафиксировано. По окончании лечения обязательно проведение беседы с больным о профилактике развития МШ.
Обсуждение. Наиболее доступных методов диагностики (общий анализ мочи и УЗИ) не достаточно для диагностики МШ. Лечебно-диагностический алгоритм у пациентов с МШ должен включать проведение цистоскопии и по показаниям – ТУР мочевого пузыря с последующим гистологическим исследованием.
Как показали результаты наблюдений, применение консервативного лечения не всегда позволяет добиваться полного регресса пролиферативных образований. По свидетельству [16], нарушение пассажа мочи в результате осложнений МШ обусловливает дополнительное распространение канцерогенов по поверхности слизистой оболочки мочевого пузыря, что служит одним из факторов злокачественной трансформации уротелия. Таким образом, активная хирургическая тактика оправданна при крупных гранулематозных образованиях и, вероятно, способна снижать канцерогенный риск у данного контингента больных. Применение эндоскопической аппаратуры дает возможность выполнять этот вид вмешательства с минимальным количеством осложнений. Динамическое наблюдение за пациентами с МШ позволяет оценивать результаты лечения на любом этапе и применять малоинвазивные хирургические методики при неэффективности терапии. Считаем проведение контрольной цистоскопии больным с незначительными изменениями слизистого слоя мочевого пузыря нецелесообразным при условии правильного выполнения инициальной цистоскопии, четких показаний к консервативному лечению и адекватной терапии.
Заключение. Комплексная оценка патологических изменений стенки мочевого пузыря с использованием указанных диагностических методов имеет значение для определения показаний к хирургическому лечению в дополнение к антипаразитарной и антибактериальной терапии. Выполнять цистоскопию целесообразно всем больным МШ, поскольку при этом можно оценить объем поражения мочевого пузыря и определить показания к выполнению ТУР мочевого пузыря.



