 Геморрагическая лихорадка с почечным синдромом (ГЛПС) – острое природно-очаговое вирусное заболевание, которое вызывается вирусами рода хантавирус, характеризующееся поражением мелких кровеносных сосудов, почек, легких и других органов человека [1]. Широкое распространение ГЛПС в мире, отсутствие специфической профилактики и эффективной лабораторной диагностики на ранних стадиях развития заболевания определяют актуальность изучения новых высокоспецифичных и чувствительных биомаркеров для диагностики, прогнозирования осложнений и своевременного назначения терапии на ранних стадиях заболевания [1]. Кроме того, для оценки степени повреждения тканей-мишеней вирусом (эндотелия сосудов), а также для разработки и совершенствования методов защиты тканей-мишеней от воздействия вируса необходим специальный биомаркер, который позволяет обнаруживать изменения уже на самых ранних этапах развития патологического процесса. Микро-РНК (miRNAs) – короткие, в среднем 18–22 нуклеотида, одноцепочечные некодирующие РНК, которые регулируют экспрессию генов на посттранскрипционном уровне путем типичного связывания с 3’-нетранслируемой областью (3′-НТО) специфических мРНК-мишеней, что приводит к уменьшению экспрессии белка посредством блокады трансляции и/или способствует деградации мРНК (см. рисунок). По оценкам, более 60% всех белок-кодирующих генов человека непосредственно регулируются микроРНК [2]. Доказано, что микроРНК принимают участие в различных биологических процессах, включая клеточный цикл, апоптоз, пролиферацию и дифференцировку клеток [2]. К тому же микроРНК играют роль в патофизиологии многих заболеваний человека, включая вирусные инфекции (табл. 1) [3–7]. Это обусловлено, с одной стороны, дисрегуляцией клеточной экспрессии микроРНК, наблюдаемой при инфекционном процессе, характеризующейся увеличением или уменьшением экспрессии определенных микроРНК, с другой – способностью клетки секретировать или высвобождать некоторые из этих микроРНК во внеклеточную среду, что объясняет их присутствие в биологических жидкостях [8, 9]. Такие циркулирующие микроРНК устойчивы к воздействию нуклеаз, что делает их привлекательными в качестве потенциальных биомаркеров [8]. В данной работе будут описаны 6 микроРНК (miR-126, -146a, -410, -218, -503 и -155) с учетом их потенциальной роли в патогенезе ГЛПС. Также будут рассмотрены циркулирующие микро-РНК как возможные биомаркеры при ГЛПС.
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – острое природно-очаговое вирусное заболевание, которое вызывается вирусами рода хантавирус, характеризующееся поражением мелких кровеносных сосудов, почек, легких и других органов человека [1]. Широкое распространение ГЛПС в мире, отсутствие специфической профилактики и эффективной лабораторной диагностики на ранних стадиях развития заболевания определяют актуальность изучения новых высокоспецифичных и чувствительных биомаркеров для диагностики, прогнозирования осложнений и своевременного назначения терапии на ранних стадиях заболевания [1]. Кроме того, для оценки степени повреждения тканей-мишеней вирусом (эндотелия сосудов), а также для разработки и совершенствования методов защиты тканей-мишеней от воздействия вируса необходим специальный биомаркер, который позволяет обнаруживать изменения уже на самых ранних этапах развития патологического процесса. Микро-РНК (miRNAs) – короткие, в среднем 18–22 нуклеотида, одноцепочечные некодирующие РНК, которые регулируют экспрессию генов на посттранскрипционном уровне путем типичного связывания с 3’-нетранслируемой областью (3′-НТО) специфических мРНК-мишеней, что приводит к уменьшению экспрессии белка посредством блокады трансляции и/или способствует деградации мРНК (см. рисунок). По оценкам, более 60% всех белок-кодирующих генов человека непосредственно регулируются микроРНК [2]. Доказано, что микроРНК принимают участие в различных биологических процессах, включая клеточный цикл, апоптоз, пролиферацию и дифференцировку клеток [2]. К тому же микроРНК играют роль в патофизиологии многих заболеваний человека, включая вирусные инфекции (табл. 1) [3–7]. Это обусловлено, с одной стороны, дисрегуляцией клеточной экспрессии микроРНК, наблюдаемой при инфекционном процессе, характеризующейся увеличением или уменьшением экспрессии определенных микроРНК, с другой – способностью клетки секретировать или высвобождать некоторые из этих микроРНК во внеклеточную среду, что объясняет их присутствие в биологических жидкостях [8, 9]. Такие циркулирующие микроРНК устойчивы к воздействию нуклеаз, что делает их привлекательными в качестве потенциальных биомаркеров [8]. В данной работе будут описаны 6 микроРНК (miR-126, -146a, -410, -218, -503 и -155) с учетом их потенциальной роли в патогенезе ГЛПС. Также будут рассмотрены циркулирующие микро-РНК как возможные биомаркеры при ГЛПС.

Первичный транскрипт микроРНК (при-микроРНК, pri-miRNA) сначала транскрибируется в ядре с помощью РНК-полимеразы II, которая впоследствии расщепляется белками Drosha/Pasha в предшественник микроРНК (пре-микроРНК , pre-miRNA). Пре-микроРНК экспортируется из ядра в цитоплазму клетки с помощью белка Экспортин 5 (XPO5) и загружается на Dicer (рибонуклеаза из семейства РНКазы III); затем петля пре-микроРНК расщепляется, образуя двухцепочечную структуру, состоящую из зрелой микроРНК и антисмысловой микроРНК (микроРНК дуплекс, miRNA duplex). Последний обычно деградирует, тогда как ведущая цепь зрелой микроРНК включается в микроРНК-индуцированный комплекс сайленсинга (RISC), что приводит к подавлению экспрессии генов посредством связывания с 3′-НТО специфических мРНК-мишеней. В свою очередь микроРНК могут экспортироваться из клеток в биологические жидкости в составе внеклеточных везикул (активная секреция через экзосомы и микровезикулы) и быть связанными с рибонуклеопротеинами, в частности с белками Argonaute 2 (комплекс микро-РНК-Ago2). МикроРНК также обнаруживаются в апоптотических тельцах и бывают связанными с липопротеинами высокой плотности (ЛПВП).
МикроРНК и молекулярные основы патогенеза ГЛПС
Ядерный фактор каппа B (NF-kB) является ключевым фактором транскрипции в регуляции врожденного и адаптивного иммунного ответа на вирусную инфекцию. После активации в цитоплазме клетки NF-kB транспортируется в ядро, чтобы вызвать транскрипцию генов, кодирующих интерфероны (IFN) и про/противовоспалительные цитокины [10]. Yu et al. [11] показали, что увеличение синтеза интерферона бета (IFN-b), активированная регуляторным фактором интерферона-3 (IRF-3) и NF-kB, происходит в хантавирус-инфицированной клеточной линии эндотелиальных клеток (ЭК) EVC-304, а не в клетках со сниженной экспрессией Толл-подобного рецептора 4 (TLR4), что предполагает, что хантавирусная инфекция запускает TLR4-опосредованную активацию IRF-3 и NF-kB через миелоидный фактор дифференцировки 88 (MyD88) – независимый сигнальный путь врожденного иммунного ответа. Согласно другому исследованию [12], заражение хантавирусной инфекцией человеческих эндотелиальных клетках пупочной вены человека (HUVECs) активирует сигнальный путь серин/треонинкиназа (Akt)/NF-kB с последующим увеличением синтеза цитокинов/хемокинов и молекул адгезии [12]. Поскольку прямых цитопатических эффектов патогенных хантавирусов не наблюдалось, повышенная проницаемость сосудов может быть вызвана этим несбалансированным иммунным ответом, вызванным вирусной инфекцией.
Результаты исследования Chen et al. [13] показали, что живой хантавирус может индуцировать экспрессию miR-146a, NF-kB и провоспалительных цитокинов в HUVECs. Показано, что промотор miR-146a имеет два участка связывания с 3′-НТО мРНК NF-kB и NF-kB-зависимая экспрессия miR-146a может рассматриваться как регулятор врожденного иммунного ответа [14]. Хорошо известно, что miR-146a участвует в реакциях врожденного иммунитета и воспалительных реакциях при некоторых вирусных инфекциях [15]. Иными словами, Chen et al. [13] пришли к выводу, согласно которому эта NF-kB-зависимая индукция экспрессии miR-146a также происходит при хантавирусной инфекции, поскольку белки данного вируса, нуклеопротеин/гликопротеин (NP/GP), способствуют промоторной активности экспрессии miR-146a и NF-kB. Также авторы продемонстрировали, что miR-146a подавляет экспрессию IFN-b и способствует репликации хантавируса на этапах эксперимента с применением miR-146a mimic (мимики (mimics) – синтетические олигонуклеотиды, повышающие экспрессию целевой микроРНК ) и anti-miR-146a (антагомиры (antagomirs) – синтетические олигонуклеотиды, ингибирующие целевую микроРНК), что может быть механизмом, с помощью которого вирус избегал естественного иммунного ответа хозяина. IFN могут обеспечивать первую линию защиты от вирусных инфекций, а активированный NF-kB может напрямую определять раннюю продукцию IFN-b после инфицирования вирусом [16]. Между тем miR-146a, как было показано, регулирует активность интерферона типа I (IFN-I) посредством отрицательной обратной связи через NF-kB [17]. Этот механизм считается универсальным, так как многие вирусы могут реплицироваться путем ингибирования синтеза IFN в клетках-хозяинах. В связи с этим было также показано, что хантавирус в высокой концентрации ингибирует синтез и секрецию IFN [18]. Интересно еще одно наблюдение в работе Chen et al.: при хантавирусной инфекции увеличивалась экспрессия интерлейкина-8 (IL-8), хемокинового лиганда 5 (CCL5) и интерферон-гамма-индуцированного-протеина-10 (IP-10) в клеточной линии HUVECs, экспрессия которых в свою очередь подавлялась mimic miR-146a. То есть miR-146a действует как ингибитор, ослабляя воспалительный ответ NF-kB-зависимым образом. Субъединицы NF-kB действуют как фактор транскрипции для экспрессии IL-8, CCL5 и IP-10. В соответствии с этим предполагается, что хантавирус-индуцированная экспрессия miR-146a формирует противовоспалительную среду, обеспечивая условия для персистенции вируса в организме хозяина.
Shin et al. [19] показали корреляцию экспрессии между CCL5, IFN-b и miR-146a в HUVECs, инфицированных хантавирусом [19]. Повышенная экспрессия miR-146a-5p приводила к уменьшению экспрессии IFN-b в данной клеточной линии. MiR-146a, вероятно, остается одной из наиболее изученных микроРНК. Известно, что она ингибирует пути передачи сигнала, приводящие к активации NF-κB, а нарушение регуляции NF-κB связано с такими заболеваниями, как рак, вирусные инфекции и аутоиммунные заболевания [20].
В организме хозяина хантавирус остается связанным с ЭК через взаимодействие на поверхности клеток с интегрином αVβ3, направляя тромбоциты к поверхности ЭК. αVβ3-интегрин на тромбоцитах и на ЭК играет центральную роль в регуляции целостности сосудов [21, 22]. На ЭК семейство интегринов β3, включая αVβ3 – интегрин, обычно регулируют проницаемость сосудов через фактор роста эндотелия сосудов (VEGF) путем образования комплекса с рецептором 2 VEGF (VEGFR2). Фактически снижение экспрессии β3-интегрина приводит к активации VEGF [23]. Таким образом патогенные хантавирусы блокируют αVβ3-направленную миграцию ЭК и повышают проницаемость эндотелия в ответ на действие VEGF через 3 дня после заражения. Эти данные свидетельствуют о том, что патогенные хантавирусы изменяют сигнальные пути, направленные на VEGFR2, особенно на поздних сроках после заражения ЭК. Недавно было показано, что ЭК-специфические микроРНК регулируют экспрессию VEGF и служат ключевым детерминантом проницаемости сосудов [24]. В результате изменения экспрессии специфических эндогенных микроРНК в ЭК может способствовать повышению проницаемости эндотелия при хантавирусной инфекции. MiR-126 является специфичной для ЭК микроРНК, отвечающей за поддержание целостности сосудов. В свою очередь снижение экспрессии miR-126 приводит к увеличению проницаемости капилляров и отека у мышей [25]. MiR-126 функционирует путем подавления экспрессии SPRED1 (sprouty-связанный домен EVH1, содержащий белок 1) и PIK3R2 (фосфоинозитид-3-киназа, регуляторная субъединица 2), связанных с сигнальными путями, направленными на активацию VEGFR2 [26]. Подобно сниженной экспрессии miR-126, сверхэкспрессия SPRED1 увеличивает VEGF-индуцированную проницаемость ЭК. В результате этой активации miR-126 усиливает барьерные функции эндотелия, подавляя активность SPRED1 [27]. MiR-126 и SPRED1 регулируют целостность капилляров, определяя состояние фосфорилирования белка кофилина. SPRED1 является негативным регулятором киназы семейства LIM TESK1 (тестикулярная протеинкиназа 1), а связывание SPRED1 с TESK1 ингибирует фосфорилирование кофилина [28]. Нефосфорилированный кофилин расщепляет актиновые филаменты и разрушает адгезивные соединения путем диссоциации VE-кадгерина сосудистого эндотелия от его цитоскелетного белка (анкирин). Напротив, фосфорилирование кофилина TESK1 инактивирует кофилин, стабилизируя актиновые филаменты и межцепочечные адгезивные соединения [29]. Поскольку адгезивные соединения образуют первичный жидкостный барьер эндотелия, фосфорилирование кофилина регулирует проницаемость эндотелия. Pepini et al. показали, что после инфицирования хантавирусом HUVECs сверхэкспрессия miR-126 приводила к 10-кратному увеличению экспрессии SPRED1, что согласуется с данными о повышенной проницаемости ЭК под воздействием хантавируса [30]. Повышение экспрессии SPRED1 в инфицированных ЭК может увеличивать активность кофилина и усиливать реакции разборки адгезивных соединений. Pepini et al. также продемонстрировали, что существует связь между сниженной экспрессией miR-503 и активацией кофилина, в результате происходило снижение стабильности адгезионных соединений в ЭК, инфицированных хантавирусом [30]. В данной работе инфекция привела к 77-кратному снижению уровня экспрессии miR-503 в ЭК, где miR-503 регулирует экспрессию циклина D1 [30, 31]. В то время как сниженная экспрессия циклина D1 сопровождается повышенной клеточной адгезией, повышенная экспрессия циклина D1 обусловливает снижение клеточной адгезии и усиление миграции клеток путем ингибирования ответных сигналов Rho-ассоциированной протеинкиназы, содержащей спиральную спираль (Rho/ROCK) [30]. LIM-киназа, фосфорилирующая кофилин, служит ключевым субстратом ROCK, поэтому снижение уровня экспрессии miR-503 может также повышать активность кофилина и увеличивать проницаемость эндотелия, наблюдающуюся при хантавирусной инфекции [30, 32].
По результатам микрочипирования в инфицированных хантавирусом HUVECs было продемонстрировано резкое 3400-кратное снижение экспрессии miR-410 [30]. Аберрантная экспрессия miR-410 выявлена при различных патологических процессах, включая онкологию, воспаление и аутоиммунные заболевания [33, 34]. На данный момент неясно, играет ли такая изменчивость экспрессии у miR-410 в ЭК, инфицированных хантавирусом, какую-либо роль в регуляции клеточной активации или иммунного распознавания. Однако резкое снижение экспрессии miR-410 позволяет предположить ее потенциальную роль в патогенезе хантавирусной инфекции по отношению к ЭК, поскольку были определены конкретные гены-мишени для miR-410 и имеются доказательства роли miR-410 в регуляции функций ЭК [35]. Похожее исследование с микрочипами выявило 129-кратное снижение miR-218 в инфицированных хантавирусом HUVECs. Недавние исследования определили, что miR-218 специфически подавляет экспрессию Robo1, рецептора клеточной поверхности, который усиливает ангиогенез путем ингибирования нормальных регуляторных ответов VEGF другого рецептора ЭК – Robo4 [30, 36]. Robo4 обычно стабилизирует сосудистую стенку, противодействуя ответным сигналам VEGF, повышающим проницаемость ЭК. Напротив, повышенная экспрессия Robo1 приводит к образованию гетеродимерных комплексов Robo1–Robo4, снижающих клеточную адгезию и усиливающих миграцию ЭК [37]. Это открытие предполагает, что в HUVECs, инфицированных хантавирусом, снижение экспрессии miR-218 может усиливать проницаемость эндотелия, направленную на VEGF, за счет увеличения экспрессии Robo1 и, следовательно, снижения экспрессии Robo4.
Экспрессия miR-155 индуцируется передачей сигналов TLR-2, -3, -4 и -9 во многих типах клеток и, как правило, функционирует в качестве провоспалительной микроРНК посредством нацеливания на гены-мишени, регулирующие воспалительный процесс, например SH2-содержащий домен инозитол 5’-фосфатаза 1 [38, 39]. Однако для предотвращения чрезмерного воспаления необходимо контролировать экспрессию miR-155. В макрофагах передача сигналов TLR-4 индуцируется miR-155 и интерлейкином-10 (IL-10). IL-10 – противовоспалительный цитокин, который ингибирует транскрипцию miR-155; эта система обеспечивает контроль активации miR-155 и, следовательно, воспаления, которое она вызывает [40]. Как отмечено выше, miR-155 провоцирует воспаление, но при некоторых условиях может ингибировать экспрессию NF-κB, тем самым контролируя воспалительный процесс [41, 42]. Другим процессом, который строго контролируется микро-РНК, является производство антител с высокой аффинностью. Во время инфекции/поствакцинации В-лимфоциты, фолликулярные Т-хелперы и дендритные клетки образуют зародышевые центры в лимфоидной ткани. МикроРНК являются неотъемлемой частью процесса созревания аффинности, о чем свидетельствуют исследования, показывающие, что зародышевый центр не образуется, если происходит глобальное снижение экспрессии микроРНК в B-лимфоцитах. В этих зародышевых центрах активированные В-лимфоциты подвергаются клональной экспансии и перестройки в свои В-клеточные рецепторы (соматическая гипермутация), которые затем тестируются на антиген, связанный фолликулярными дендритными клетками в присутствии Т-фолликулярных хелперных клеток. Nakagawa et al. продемонстрировали, что активация апоптоза В-лимфоцитов может возникать, если их мембранный рецептор не полностью взаимодействует с антигеном, и в этом случае В-лимфоциты могут получать сигналы выживания клеток от фолликулярных Т-хелперов, вызывая активацию miR-155, которая затем воздействует на проапоптотические факторы (например, JARID2) и обращает апоптический путь [43]. Перестройка В-клеточного рецептора (посредством соматической гипермутации) и переключения классов иммуноглобулинов регулируется микроРНК. Индуцируемая активацией цитидин-деаминаза (AID) катализирует мутацию локуса иммуноглобулина, и AID служит неотъемлемой частью переключения классов иммуноглобулинов и созревания аффинности. Но и в свою очередь должна строго контролироваться для предотвращения мутаций генов, не являющихся мишенями, которая может приводить к онкогенной активации и по неясным причинам – появлению низкоаффинных и аутореактивных антител. Для строгой регуляции экспрессии AID передача сигналов B-клеточным рецептором регулируется miR-155 (направленным на транскрипты AID). Однако мутация AID приводит к ее невосприимчивости к miR-155, что в результате резко повышается экспрессия AID, вызывая всплеск синтеза незрелых B-лимфоцитов и AID-опосредованные хромосомные транслокации [34]. Учитывая ключевую роль miR-155 в ответе зародышевого центра, нарушение регуляции miR-155 может приводить к иммунной дисфункции у людей. Подтверждением служит следующее: В-лимфоциты пожилых людей имеют более высокий уровень miR-155 по сравнению с молодыми людьми, и это препятствует переключению классов иммуноглобулинов в В-лимфоцитах пожилых людей из-за усиления подавления AID. Эти данные указывают на то, что модуляция иммунного ответа посредством микроРНК является тонко сбалансированным процессом и повышенная восприимчивость к инфекции, а возможно, и плохая реакция на вакцины о стороны пожилых людей могут быть частично обусловлены возрастной дисрегуляцией микроРНК [44, 45]. Хантавирусная инфекция обусловливает увеличение экспрессии miR-155 в HUVECs, которая, как недавно было показано, играет роль в регуляции не только воспалительной реакции, но и ангиогенеза и целостности эндотелия [30]. miR-155 регулирует «разборку» адгезивных соединений, миграцию клеток и морфологию клеток, что изменяет проницаемость сосудов.
Циркулирующие микроРНК как потенциальные биомаркеры при ГЛПС
Циркулирующие микроРНК не рассматривались в качестве биомаркеров при ГЛПС, хотя за последнее время был проведен ряд исследований при различных заболеваниях, включая другие вирусные инфекции (табл. 2) [46–50], показавших, что циркулирующие микроРНК могут быть более предпочтительными в качестве биомаркеров по сравнению с биомаркерами-белками по нескольким причинам.
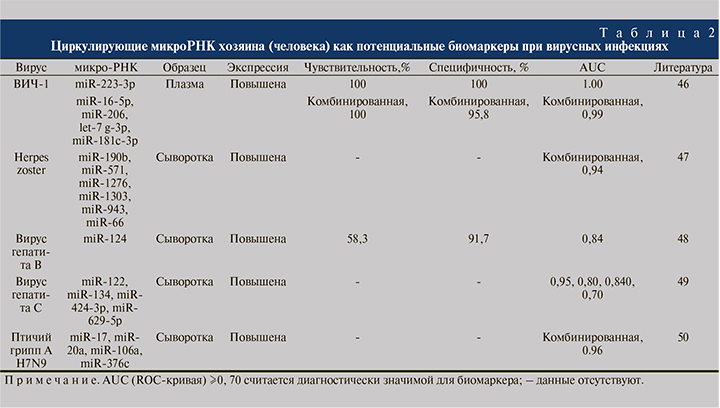
Среди них: 1) высокая стабильность и выявляемость в различных биологических жидкостях человека, в том числе в крови; 2) могут быть количественно, рентабельно, эффективно и относительно быстро определены в современных клинических лабораториях с высокой чувствительностью и специфичностью с использованием различных методов, таких как полимеразная цепная реакция в реальном времени (ПЦР в реальном времени); 3) высокая чувствительность применительно к конкретной патологии; 4) возможность обнаружения на ранних стадиях заболевания, в то время как белковые структуры выявляются в крови, только когда значительная часть ткани уже повреждена; 5) участие практически во всех клеточных функциях; 6) микроРНК служит важным фактором репликации вируса (микроРНК хозяина и вируса) [51–53].
Хантавирусная инфекция у людей в основном вызывает два патологических процесса: хантавирусный легочный синдром и ГЛПС. На сегодняшний день имеются доказательства того, что микроРНК являются ключевым медиатором ответа хозяина на инфекцию преимущественно путем регуляции определенных генов (белков), например, участвующих в сигнальных путях врожденного и адаптивного иммунного ответа. В ряде исследований in vitro и in vivo, посвященных изучению динамики изменения профиля экспрессии miR-126, -146a, -410, -218, -503 , -155 хозяина и их генов-мишеней при хантавирусной инфекции, показана зависимость профиля их экспрессии и основных звеньев патогенеза хантавирусной инфекции. Однако специфическая роль каждой из этих микроРНК при хантавирусной инфекции еще не полностью определена, но предполагается, что специфичные для вида вируса изменения могут быть еще одной важной детерминантой в развитии ГЛПС, связанной с хантавирусом. Это позволит в ближайшем будущем использовать циркулирующие микроРНК как биомаркеры для диагностики, прогнозирования клинического течения и/или тяжести ГЛПС.



