Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) – одно из наиболее распространенных заболеваний у мужчин старше 50 лет. Для лечения симптомов нарушения функции нижних мочевых путей (СНМП), связанных с ДГПЖ (СНМП/ДГПЖ), используют широкий спектр лекарственных средств: α1-адреноблокаторы; ингибиторы 5α-редуктазы; антагонисты мускариновых рецепторов; ингибиторы фосфодиэстеразы 5-го типа; β3-агонисты; растительные экстракты; различные варианты комбинированной терапии и др. При этом, несмотря на массу проведенных исследований, в том числе двойных слепых и рандомизированных, вопросы о четких показаниях к назначению того или иного препарата и о прогнозировании отдаленных результатов лечения остаются открытыми [1].
Принимая во внимание, что лекарственную терапию, как правило, проводят в течение длительного времени, иногда пожизненно, понятен интерес исследователей к поиску методов прогнозирования ее отдаленных результатов. Однако работ, посвященных этой проблеме, известно немного, что, по-видимому, связано с отсутствием доступных инструментов и низким качеством прогноза, не удовлетворяющим требованиям клинической практики.
В последние годы активно развиваются особые методы анализа данных, так называемый Data mining (добыча данных, интеллектуальный анализ данных), использующий широкий потенциал современных методов классификации, моделирования и прогнозирования для выявления в изучаемом наборе данных новых сведений, которые не могут быть получены путем простого статистического анализа. Другими словами, методы Data mining служат средством извлечения из набора данных ранее не известных скрытых взаимосвязей между переменными, характеризующих объект, предоставляя исследователю новые, в практическом смысле полезные и доступные для интерпретации знания, необходимые для принятия решений в различных сферах человеческой деятельности, в том числе и в медицине [2–5].
Одним из перспективных направлений Data mining является предиктивная, или прогностическая, аналитика (Predictive analytics), которую используют для прогнозирования неизвестных событий в будущем. В ее основе – математическое моделирование, т.е. создание модели как набора правил, формул или уравнений, извлеченных из исходных данных и позволяющих генерировать предсказания на этой основе.
Распространенным методом прогностического моделирования является метод классификации, реализованный во многих компьютерных системах клинического прогнозирования для оценки вероятности и риска возникновения события. Модели классификации используют значения одного или нескольких входных полей (независимых переменных или предикторов), чтобы предсказать значения одного или нескольких выходных целевых полей или полей назначения (зависимых переменных, спрогнозированных моделью на основе анализа входных предикторов). Во многих областях медицины используют различные способы моделирования и алгоритмы машинного обучения: деревья решений (алгоритмы дерева C&R, QUEST, CHAID, C5.0), регресса (линейный, логистический, обобщенный линейный и Кокса), нейронные сети, модели опорных векторов, Байесовские сети и др. [6–8].
В то же время имеются лишь единичные работы по применению алгоритмов машинного обучения и методов Data Mining в построении предиктивных моделей при лечении пациентов с СНМП/ДГПЖ [9, 10].
Порядок решения задач методами Data mining включает следующие этапы:
- Постановку задачи анализа.
- Сбор данных.
- Подготовку данных (фильтрация, дополнение, кодирование).
- Выбор модели (алгоритма анализа данных).
- Подбор параметров модели и алгоритма обучения.
- Обучение модели (автоматический поиск и оценка остальных параметров модели).
- Анализ качества обучения (если неудовлетворительный, то переход к п.п. 4 или 5).
- Анализ выявленных закономерностей (если неудовлетворительный – возврат к п.п. 1, 4 или 5).
Цель прогнозирования – получение данных о важных событиях в будущем в состоянии больного под влиянием проводимой терапии. При лечении СНМП/ДГПЖ с учетом его длительности такими событиями служат достижение значимого улучшения ключевых параметров или отсутствие такового. К основным общепризнанным клиническим параметрам при ДГПЖ относятся выраженность СНМП, представленная баллами по шкале IPSS и максимальная скорость потока мочи (Qmax).
Целью настоящей работы стало прогнозирование отдаленных результатов лекарственной терапии СНМП/ДГПЖ с использованием методов прогностического моделирования на примере лечения экстрактом Serenoa repens (Пермиксон).
Материалы и методы. Для прогнозирования лечебного эффекта препарата Пермиксон в отдаленные сроки с применением методов предиктивной аналитики использовали материалы клинического исследования «Длительная клиническая и биологическая переностимость липидостеролового экстракта Serenoa repens (Permixon) пациентами с симптоматической доброкачественной гипертрофией предстательной железы»1 (№ P0048 95 GP 401), проведенного в 1995–1999 гг. в трех медицинских центрах Москвы: НИИ урологии Минздрава РФ, урологической клинике ММА им. И. М. Сеченова и в урологическом отделении Городской клинической больницы № 602.
При подготовке данных использовали пакет первичной документации, включивший клиническую информацию о результатах обследования и динамического наблюдения каждого пациента на всех этапах исследования. Документация была официально представлена компанией «Pierre Fabre» (Франция) в 2000 г. для проведения дополнительного научного анализа. Данные с бумажных носителей были оцифрованы и перенесены в сформированную электронную таблицу Excel (Microsoft).
Общие результаты клинического исследования препарата Пермиксон
Первичной целью открытого многоцентрового несравнительного исследования было определение долгосрочной клинической эффективности и безопасности препарата Пермиксон на протяжении 2 лет лечения пациентов с СНМП/ДГПЖ. В исследование, согласно критериям, были включены 155 амбулаторных пациентов в возрасте от 52 до 87 лет (средний возраст – 65,3 года), которые получали препарат в капсулах по 160 мг 2 раза в день на протяжении двух лет. Анкетирование, инструментальное и лабораторное обследование проводили каждые 6 мес. (визиты V0, V6, V12, V18, V24). В ходе этих визитов оценивали эффективность препарата, его переносимость, регистрировали нежелательные явления.
Критерии включения в исследование: возраст 50 лет и старше; наличие СНМП/ДГПЖ более 6 мес.; IPSS более 6 баллов; Qmax от 5 до 15 мл/с; объем мочеиспускания от 150 до 400 мл; объем остаточной мочи менее 150 мл; объем предстательной железы (ПЖ) более 25 см3 при трансректальном и/или трансабдоминальном УЗИ, уровень простатспецифического антигена (ПСА) менее 4 нг/мл. Критерии исключения: любое хирургическое вмешательство на шейке мочевого пузыря или ПЖ в анамнезе, рак ПЖ или мочевого пузыря, рецидивирующая инфекция мочевыводящих путей, применение на протяжении предыдущих 3 мес. препаратов, способных изменить характер мочеиспускания.
Оценка эффективности лечения базировалась на изучении динамики СНМП и качества жизни относительно исходного уровня с использованием шкал IPSS и QOL. До начала лечения (V0) и в точках V6, V12, V18, V24 методом урофлоуметрии определяли скорость мочеиспускания. Объем ПЖ и объем остаточной мочи в каждом центре оценивали УЗИ-методом.
Для оценки клинической безопасности препарата Пермиксон на протяжении всего исследования осуществляли регистрацию нежелательных явлений. Учитывали все серьезные и несерьезные нежелательные явления независимо от того, были ли они связаны с изучаемым лекарством. Также проводили измерения пульса, систолического и диастолического артериального давления. Влияние препарата на сексуальную функцию изучали с помощью специального опросника MSF-4, который пациенты заполняли самостоятельно.
Для оценки биологической безопасности препарата 1 раз в 6 мес. выполняли общий и биохимический анализы крови, определяли уровни ПСА, гормонов в плазме крови (тестостерон, дигидротестостерон, D4-андростендион, Зα-5α-андростендиол, андростендион-глюкуронид, эстрадиол, DHEA, DHEA-сульфат, TeBG, лютеинизирующий гормон).
Исходные клинические показатели и их динамика на фоне лечения Пермиксоном на протяжении 24 мес. представлены в табл. 1.
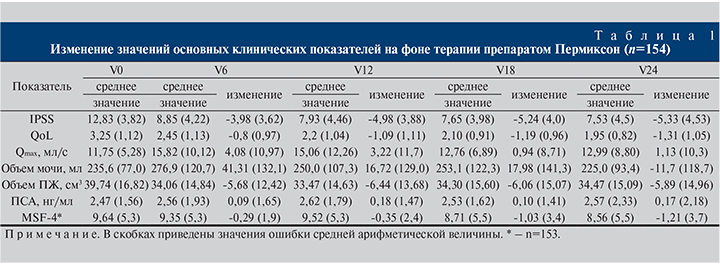
Пермиксон облегчал симптоматику ДГПЖ, на что указывало прогрессивное и устойчивое улучшение показателя IPSS – основного критерия эффективности. По сравнению с исходным значением средний показатель IPSS достоверно снизился к моменту первого определения через 6 мес. и продолжал улучшаться до 24-го месяца лечения (р=0,001). Относительное уменьшение величины IPSS составило 38,6% через 12 мес. и 41,4% через 24 мес. Если на момент включения у подавляющего большинства (90%) пациентов наблюдали СНМП умеренной выраженности, то уже через 6 мес. мужчин с незначительными симптомами было 38%, а через 12–24 мес. – примерно 50%.
Статистически значимое (р<0,001) уменьшение индекса QOL, соответствовавшее улучшению качества жизни, наблюдали через 6 мес., которое сохранялось на протяжении 2 лет исследования. Доля пациентов, почувствовавших улучшение качества жизни, неуклонно возрастала (с 58,4 до 77,3%) в период с 6 до 24 мес. лечения.
Прогрессивное уменьшение баллов шкалы MSF-4, соответствовавшее улучшению сексуальной жизни, наблюдали на протяжении 2 лет исследования. Эти изменения были статистически значимыми через 18 и 24 мес. (р<0,001).
Данные урофлоуметрии свидетельствовали о значительном увеличении Qmax по сравнению с исходным значением в каждой точке определения. После среднего увеличения более чем на 3 мл/с в течение 1-го года лечения Qmax осталась выше исходных значений на 0,94–1,13 мл/с до конца исследования. Изменения, наблюдавшиеся в 4 последовательных временных точках, соответствовали процентному увеличению: +34,7% (V6), +27,2% (V12), +7,9% (V18) и +9,5% (V24). После исключения из анализа пациентов с выпадающими значениями изучаемых показателей оказалось, что скорректированные значения изменений Qmax через 18 и 24 мес. существенно выше: 2,32 и 2,8 мл/с соответственно по сравнению с общей выборкой. Кроме того, через 6 мес. зарегистрировано статистически значимое увеличение объема мочеиспускания.
Объем предстательной железы у участников исследования снизился в среднем на 14% через 6 мес. лечения и сохранялся на достигнутом уровне в течение всего периода наблюдения. Уменьшение объема предстательной железы было зарегистрировано у 80% пациентов.
В данном исследовании показано, что Пермиксон обладает высоким профилем безопасности. На протяжении всего исследования не было выявлено достоверного изменения среднего уровня общего ПСА, уровней гормонов сыворотки крови, как и других гематологических и биохимических параметров в каждой точке оценки. Также не отмечено никаких изменений основных жизненных показателей. Только у 4 пациентов наблюдали серьезные нежелательные явления, лишь одно из которых было связано с лечением [11].
Подготовка данных и их анализ
Сформирована база клинических данных, включившая результаты обследования и динамического наблюдения 151 больного, участвовавшего в описанном выше исследовании (исключены 4 пациента с неполным набором данных).
Целевые показатели. Целевыми показателями прогноза были определены ключевые клинические параметры: выраженность СНМП/ДГПЖ по шкале IPSS и показатель Qmax. Создаваемая математическая модель должна предсказывать достижение их клинически значимого улучшения или отсутствие такового в отдаленные сроки лечения препаратом Пермиксон: через 12 и 24 мес.
При построении моделей целевыми показателями по сравнению с исходными стали:
- уменьшение СНМП по шкале IPSS>25% через 12 (IPSS25_m12) и 24 (IPSS25_m24) мес. лечения; уменьшение СНМП по шкале IPSS>3 баллов через 12 (IPSS_3_m12) и 24 (IPSS_3_m24) мес. лечения;
- увеличение Qmax>25% через 12 (Qmax25_m12) и 24 (Qmax25_m24) мес. лечения.
При оценке результатов использовали бинарный подход: 1 – если улучшение по выбранному клиническому показателю наступило и 0 – если не наступило.
Входные данные. Для построения моделей с применением алгоритмов машинного обучения был определен перечень входных данных (переменных), представлявших основные клинические показатели пациентов до начала лечения.
На первом этапе был изучен 21 входной параметр, включивший выраженность СНМП, качество жизни, урофлоуметрические параметры, размеры и объем ПЖ, показатели гормонального статуса.
Для предварительной оценки важности предикторов использовали 11 алгоритмов машинного обучения: C&RT (Classification and Regression Tree); С5.0 (Rule Quest); CHAID (Chi-squared Automatic Interaction Detection); KNN (kNN - k Nearest Neighbours); Байесовскую сеть (Bayesian network); QUEST (Quick, Unbiased, Efficient Statistical Tree); SVM (Support Vector Machine); логистический регресс (Logistic Regression); дискриминантный анализ (Discriminant Analysis); нейронную сеть (Neural Net); случайные деревья (Random Forest). Провели тщательную проверку и отбор материала, при этом коррелирующие переменные исключили из набора данных. В итоге для построения релевантной модели наиболее значимыми входными критериями были признаны 7 из них: IPSS, Qmax, средняя скорость потока мочи (Qave), объем мочеиспускания, время мочеиспускания, объем остаточной мочи (PVR), объем предстательной железы (PVol).
Выбор алгоритмов анализа данных. Процесс моделирования состоял в выборе модели или комплексов моделей (ансамблей), которые были бы способны предсказать результат, наиболее точно совпадавший с наблюдаемым фактическим результатом. Используя способ автоклассификации, для каждого целевого показателя был сформирован «слепок» из трех оптимальных алгоритмов, показавших лучшие прогностические результаты. В результате для дальнейшей работы из 11 изучаемых алгоритмов машинного обучения осталось 7: Байесовская сеть (BNet); C5.0; механизм опорных векторов (SVM); метод ближайших соседей (KNN); нейронная сеть (NNet); автоматическое обнаружение взаимодействия хи-квадрат (CHAID); дерево классификации и регресса (C&RT).
Подбор параметров модели и алгоритмов обучения. Предварительный анализ выявил значительные различия между показателями чувствительности и специфичности моделей из трех алгоритмов (слепков) для соответствовавших целевых полей. Проблема дисбаланса данных достаточно распространена в математическом моделировании, когда имеются существенные различия в соотношении между числом истинно положительных и истинно отрицательных результатов. Для устранения этого неравенства обычно применяют метод балансировки, позволяющий обучать модели распознавать малочисленные отклики в бинарных ответах на фоне альтернативных откликов, представляющих подавляющее большинство наблюдений в наборе данных [12–14].
При балансировке данных для каждого целевого поля были построены дополнительные модели (слепки) из трех алгоритмов, которые могли отличаться от построенных ранее. После применения метода балансировки прогностические свойства моделей значительно улучшились. Далее для повышения качества прогнозирования на основе набора исходных данных слепки двух типов моделей (с балансировкой и без) были объединены в «ансамбли» (рис. 1, 2).
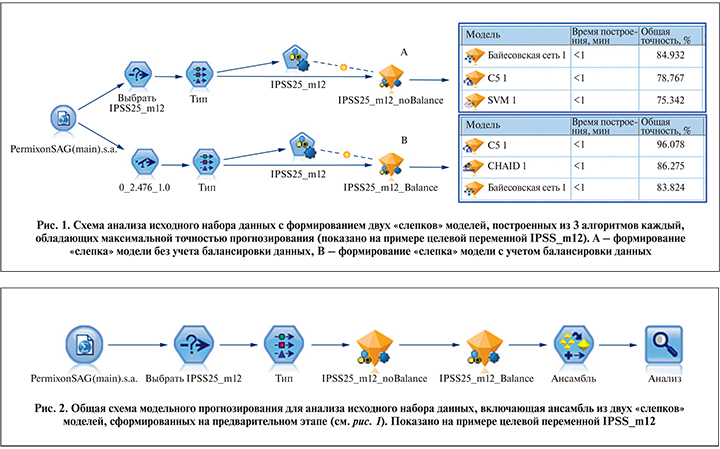
Обучение модели. Для тестирования релевантности моделей и их прогностического качества применили общепринятый подход, заключавшийся в разделении набора данных на две рандомизированные выборки. Большую часть основного набора данных, 70%, использовали для обучения модели, меньшую ее часть, 30%, – для проверки адекватности модели. Разделение данных на две выборки позволило обучать модель на одной выборке и тестировать на другой.
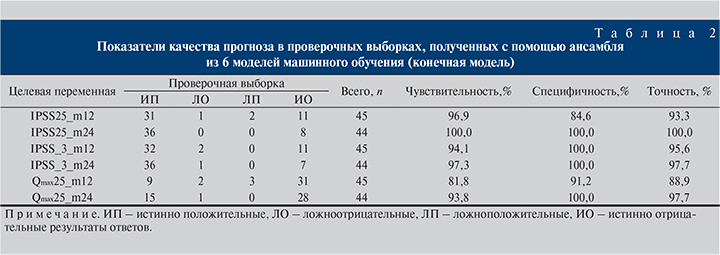
Анализ качества обучения. Для повышения качества прогностических результатов по каждому целевому полю подключали соответствовавший ансамбль моделей, полученных при балансировке данных. Таким образом, окончательные прогностические модели для каждого целевого поля включали ансамбль суммарно из 6 алгоритмов машинного обучения. Результаты тестирования моделей на проверочных выборках указывают на то, что модельные комплексы приобрели способность к различению и предикции малочисленных результатов ответа, коими для полей IPSS25 и IPSS_3 были истинно отрицательные, а для полей Qmax25 – истинно положительные результаты. При этом проверочные выборки исходного набора данных (n=151) показали высокое качество прогноза (табл. 2).
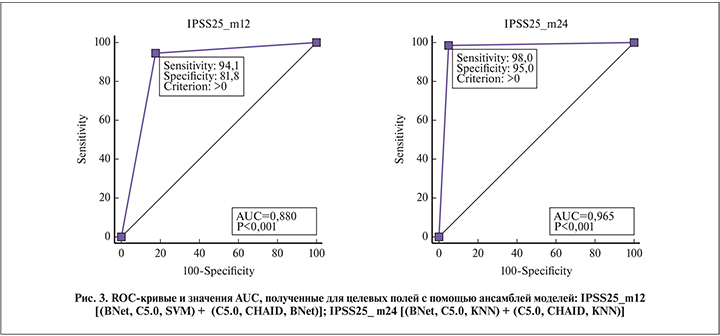
Анализ выявленных закономерностей. Окончательную оценку прогностических возможностей созданных модельных комплексов (ансамблей) провели с использованием ROC-анализа и расчета показателя AUC (площади под кривой). Значения показателя AUC важны для оценки качества модели-предиктора. Чем выше показатель AUC и чем ближе он к единице, тем качественнее модель-предиктор, позволяющая делать прогноз и различать случаи с позитивными и негативными результатами.
Использование в работе модельных ансамблей позволило получить значения AUC в диапазоне от 0,864 до 0,965 (р<0,001), что соответствует моделям очень хорошего (excellent; 0,8–0,9) и превосходного (outstanding; 0,9–1,0) качества [15]. При этом чувствительность и специфичность моделей, рассчитанных по методу E. R. DeLong et al. [16], колеблется в пределах 82,4–99,0 и 75,0–96,1 соответственно (рис. 3–5).
Обсуждение. Для математического моделирования нами были использованы результаты открытого долгосрочного исследования эффективности и переносимости препарата Пермиксон пациентами с ДГПЖ, подтвердившего, что препарат, применяемый по 160 мг 2 раза в день на протяжении 2 лет, демонстрирует хороший клинический эффект и обладает высоким профилем безопасности. Подтверждена действенность препарата в отношении СНМП/ДГПЖ. Исследование показало, что Пермиксон продолжал снижать выраженность симптомов на протяжении 2 лет наблюдения, а также способствовал клинически значимому улучшению уродинамических параметров в течение всего периода лечения. Также продемонстрировано уменьшение на 14% объема предстательной железы на фоне лечения [11]. Результаты этого исследования сопоставимы с данными других исследований препарата Пермиксон.

С использованием методов предиктивной аналитики предпринята попытка построения математической модели для предсказания отдаленных результатов лечения по исходным данным. Для построения модели сформирована база результатов клинических обследований и динамического наблюдения 151 больного. В качестве целевых показателей отобраны снижение СНМП по шкале IPSS>25% и>3 баллов IPSS, а также увеличение Qmax>25% через 12 и 24 мес. лечения.

В связи с этим практический интерес представляет вопрос: что считать клинически значимым улучшением для выбранных параметров?
Существующие представления об эффективности терапии ДГПЖ сформировались на основании нескольких исследований и постулатов. В 1991 г. Y. Aso et al. [17] предложили считать выраженным эффектом снижение СНМП по шкале IPSS на 50% и более, эффективным – на 25% и более и неэффективным – менее 25%.
M. J. Barry et al. [18] по результатам масштабного исследования рассчитали, что улучшение СНМП по шкале IPSS (AUA-SI)3 на 3 балла по сравнению с базовым уровнем соответствует оптимальным показателям чувствительности (0,68) и специфичности (0,70) при разделении пациентов «с улучшением» и «без улучшения». Этот критерий позже был признан Американской урологической ассоциацией (AUA) как «установленный клинически значимый порог» эффективности для лекарственной терапии [19]. Пациенты, достигшие или превысившие этот уровень улучшения, могут рассматриваться как «ответчики» на лечение.
В дальнейшем ряд исследователей применил критерий улучшения СНМП по IPSS на 25% и более при организации масштабных исследований лекарственных препаратов [20–22]. А некоторые авторы использовали не только критерии снижения IPSS на 25, 50 и 75%, но одновременно и еще один критерий – уменьшение симптомов более чем на 3 балла [23]. При изучении методами Data mining ответа на лекарственную терапию СНМП/ДГПЖ F. Fusco et al. [9] также применили критерий улучшения по IPSS на 25% и более.
И наконец, H. Lepor [20] помимо критерия симптоматического улучшения применил уродинамический критерий улучшения параметров мочеиспускания – увеличение исходного показателя Qmax на 30% и более.
В завершение необходимо отметить, что при выборе критериев определения «ответчиков» следует учитывать, что оценка клинически значимых различий сильно зависит от исходной выраженности симптомов: чем выше исходный балл, тем больше снижение [18, 24].
С учетом вышеизложенного можно заключить, что избранные нами целевые показатели в целом соответствуют общепринятым критериям оценки клинического улучшения СНМП/ДГПЖ по IPSS и Qmax, применяемым в исследованиях эффективности лекарственных средств.
Для каждого целевого поля (диагностического критерия) и временного интервала были построены математические модели с использованием ансамблей из отобранных 7 алгоритмов машинного обучения, обладающих лучшими прогностическими качествами. Проверка моделей на внутренних рандомизированных выборках продемонстрировала их высокие прогностические свойства: чувствительность – 82,4–99,0; специфичность – 75,0–96,1; AUC – 0,864–0,965.
Можно отметить, что исходный показатель IPSS, обычно используемый и принятый в качестве критерия оценки эффективности лекарственных средств, в данном исследовании оказался равным 12,8 балла. Это немного ниже, чем значения, обычно наблюдаемые в клинических исследованиях, и связано с тем, что использование индекса IPSS более 6 баллов как критерия включения привело к отбору только 4% пациентов с тяжелой симптоматикой (IPSS>19). Именно с этим мог быть связан дисбаланс исходных данных, потребовавший использования специальных методов балансировки, что было показано выше. Тестирование моделей на рандомизированных выборках показало, что указанный фактор не оказал существенного влияния на точность прогноза.
Использование материалов открытого исследования лекарственного препарата, по нашему мнению, также не должно оказать влияния на результаты моделирования, так как наличие «ветви» с плацебо позволило бы в лучшем случае спрогнозировать плацебо-эффект в отдаленном периоде (что представляет определенный научный интерес), но не изменить результат прогноза по основному лекарственному средству. Кроме того, хорошо известно, что плацебо-эффект уменьшается со временем [25].
Отсутствие влияния исследуемых гормонов (тестостерон, дигидротестостерон, D4-андростендион, Зα5α-андростендиол, андростендионглюкуронид, эстрадиол, DHEA, DHEA-сульфат, TeBG, лютеинизирующий гормон) на прогноз отдаленных результатов лечения препаратом Пермиксон, что было показано в настоящей работе, согласуется с известными данными, согласно которым препарат мало влияет на процессы с участием андрогенов, основанные на связывании последних с их рецепторами [26].
Заключение. Таким образом, настоящей работой продемонстрирована потенциальная возможность эффективного прогнозирования методами предиктивной аналитики и Data mining отделенных результатов лекарственной терапии СНМП/ДГПЖ по основным клиническим критериям. Результаты проведенной работы подтверждают эффективность лечебного действия препарата Пермиксон на протяжении 2-летнего периода его применения. Построенные прогностические модели будут совершенствоваться путем их обучения и проверки по мере включения в базовый набор данных новых клинических наблюдений. Моделирование выполнено на примере открытого исследования препарата Пермиксон, однако данный подход применим к созданию аналогичных моделей и для прогнозирования эффекта других лекарственных средств.



