Введение. Пролиферативные процессы в предстательной железе: рак предстательной железы (РПЖ) и доброкачественная гиперплазия предстательной железы (ДГПЖ) – наиболее распространенные заболевания у мужчин пожилого возраста [1]. ДГПЖ представляет собой доброкачественный пролиферативный процесс и традиционно рассматривается как ассоциированное с возрастом хроническое прогрессирующее поражение предстательной железы, характеризующееся развитием простатической железисто-стромальной гиперплазии, обусловливающей развитие симптомов нижних мочевыводящих путей (СНМП) [2–5].
Простатическая интраэпителиальная неоплазия (ПИН) рассматривается как морфологический предшественник рака предстательной железы с высокой вероятностью злокачественной трансформации [6]. При этом само наличие ПИН – недостаточное и необязательное условие для возникновения карциномы. По данным различных авторов, ПИН обнаруживается по результатам гистологических исследований в 20–50% пункционных биопсий, выполненных больным с подозрением на рак. При этом ПИН выявляется в 1,7 раза чаще, чем РПЖ [7]. Современные исследования показывают, что ПИН тяжелой степени (ПИН-3) ассоциирована с 20–30% случаев выявления рака простаты при повторной биопсии [8, 9]. В связи с этим существует проблема, в каких случаях ПИН имеет потенциал к прогрессированию в клинически значимый РПЖ, а в каких останется индолентным гистопатологическим процессом [9].
Нередко в «стареющей» простате выявляется процесс воспаления. Последний в настоящее время считается фактором, способствующим пролиферации клеток с развитием как доброкачественных, так и злокачественных заболеваний, в генезе которых активно исследуется роль ренин-ангиотензиновой системы (РАС) [10–12]. РАС – одна из наиболее сложноорганизованных гормональных, полипептидных систем организма человека, представляет собой физиологический путь, способствующий пролиферации опухолевых клеток, ангиогенезу и воспалительной реакции в опухолевой ткани [13, 14]. «Классическая» ось регуляции РАС – ангиотензинпревращающий фермент (АПФ)/ангиотензин II (АнгII)/рецепторы ангиотензина II первого и второго типов (AT1-R и AT2-R) – хорошо изучена. Однако роль РАС в прогрессировании рака простаты в настоящее время до конца не изучена [15, 16].
Цель исследования – анализ роли компонентов ренин-ангиотензиновой системы в патогенезе пролиферативных изменений предстательной железы.
Материалы и методы. В исследование включены 63 пациента, которым была выполнена трансректальная биопсия предстательной железы.
Первую группу составили 19 пациентов с доброкачественной гиперплазией предстательной железы (значения медиан [Me]: возраст – 60 лет, ПСА – 2,7 нг/мл, объем предстательной железы [ПЖ] – 59,6 см3, длительность СНМП – 36 мес.). Вторую группу составили 19 мужчин, у которых рак простаты обнаружен при повторной биопсии, выполненной на основании выявленной ПИН-3 при первичной (систематической) биопсии простаты, а также сохраняющегося повышенного уровня ПСА. Значения Me характеристик в группе: возраст – 60 лет, ПСА – 9,9 нг/мл, объем ПЖ – 44,3 см3, процент поражения простаты опухолевым процессом – 15%). Очаг в предстательной железе по данным трансректальной ультрасонографии (ТрУС) выявлен у 26% пациентов второй группы. Также у больных 2-й группы ПИН-3 в биоптатах ПЖ определялась в 20% случаев. У 4 пациентов в биоптатах выявлены очаги атипичной мелкоацинарной пролиферации. Клиническая стадия РПЖ во 2=й группе: T1a – 5,3%, T1b – 26,3%, T1c – 21,0%, T2 – 47,4%. Инвазии РПЖ в капсулу ПЖ у пациентов не выявлено. Третью группу составили 25 мужчин с РПЖ, выявленным при первичной биопсии простаты. Me (возраст – 63 года, ПСА – 7,1 нг/мл, объем ПЖ – 38 см3, процент поражения простаты опухолевым процессом – 40). Очаг в ПЖ при ТрУС выявлен у 68% больных, ПИН-3 – у 20%. Клиническая стадия РПЖ в 3-й группе: T1c – 76,0%, T2 – 24,0%. Инвазия РПЖ в капсулу ПЖ имела место у 68% больных.
Пятнадцати больным выполнена радикальная простатэктомия: 7 – второй и 8 – третьей групп. При оценке препарата ПЖ после радикальной простатэктомии у больных 2-й группы патологическая стадия болезни (pT) оказалась: рT2a у 57,1%, pT2b у 14,3% и pT2c имели 28,6%. Инвазия опухоли в капсулу ПЖ выявлена у 28,6% пациентов. Стадия по гистологической прогностической классификации Международной ассоциации уропатологов (ISUP – international society of uropatologists) у 14% больных соответствовала первой группе, у 43% – ISUP-2, у остальных – ISUP ≥3. После оценки препарата ПЖ после радикальной простатэктомии в 3-й группе больных патологическая стадия РПЖ оказалась: у 12,5% рT2a, у 87,5% рT2c. Инвазию РПЖ в капсулу железы имели 9%. Все пациенты соответствовали стадии ISUP ≥3.
Контрольную группу составили 24 мужчины без выявленных патологических процессов в предстательной железе.
Исследование проведено в соответствии с национальным стандартом РФ «Надлежащая клиническая практика» [17].
В секрете предстательной железы определяли активность ангиотензинпревращающего фермента (АПФ) (КФ 3.4.15.1) с использованием в качестве субстрата N-[3-(2-фурил)-акрилоил]-L-фенилаланил-глицилглицин (FAPGG) [18]. Для иммуногистохимического исследования использован материал полифокальных пункционных биопсий у пациентов с ДГПЖ, с ПИН (пациенты 2-й группы до выявления РПЖ) и у больных раком простаты при его выявлении. Постановка иммуногистохимических (ИГХ) реакций, интерпретация полученных результатов осуществлены в соответствии с общепринятыми правилами [19]. Процедуру иммуногистохимического окрашивания проводили с использованием первичных антител к рецептору ангиотензина II второго типа «GTX79393, AGTR2 Antibody, Rabbit, Polyclonal, IgGWB, ICC/IF, IHC-P, Human-100ul (GeneTex)» в разведении 1:1000 и системы визуализации EnVision FLEX (Dako, Дания) по стандартной методике.
Экспрессию рецепторов АТ2-R оценивали полуколичественным методом.
Статистическую обработку полученных данных проводили с использованием U-критерия Манна–Уитни с применением пакета прикладных программ Statistica*. Данные представлены в виде медианы и интерквартильного размаха – Me [LQ–UQ] (LQ – нижний квартиль, UQ – верхний квартиль). Статистически достоверными считали различия на уровне р<0,05 [20].
Результаты. Установлено, что при пролиферативных заболеваниях предстательной железы активность АПФ в секрете простаты по сравнению с таковой в контрольной группе достоверно увеличена (см. таблицу).

Максимальное увеличение активности АПФ (p<0,05) отмечено при доброкачественной гиперплазии простаты. Активность АПФ в секрете предстательной железы снижена при ПИН относительно ДГПЖ и еще более снижена при раке предстательной железы.
Нами определено, что экспрессия AT2-R в ткани простаты при пролиферативных заболеваниях предстательной железы имеет свои особенности. Так, при ДГПЖ экспрессия рецепторов ангиотензина II второго типа имеет место в ядрах эпителиальных клеток (рис. 1). При этом экспрессия AT2-R, как правило, максимально интенсивна и наблюдается в большинстве ядер.
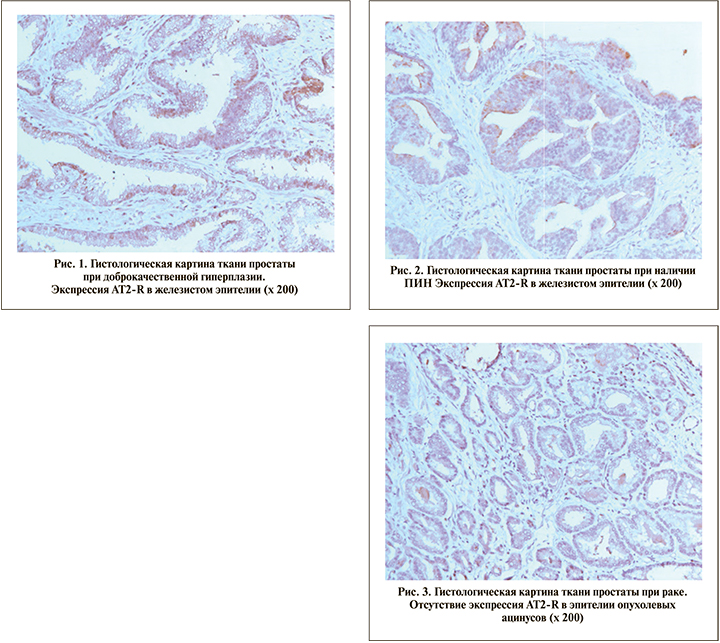
В фокусах ПИН доля окрашенных клеток и интенсивность ИГХ окрашивания ниже, чем при доброкачественной гиперплазии простаты, что свидетельствует о более низкой, чем при ДГПЖ, экспрессии AT2-R (рис. 2).
В опухолевых клетках при РПЖ отмечена слабая экспрессия AT2-R либо она совсем отсутствует (рис. 3).
Обсуждение. В предстательной железе экспрессированы все основные компоненты «классической» оси регуляции РАС: АПФ/ангиотензин II/АТ1–рецептор, АТ2–рецептор РАС. Результаты наших исследований показывают, что активность АПФ в секрете предстательной железы при пролиферативных заболеваниях значительно выше, чем в «здоровой» простате. Наиболее высокая активность АПФ отмечена при доброкачественной гиперплазии предстательной железы, минимальная – при раке простаты, но при этом остается достоверно высокой относительно нормы. Это, по-видимому, связано с заменой высокоспециализированных эпителиальных клеток простаты опухолевыми клетками при развитии РПЖ, что и приводит к резкому снижению продукции АПФ [22].
С другой стороны, высокая активность АПФ при ДГПЖ, ПИН и РПЖ приводит к накоплению ключевого эффекторного пептида ренин-ангиотензиновой системы – АнгII. Известно, что последний служит противовоспалительным фактором, запускающим синтез противовоспалительных веществ [23]. Таким образом, эти данные подтверждают теорию последовательного канцерогенеза в ткани предстательной железы: при утяжелении степени хронического воспаления и фиброза нарастает степень дисплазии в ткани простаты [11, 24]. Однако роль воспаления в канцерогенезе простаты остается спорной. Знание сложного «молекулярного ландшафта», связанного с хроническим воспалением при РПЖ, может приводить к внедрению и оптимизации новых таргетных методов лечения [25].
Эффекты АнгII реализуются через два высокоаффинных рецептора: рецептор АнгII первого типа (АТ1-R) и рецептор АнгII второго типа АТ2-R [26]. АТ1-R индуцируют ангиогенез, клеточную пролиферацию, обладают антиапоптотическим эффектом. АТ2-R являются негативным регулятором сигнальных путей, зависимых от АТ1-R, и обладают антипролиферативными эффектами [27, 28].
В здоровой предстательной железе АнгII локализован в базальном слое эпителия, рецепторы АнгII первого типа – преимущественно на гладких мышцах стромы и кровеносных сосудов. Предполагается, что АнгII может опосредовать паракринные функции в отношении роста клеток и тонуса гладких мышц в предстательной железе человека [29]. Проонкогенное влияние РАС также связывают со стимуляцией ангиогенеза, который опосредуется преимущественно через АнгII-АТ1-R-зависимый сигналинг, который в опухолевых и окружающих опухоль клетках направлен на ускорение процесса пролиферации и переходу к злокачественности [15, 30, 31]. Однако существенных различий в количестве и распределении рецептора ангиотензина II первого типа (АТ1-R) при доброкачественной гиперплазии, высокодифференцированной простатической интраэпителиальной неоплазии и аденокарциноме предстательной железы не обнаружено [32].
Нами показано, что экспрессия AT2-R в тканях предстательной железы при ее пролиферативных заболеваниях имеет свои особенности. Так, она отличалась в ядрах эпителиальных клеток, тогда как в строме экспрессия оказалась одинаковой. В ядрах эпителиальных клеток уровень экспрессии AT2-R снижался в ряду ДГПЖ–ПИН–РПЖ. Наличие рецепторов АнгII второго типа в ядрах опухолевых клеток, по-видимому, свидетельствует о переходе на интракринный путь регуляции при раке простаты. При этом экспрессия AT2-R при ДГПЖ, как правило, максимальна, при РПЖ снижена относительно ДГПЖ, но выше, чем в контрольной группе. Определенная закономерность прослеживается и при ИГХ-окрашивании фокусов ПИН: отмечена тенденция к выявлению AT2-R в атипичных клетках при первичной биопсии еще до установления диагноза РПЖ, однако в этом случае ИГХ-окрашивание выражено слабее, чем при ДГПЖ.
Таким образом, увеличение активности АПФ, накопление АнгII в секрете простаты при пролиферативных заболеваниях предстательной железы на фоне дефицита рецепторов АнгII второго типа служат метаболической основой злокачественной трансформации предстательной железы. Эти выводы подтверждают также результаты ИГХ-анализа экспрессии АнгII при пролиферативных нарушениях простаты. Появление экспрессии АнгII в клетках небазального эпителия служит ранним признаком злокачественных изменений предстательной железы человека [9]. Что особенно важно, поскольку АнгII оказывает непосредственное воздействие на раковые клетки, способствуя росту опухоли, за счет влияния на адгезию, миграцию и подвижность клеток, ускоряя прогрессирование метастазирования [33].
Заключение. Результаты наших исследований расширяют представления о роли компонентов ренин-ангиотензиновой системы в патофизиологии доброкачественной гиперплазии простаты, интраэпителиальной неоплазии и рака предстательной железы, подтверждая концепцию, согласно которой активация локальной ренин-ангиотензиновой системы вовлечена в патофизиологию пролиферативных заболеваний предстательной железы. Уровень экспрессии рецепторов АнгII второго типа служит лимитирующим фактором онкогенной трансформации предстательной железы.
Уровни активности АПФ в секрете предстательной железы и эскпрессии рецепторов АнгII второго типа в ткани предстательной железы при первичной биопсии простаты могут рассматриваться как перспективные прогностические инструменты ранней детекции малигнизации предстательной железы.



