Введение. Традиционно антибактериальная терапия (АБТ) при хроническом бактериальном простатите (ХБП) нацелена на подавление роста и размножения и/или элиминацию узкого спектра наиболее изученных и легкокультивируемых облигатных уропатогенов. Данный спектр представлен различными видами семейства Enterobacteriaceae, единичными таксонами грампозитивной микрофлоры, в некоторых случаях – неферментирующими грамотрицательными бактериями, в частности Pseudomonas aeruginosa [1, 2]. Также доказано, что к манифестации заболевания причастны и некоторые возбудители, передаваемые половым путем [3].
Вместе с тем в ряде публикаций представлены убедительные данные о роли различных видов Staphylococcus spp., Streptococcus spp., Corynebacterium spp., некоторых анаэробов, вирусов и грибов в развитии ХБП [4, 5]. Однако,новые исследования и публикации по вопросу этиологической структуры ХБП глобально не меняют существующую многие десятилетия парадигму о доминирующей роли Enterobacteriaceae, следствием чего являются следующие стереотипы: 1) ХБП – это, как правило, моноинфекция, вызываемая одним из уропатогенов; 2) АБТ в подавляющем большинстве случаев направлена на элиминацию энтеробактерий – каузативных уропатогенов ХБП. Согласно клиническим рекомендациям Европейской ассоциации урологов по урологическим инфекциям (EAU Guidelines on Urological Infections) и рекомендациям Ассоциации американских семейных врачей (Association of American Family Physician), основными препаратам лечения ХБП определены фторхинолоны (ФХ) [6, 7]. Однако препараты данной группы действительно эффективны только у пациентов с первичным ХБП.
В свою очередь при рецидивирующем ХБП многофакторность патогенеза и появление полирезистентной микрофлоры, в частности карбапенем-резистентных (CREB) и БЛРС-продуцирующих (ESBL) Enterobacteriaceae, мультирезистентных Escherichia coli и P. aeruginosa, ванкомицин-резистентных Enterococcus и некоторых других микроорганизмов, обусловливает неудачи АБТ [8–12]. В целом эффективность АБТ при ХБП оценивается на уровне 60,0% [4].
Поэтому в терапии ХБП продолжается поиск альтернативных вариантов лечения с использованием антибактериальных препаратов. В случае минимальной торпидной эффективности стандартной АБТ или рецидивирующих эпизодов ХБП эти альтернативные схемы могут выступать в качестве второй или в отдельных случаях первой линии для достижения положительного клинического результата. В то же время существует предположение об изначально ошибочной позиции, определяющей этиологию заболевания на основе стандартной бактериологии. Данные исследований демонстрируют значительные различия между общепринятым этиологическим спектром и современным микробным пейзажем, верифицируемым в биоматериале пациентов с ХБП при использовании расширенной бактериологии [13, 14]. Это приводит не только к верификации узкого спектра патогенов при ХБП, но и к назначению антибактериальных препаратов, действующих именно на данный спектр микроорганизмов.
Цель исследования: сравнить микробиологическую эффективность стандартной и таргетной антибактериальной терапии на основании сопоставления результатов расширенного бактериологического исследования биоматериала пациентов с ХБП до и после лечения.
Материалы и методы
Дизайн исследования. Одноцентровое обсервационное сравнительное исследование (2012–2019).
Этическое заявление. Исследование одобрено Этическим комитетом Ростовского государственного медицинского университета (протокол № 17/12 от 04.12.2012) и соответствует положениям Хельсинкской декларации (в редакции Форталеза, Бразилия, октябрь 2013 г.). Все пациенты подписали информированное согласие на участие в исследовании и разрешение на публикацию персональных медицинских данных.
Характеристика выборки. В исследование включены 60 пациентов в возрасте 20–45 лет с ХБП.
Критерии включения: наличие симптомов, характерных для простатита, длительностью более 3 мес.; боль в «типичных локализациях»: промежности и/или надлонной области, отраженная в мошонку, крестец, паховые области; симптомов нижних мочевыводящих путей (СНМП), лейкоцитурии, позитивной культуры постмассажной мочи (ПММ), с более чем 10-кратным доминированием обсемененности ПММ над 1 и 2 порциями пробы Meares–Stamey. Критерии исключения: острые инфекции нижних мочевых путей и половых органов; инфекции, передаваемые половым путем; рак простаты; сердечная/почечная/печеночная недостаточность; предшествующие хирургические вмешательства на простате и нижних мочевых путях (не позднее чем за 3 месяца до исследования); лучевая терапия; лекарственная, алкогольная зависимости; наличие аллергических реакций на антибактериальные препараты (АБП).
Обследование. Каждый пациент проходил инициальное (на диагностическом этапе) и контрольное обследования (через 3 мес. после окончания лечения). Пациенты на первом визите заполняли валидированные опросники NIHCPSI, IPSS-QoL, IIEF-5. У всех обследуемых пациентов получение биоматериала для анализа осуществляли посредством 4-стаканной пробы Meares–Stamey. В каждом образце биоматериала определяли количество лейкоцитов.
Бактериологическое исследование уретральной, пузырной и постмассажной мочи всем пациентам проводили на расширенном наборе (n=12) питательных сред для аэробных и анаэробных бактерий (HiMedia Laboratories Ltd., Махараштра, Индия), соответственно в аэробных и анаэробных условиях культивирования (AnaeroHiGas Pack, HiMedia, HiMedia Laboratories Ltd., Махараштра, Индия) с целью максимально возможной идентификации микроорганизмов. Для сопоставления динамики показателей обсемененности и частоты идентификации микроорганизмов использованы данные по ПММ.
Постановку индивидуальных антибиотикограмм проводили с целью оценки чувствительности идентифицированных микроорганизмов к 13 АБП: 6 фторхинолонам (ФХ), 2 макролидам (МЛД) и по 1 представителю групп пероральных цефалоспоринов (ЦЕФ), производных фосфоновой кислоты и нитрофуранов, тетрациклинам и гликопептидам. Показатели минимальной ингибирующей концентрации определяли посредством диско-диффузионного метода на агаровой среде Mueller–Hinton в соответствии с рекомендациями Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute, CLSI), Европейского комитета по тестированию чувствительности к противомикробным препаратам (European Committee for Antimicrobial Susceptibility Testing, EUCAST) с помощью стандартных дисков «HiMedia» (HiMedia Laboratories Ltd., Махараштра, Индия).
Рандомизация и терапия
После инициального обследования все пациенты были рандомно разделены на две группы. В обеих группах осуществляли терапию по стандартной схеме: АБП (с учетом данных индивидуальных антибиотикограмм)+αадреноблокатор+нестероидный противовоспалительный препарат.
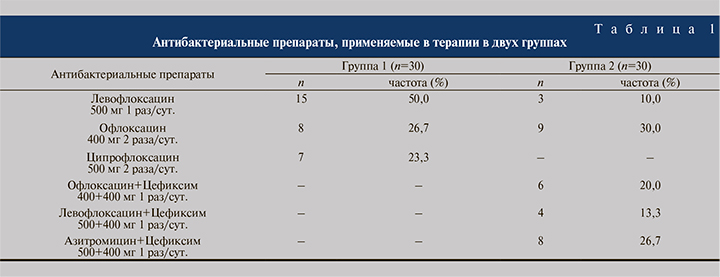
В группе 1 проводили терапию одним из ФХ (левофлоксацин, офлоксацин или ципрофлоксацин), направленную исключительно на подавление каузативных уропатогенов с учетом именно их чувствительности. В группе 2 применяли либо монотерапию ФХ (левофлоксацин или офлоксацин), либо сочетание одного из ФХ с пероральным ЦЕФ (цефиксим), либо комбинацию МЛД (азитромицин) с ЦЕФ (цефиксим) на основании чувствительности всех идентифицированных в биоматериале бактерий, таким образом обеспечивая воздействие АБП/АБПов на весь спектр микроорганизмов. Спектр и частота использования АБП и их комбинаций в группах представлены в табл. 1. Медикаментозную терапию проводили в течение 1 мес. Весь спектр обследования повторяли на контрольном визите через 3 мес. после окончания терапии.
Статистический анализ
Статистическую обработку результатов осуществляли с помощью прикладного пакета Statistica 10.2 (StatSoft Inc., Талса, Оклахома, США). Нормальность распределения показателей определяли с помощью тестов Shapiro–Wilk и Колмогорова–Смирнова. Описательная статистика количественных признаков представлена в виде среднего (M) и стандартного отклонений (SD), в таблицах – M±SD. Сравнение независимых переменных в группах проводили с помощью статистических методов: t-критерия Student (unpaired and paired t-test для зависимых и независимых выборок), Pearson's χ2-test. Принятый уровень достоверности p<0,05 при а=0,05.
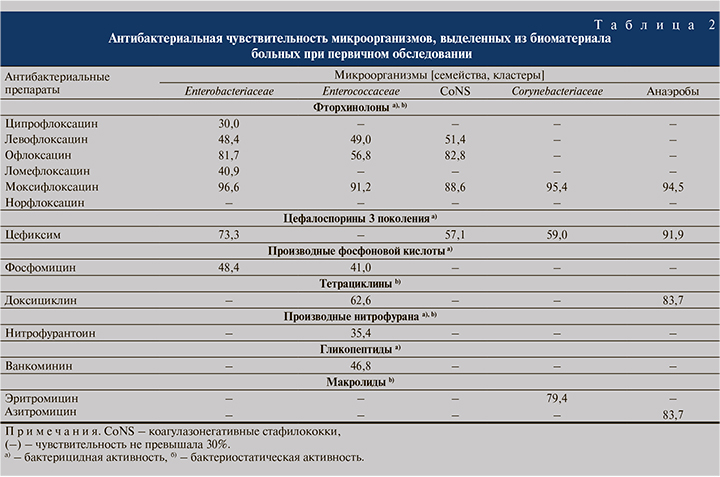
Результаты. Исходно (при первичном обращении) в ПММ у пациентов группы 1 верифицировано 9 таксонов аэробных микроорганизмов, 8 – анаэробных, в группе 2 – 10 аэробных и 9 анаэробных. Показатель обсемененности ПММ ≥103 КОЕ/мл в группе 1 регистрировали для 5 аэробов и 7 анаэробов, в группе 2 – для 10 и 8 таксонов соответственно. Данные индивидуальной антибиотикочувствительности микроорганизмов, выделенных из ПММ в количестве ≥103 КОЕ/мл у пациентов обеих групп представлены в табл. 2. Антибиотикочувствительность каузативных патогенов Enterobacteriaceae к ФХ распределилась по вектору: моксифлоксацин → офлоксацин → левофлоксацин → ломефлоксацин → ципрофлоксацин. Практически 50,0% выделенных микроорганизмов были чувствительны к левофлоксацину и более 80,0% – к офлоксацину. В отношении анаэробных бактерий наибольшей активностью обладал цефиксим (91,9%).
Результаты первичного и повторного культуральных исследований ПММ приведены в табл. 3.
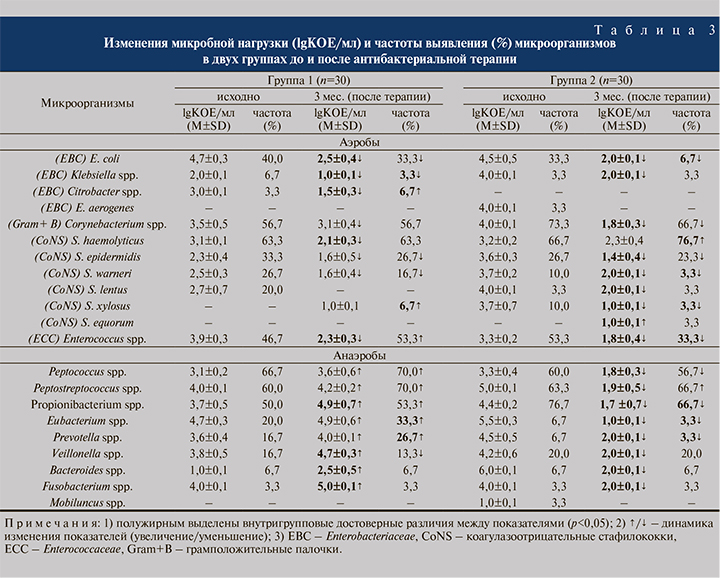
В группе 1 пациентов, получавших только ФХ, в кластере аэробов наблюдалось снижение частот обнаружения пяти таксонов, но с достоверными (р<0,05) показателями только для одного из них – Кlebsiella spp. На контрольном визите в ПММ отмечено изменение в спектре микроорганизмов только за счет увеличения (р<0,05) частоты обнаружения Citrobacter spp. и появления таксона коагулазонегативных стафилококков (КоНС) – Staphylococcus xylosus. В анаэробном кластере микроорганизмов частота верификации большинства таксонов (пяти из восьми) за исключением Bacteroides spp. и Fusobacterium spp. достоверно повысилась (р<0,05) для Eubacterium spp. и Prevotella spp. Таким образом, к 3-му месяцу наблюдения определено достоверное снижение частоты идентификации в биоматериале для 5 аэробов и 4 анаэробов.
В группе 2 на контрольном визите спектр микроорганизмов в ПММ практически не изменился, за исключением элиминации Enterobacter aerogenes и идентификации Staphylococcus equorum. Среди 10 аэробных микроорганизмов снизилась частота обнаружения 6 таксонов с достоверными значениями только для 4 микроорганизмов. Значимый (р<0,05) прирост частоты выявляемости отмечен только у Staphylococcus haemolyticus, но со снижением количественных показателей. В анаэробном кластере по сравнению с аналогичными показателями группы 1 снижаются частоты обнаружения четырех таксонов из восьми с достоверными значениями для Propionibacterium spp., Prevotella spp. и Eubacterium spp. Четко прослеживается закономерность снижения (р<0,05) бактериурии в ПММ как для аэробов, так и для анаэробов.
Обсуждение. При расширенном бактериологическом исследовании в двух группах в ПММ обнаружен 21 таксон микроорганизмов. В порядке убывания по совокупной частоте идентификации они расположились по вектору: анаэробы (100,0%), КоНС (86,7%), Corynebacterium spp. (65,0%), Enterococcus spp. (50,0%), Enterobacteriaceae (45,0%). Таким образом, анаэробы и КоНС явились доминирующими в ПММ при ХБП. Полученные данные не корреспондируют с концепцией ряда исследований о преобладающей роли Enterobacteriaceae при ХБП. Так, А. Trinchieri et assoc. (2021) при исследовании 1027 изолятов из ПММ, секрета простаты (СП), эякулята и уретры определили превалирование E. coli (31,0%) и Enterococcus spp. (22,0%). Также К. Stamatiou et al. (2019) при исследовании 389 пациентов с ХБП установили, что в ПММ/СП (465 образцов) доминировали E. coli (142/465 образцов) и E. faecalis (102/465). Значительно реже в обоих исследованиях были выделены облигатные уропатогены Klebsiella spp., Proteus spp. и Pseudomonas aeruginosae. Однако К. Stamatiou et al. (2019) среди иных кластеров микроорганизмов также значительно часто идентифицировали КоНС (108/465 образцов). Необходимо отметить, что в данных работах анаэробы не определялись в связи с особенностями проведения бактериологического исследования [11, 15].
Согласно клиническим рекомендациям Европейской ассоциации урологов по урологическим инфекциям (EAU Guidelines on Urological Infections), КоНС, Corynebacterium spp. и анаэробы относятся к дебатируемым микроорганизмам, т.е. их способность вызывать развитие релевантного воспалительного процесса в простате остается дискутабельной [7]. Авторские коллективы приводят различные данные исследований, по результатам которых формируются контрверсии о простатотропном патогенном потенциале отдельных дебатируемых микроорганизмов (анаэробов, внутриклеточных патогенов, КоНС, Corynebacterium spp., Peptococcus spp., вирусов и др.) [13–16]. Тем не менее не во всех случаях у пациентов с симптомами, характерными для простатита, в биоматериале верифицируют каузативные уропатогены, но в свою очередь выявляют дебатируемые микроорганизмы или бактерии с «неизвестной простатотропной патогенностью» [17–19]. В таком случае необходимо ли нам следовать стандартным протоколам АБТ для ХБП? Мы полагаем, что в таких случаях целесообразно формировать индивидуальную лечебную траекторию с учетом антибиотикочувствительности, фармакокинетики, принципов потенцирования/синергии АБП и спектра антибактериальной активности.
Для подтверждения выдвинутой гипотезы нами на основании анализа антибиотикограмм отмечено четыре АБП с наиболее значительной (по частоте) и обширной (по охвату) противомикробной активностью (представлены в порядке убывания, max–min) к верифицированным в ПММ таксонам микроорганизмов: моксифлоксацин (КоНС 88,6%– Enterobacteriaceae 96,6%), цефиксим (Enterococcaeae <30% – анаэробы 91.9%), офлоксацин (Corynebacteriaceae/анаэробы <30%–КоНС 82,8%) и левофлоксацин (Corynebacteriaceae/ анаэробы <30%–КоНС 51,4%). Действительно, моксифлоксацин является ультимативным АБП, обладающим гибридным бактерицидным и бактериостатическим эффектами, особенно в отношении грамположительных кокков и анаэробов. Необходимо отметить его способность накапливаться в ткани и секрете простаты благодаря своей липофильности по сравнению с другими ФХ [20]. Однако данный респираторный ФХ не может быть рассмотрен в составе стартовой терапии ХБП. Это обусловлено двумя основными причинами: моксифлоксацин не включен в гайдлайны по лечению ХБП, и его назначение при ХБП является off-label [7, 21]. В свою очередь офлоксацин и левофлоксацин являются АБП первой линии при ХБП. Цефиксим не входит в список основных АБП для терапии ХБП, но его назначение при неосложненных инфекциях мочевых путей допустимо [7, 22].
А. Trinchieri и соавт. (2021) при оценке частоты антибактериальной резистентности микроорганизмов из 1027 изолятов ПММ, СП, эякулята и уретры установили, что среди Enterobacteriaceae (E. coli, Proteus spp., Klebsiella spp.) устойчивость к ФХ и ЦЕФ варьировалась в пределах 12,0– 31,0%, к МЛД – в пределах 0,0–20,0%. Для Enterococcus spp., Staphylococci и Streptococci частота резистентности к ФХ определена на уровнях 21,0%; 21,0 и 4,0% соответственно, к ЦЕФ – на уровнях 93,0%; 16,0 и 4,0%, к МЛД – на уровнях 77,0%; 42,0 и 26,0% соответственно [15]. Таким образом, в исследовании также показана относительно высокая резистентность Enterobacteriaceae, Enterococcus и грамположительных кокков к ФХ и ЦЕФ. МЛД, входящие в первую линию терапии ХБП при идентификации интрацеллюлярных патогенов, продемонстрировали высокую эффективность в отношении Enterobacteriaceae. Чувствительность Enterococcus spp., Staphylococci к данной группе АБП была существенно ниже. В нашем исследовании наименьшая резистентность к МЛД отмечена у анаэробов (83,7% к азитромицину) и Corynebacteriaceae (79,4% к эритромицину), чувствительность же иных таксонов микроорганизмов к данному АБП не превысила 30,0%.
С учетом ограниченного арсенала применения АБП по данным индивидуальных антибиотикограмм, инструкций препаратов и клинических рекомендаций по терапии ХБП при назначении лекарственных средств в группе 2 применены следующие корректировки. Во-первых, исключен прием ципрофлоксацина в связи с пограничными показателями чувствительности микроорганизмов к данному АБП в биоматериале пациентов в группе 2. Во-вторых, использованы комбинации левофлоксацина/офлоксацина+цефиксима и азитромицина+цефиксима. В-третьих, подбор АБП каждому пациенту выполнялся с учетом того, что один или комбинация АБП охватывала весь спектр патогенов, идентифицированных в ПММ, т.е. при полной антибиотикочувствительности бактерий к назначаемым препаратам. В-четвертых, не подвергались изменениям дозировки, кратность и продолжительность приема АБП.
Сравнительный анализ данных бактериологического исследования на этапе обследования и на контрольном визите показал следующее. Несмотря на незначительные достоверные различия в частоте встречаемости бактерий в обеих группах, в группе 2 отмечено существенное снижение микробной нагрузки ПММ аэробами и анаэробами ниже пороговой патогенной концентрации 103 КОЕ/мл на контрольном визите. Соответственно, «точечно» подобранные ФХ наряду с кросс-сочетаниями цефиксима с офлоксацином/левофлоксацином и азитромицином, перекрывающие весь спектр микроорганизмов, определены как более эффективные в снижении микробной нагрузки по сравнению с монотерапией ФХ, ориентированной только на доминирующих в биоматериале уропатогенов в группе 1. Обусловлено это, с одной стороны, эскалацией бактерицидного эффекта в комбинации ЦЕФ и ФХ или потенцированием бактерицидного и бактериостатического эффектов в комбинации ЦЕФ с МЛД, с другой – таргетным воздействием ФХ. Следует отметить, что полная элиминация бактерий к контрольному визиту достигнута в группе 1 единственно для Staphylococcus lentus, а в группе 2 – для E. aerogenes и Mobiluncus spp., что свидетельствует о крайне незначительной элиминации возбудителей после АБТ. В связи с этим возникает, на наш взгляд, важный вопрос: есть ли необходимость в элиминации условно-патогенных микроорганизмов из ПММ? Ведь элиминация одного из видов меняет эволюционно сложившиеся симбиотические взаимоотношения в биотопе. Возможно, наиболее предпочтительно снижать количественные показатели (обсемененность) микроорганизмов? Напротив, в отношении комбинированной терапии V. Magri et al. (2019) отметили, что сочетание левофлоксацина и азитромицина в 90,0% наблюдений опосредовало элиминацию патогенов по сравнению с монотерапией левофлоксацином, при которой эрадикация была достигнута в 79,0% случаев [23].
Необходимо отметить, что опубликовано значительное число исследований, которые посвящены в основном сравнению эффективности различных ФХ и комбинаций ФХ с МЛД для терапии ХБП, но игнорируют оральные ЦЕФ [24–26]. В свою очередь мы представили данные, которые свидетельствуют об эффективности комбинаций оральных ЦЕФ с ФХ/МЛД. И. А. Бочков и соавт. (2011) также продемонстрировали данные, свидетельствующие о высокой чувствительности к ряду ЦЕФ и ФХ (74,6–91,0%) представителей Enterobacteriaceae, кроме Klebsiella spp. и Enterobacterium spp., а также КоНС; к МЛД (62,9–77,9%) наименьшая резистентность определена у Streptococcus spp. [27]. В свою очередь M. S. Bader и соавт. (2020) приводят данные, свидетельствующие о возможном использовании оральных ЦЕФ при step-down-терапии инфекций мочевой системы при известной антибиотикочувствительности [28]. Необходимо отметить, что В. Н. Крупин и соавт. (2019) полагают, что неэффективность АБТ при ХБП во много связана с неадекватной интрапростатической пенетрационной и кумулятивной способностью многих АБП [29]. ФХ, несомненно, являются в данном отношении эталонными. Однако, по данным обзора B. A. Lipsky и соавт. (2010) накопление в ткани простаты цефиксима (1,08 mg/g) сопоставимо с ципрофлоксацином (0,6–4,18 mg/g) и прулифлоксацином (1,9–5,5 mg/g) и незначительно уступает азитромицину (2,54 mg/mL) [30].
Таким образом, несмотря на ограниченность данных об использовании оральных ЦЕФ в терапии ХБП в виде монотерапии, следует рассмотреть данные препараты в качестве дополнительных в определенных ситуациях, при которых назначение ЦЕФ будет обусловлено объективными данными.
Резюмируя, необходимо выделить несколько ключевых моментов, базированных на результатах проведенного исследования:
- Стандартная АБТ не приводит к полной эрадикации возбудителя.
- Таргетная АБТ не вызывает значительного достоверного изменения спектра микроорганизмов в биоматериале.
- На контрольном визите после стандартной монотерапии (группа 1) отмечено более выраженное снижение (достоверное и недостоверное) частоты выделения и показателей обсемененности для аэробов; напротив, отмечено увеличение (достоверное и недостоверное) частоты идентификации и показатели обсемененности для анаэробов.
- На контрольном визите после таргетной монотерапии и/или комбинированной терапии отмечено значительное (преимущественно достоверное) снижение частоты выделения и обсемененности как для аэробов, так и для анаэробов.
- Рецидивов ХБП в течение периода наблюдения отмечено не было, однако в перспективе данная возможность имеет место быть, особенно у пациентов в группе монотерапии.
Заключение. На современном этапе АБП остаются основой консервативной терапии в лечении инфекций мочевых путей и внутренних половых органов, в частности ХБП. Тем не менее рост антибиотикорезистентности диктует необходимость принятия более осторожных решений при назначении АБП. Несомненно, что следование клиническим рекомендациям является обязательным в системах здравоохранения различных стран, однако состав стартовых препаратов не очень обширен. Использование расширенного бактериологического исследования и постановка индивидуальных антибиотикограмм необходимы на диагностическом этапе для получения достоверных данных. Мы считаем, что применение в качестве стартовой терапии как альтернативных препаратов из группы ФХ не первой линии, так и комбинаций ФХ с ЦЕФ/МЛД с учетом антибиотикочувствительности микроорганизмов в биоматериале может быть оправданно, особенно в регионах с повышенной резистентностью микроорганизмов к ФХ. При этом важно учитывать чувствительность всех микроорганизмов, идентифицированных в биоматериале, а не опираться только на показатели в отношении каузативных уропатогенов или доминирующих микроорганизмов. В оценке клинических и лабораторных результатов также следует учитывать факт – АБТ не всегда может приводить к полной элиминации потенциального возбудителя. Однако мы считаем, что не следует добиваться «стерильности» биоматериала в случае стабильной редукции клинической картины после полного 4–6-недельного курса при условии отсутствия интрацеллюлярных патогенов.



