Введение. В современной клинической практике для оценки мужской репродуктивной функции рекомендовано [1] выполнение спермограммы – семиологического анализа по стандартным протоколам, описанным в руководствах ВОЗ по исследованию и обработке эякулята человека (в главе «Стандартные тесты», 5-е издание, 2010 г. [2], и «Базовое исследование», 6-е издание, 2021 г. [3]). В 2010 г. диапазоны референтных значений полученных показателей были определены на 400–1900 образцах спермы фертильных мужчин из 8 стран c трех континентов, чьи партнерши оказались беременными в течение 12 мес. после прекращения контрацепции [4]. При этом в качестве минимальных референтных значений были предложены 5%-ные процентили, полученные при анализе их распределения: объем спермы – 1,5 мл; общее число сперматозоидов – 39 млн; концентрация сперматозоидов – 15 млн/мл; жизнеспособность сперматозоидов – 58%; прогрессивная подвижность сперматозоидов – 32%; общая подвижность сперматозоидов – 40%, морфология сперматозоидов (доля нормальных форм) – 4,0%. Эти значения оказались близкими к аналогичным показателям, полученным ранее в популяционных исследованиях, проведенных в Германии, Норвегии, США и других странах [5–7]. Проведенные после 2010 г. изыскания позволили дополнить базу данных Всемирной организации здравоохранения (ВОЗ) показателями эякулята мужчин из 12 государств, включая Китай и страны Африки (данные о фертильных мужчинах из России в базу включены не были), что привело к изменению референтных значений для концентрации, а также прогрессивной и общей подвижности сперматозоидов, которые составили 16 млн/мл, 30 и 42% соответственно [8]. Значения концентрации (или числа сперматозоидов) и подвижности сперматозоидов, меньше указанных, интерпретируют как «олигозооспермия» и «астенозооспермия» соответственно; отсутствие сперматозоидов в эякуляте – как «азооспермия». При этом авторы руководства подчеркнули, что мужчины, проживающие в разных странах, могут иметь региональные, обусловленные этническими и другими факторами особенности распределения параметров эякулята [3].
В частности, афроамериканцы США, жены которых были беременны, имели существенно более низкий объем спермы, концентрацию и общее количество подвижных сперматозоидов по сравнению с белыми и латиноамериканцами [9]. Поэтому авторы руководства рекомендовали «каждой лаборатории установить собственный референтный диапазон, полученный при тестировании с использованием контрольных материалов, основываясь на положительных и отрицательных прогностических значениях, рассчитанных с учетом клинического результата – наступления беременности, выкидыша и др.» (3, с. 93, 96, 101, 104) [3]. Это полностью согласуется с нашей позицией, поскольку еще за год до выхода данного Руководства ВОЗ мы по данным пилотных исследований установили, что у фертильных мужчин – жителей мегаполиса (Москва) параметры стандартного спермиологического исследования заметно отличаются от референтных диапазонов по ВОЗ [2, 3].
Уточнение нормативных показателей эякулята россиян не только представляет академический интерес, но и определяет необходимость и целесообразность специфического лечения, в т.ч. с использованием дорогостоящих процедур вспомогательных репродуктивных технологий (ВРТ) и, соответственно, затрат на это системы здравоохранения.
Цель данного исследования: установить референтные диапазоны показателей базового анализа эякулята фертильных мужчин-россиян для повышения клинико-экономической эффективности оказания помощи бесплодным парам.
Материалы и методы. Исследование многоцентровое поперечное ретроспективное. По результатам клинико-лабораторного обследования сформирована группа фертильных мужчин, соответствовавших следующим критериям:
- диагностированная беременность у жены (постоянной партнерши) по данным хорионического гонадотропина человека (ХГЧ) (больше 100 мМе/мл) и/или ультразвукового исследования (УЗИ) (наличие плодного яйца в матке);
- исследование эякулята выполнено в специализированных андрологических лабораториях по протоколам ВОЗ;
- между датой выполненного исследования и расчетной датой наступления беременности не более 3 мес. (анализ мог быть выполнен до даты беременности или после установления факта беременности);
- беременность в естественном цикле;
- отсутствие какого-либо специфического лечения не менее, чем за 3 мес., до даты беременности;
- исход беременности (роды, медицинские аборты, выкидыши, замершие беременности) не учитывался.
Анализ эякулята проводили в соответствии с рекомендациями Руководства ВОЗ по исследованию спермы, актуального на момент обследования [11]. Объем оценивали мерной центрифужной пробиркой. Концентрацию сперматозоидов определяли методом гемоцитометрии; кратность разведения эякулята (1:10; 1:20; 1:50) определяли после предварительной оценки концентрации сперматозоидов во влажном (нативном) препарате, приготовленном для подсчета подвижности сперматозоидов. Подсчет сперматозоидов в гемоцитометре проводили после разведения фиксирующим раствором методом световой микроскопии при 400-кратном увеличении, оценивая количество сперматозоидов на поле, определяемом сеткой счетной камеры; в подсчет принимались только сперматозоиды, лежавшие головками внутри сетки камеры. Подвижность определяли во влажном препарате методом световой микроскопии при 400-кратном увеличении при комнатной температуре по стандартному протоколу: подвижность каждого оценивалась как быстрая прогрессивная (категория А), медленная прогрессивная (В), непрогрессивная (С) или полная неподвижность (Д); подсчитывали 200 сперматозоидов. Морфологию сперматозоидов после окраски по Папаниколау оценивали по «строгим» Тигербергским критериям [12]: подсчитывали морфологически нормальные сперматозоиды и типы дефектов для каждого аномального сперматозоида. Мазки готовили из капли спермы объемом 20 мкл, фиксировали не менее 5 мин абсолютным этанолом. Слайды были проанализированы при 1000-кратном увеличении (объектив светлого поля с масляной иммерсией) обученным опытным врачом клинической лабораторной диагностики; характеризовали не менее 200 сперматозоидов. Сперматозоид считался нормальным, если соответствовал следующим критериям [2]:
- головка гладкая, правильно очерченная и в целом овальной формы;
- акросомальная область, составляет 40–70% площади головки без больших вакуолей и имеет не более двух мелких вакуолей;
- постакросомальная область не содержит вакуолей;
- средняя часть примерно такой же длины, как и головка сперматозоида, достаточно тонкая и одинакового диаметра по всей длине;
- хвост имеет одинаковый диаметр по всей длине, тоньше средней части и длину около 45 мкм (примерно в 10 раз больше длины головки);
- остаточная цитоплазма считается аномалией только при избытке, т.е. когда она превышает треть размера головки сперматозоида.
Сомнительные случаи – «погранично нормальные сперматозоиды» – трактовались как «аномальные».
Для интегральной оценки качества спермы вычисляли число прогрессивно подвижных сперматозоидов в эякуляте (ЧППСЭ): объем (мл) х концентрация (млн/мл) х доля прогрессивно подвижных сперматозоидов (%)/100; выражали в млн/эякулят. Данные представляли в таблице в виде процентилей, минимальных и максимальных значений; графически – в виде диаграммы размаха, где «выбросы» – значения, отстоящие больше или меньше, чем в 1,5 («контуры») и 2 раза («пределы»), по отношению к межквартильному диапазону.
Другие клеточные элементы также регистрировались, но не учитывались и не анализировались в данном исследовании.
Всего в выборку включены 445 мужчин, обратившихся в ЛПУ, где работали авторы статьи, в рамках диспансеризации по поводу сексуальных дисгармоний, хронического неинфекционного простатита или замершей беременности.
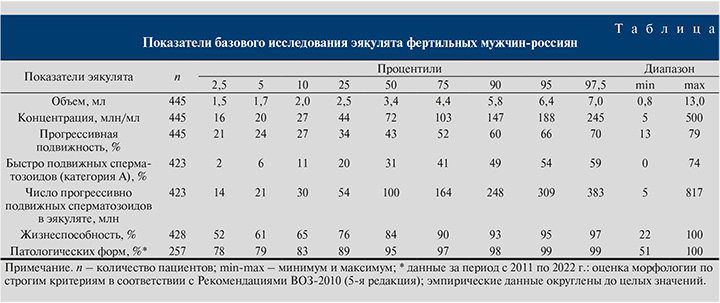
Период сбора данных: 1995–2000 гг. – 41 человек; 2001–2010 гг. – 147; 2011–2022 гг. – 257 человек.
Поддержкой базового исследования спермы являлся новый стандарт ISO23162:2021 (Международная организация по стандартизации, 2021) [13], основанный на тех же принципах, что и рекомендации ВОЗ.
Результаты исследования. Из представленных в таблице данных видно, что средние (медианные) значения для объема составляют 3,4 мл, концентрации – 72 мл/мл, доли прогрессивно подвижных сперматозоидов – 43%, морфологически нормальных форм – 5%. Нижний 5%-ный процентиль при этом составляет: для объема эякулята – 1,7 мл, концентрации сперматозоидов – 20 млн/мл, доли прогрессивно подвижных сперматозоидов – 24%, доли морфологически нормальных форм – 1%. Минимальные значения данных показателей эякулята: объем – 0,8 мл, концентрация – 5 млн/мл, прогрессивная подвижность – 13%, нормальные формы – 0% (100% сперматозоидов морфологически изменены).
Полученные средние значения весьма близки к ранее представленным нами данным о спермограмме фертильных мужчин, обследованных в Москве (медиана) и Уфе (средняя арифметическая): объем – 3,5 и 3,6 мл, концентрация – 72 и 70 млн/мл, прогрессивно подвижных – 43 и 49% соответственно [10, 14].
В соответствии с Рекомендациями ВОЗ [3] значения 5%-ного процентиля следует считать нижними пределами референтного диапазона, характерного для фертильных мужчин, т.е. нижней границей «нормы» для данных показателей эякулята мужчин-россиян.
В то же время из диаграмм размаха видно, что минимальным «невыпадающим» значением для объема эякулята является величина 0,8 мл (рис. 1А), для концентрации – 5 млн/мл (рис. 1Б), для прогрессивной подвижности – 13% (рис. 1В), для процента патологических форм – 100% (рис. 1Д), что соответствует минимальным значениям данных показателей.
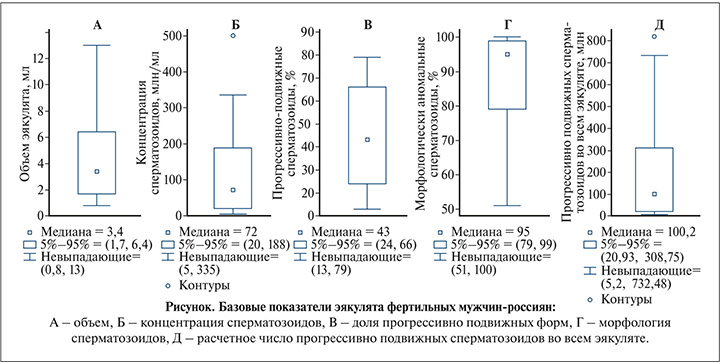
Расчетные значения числа прогрессивно подвижных сперматозоидов в эякуляте фертильных мужчин показаны в таблице и на рис. 1Д: среднее (медиана) значение данного показателя – 100 млн в эякуляте, нижний 5%-ный процентиль составил 21 млн, минимальное значение – 5,2 млн.
Обсуждение результатов. Мужское бесплодие является актуальной и значимой проблемой урологии и всей отрасли здравоохранения в целом: бесплодными, согласно анализу популяционных исследований, опубликованному ВОЗ в 2023 г. [15], являются 8,2–21,8% мужчин. В последние годы отмечается глобальная тенденция к снижению количественных показателей эякулята у мужчин, проживающих в разных странах и на разных континентах. За период с 1973 по 2018 г. концентрация сперматозоидов снизилась на 51,6%, при этом темпы снижения после 2000 г. удвоились и в настоящее время составляют 2,64% в год [16]. Отечественные исследователи выявили аналогичные тенденции в Российской Федерации: темпы снижения концентрации сперматозоидов в эякуляте с 2016 по 2021 г. составили 1,8% в год [17], а число мужчин с первично диагностированным бесплодием за период с 2000 по 2018 г. увеличилось в 1,8 раза. При этом общее число мужчин, страдающих бесплодием в нашей стране, оказалось равным 0,1% мужского населения детородного возраста, что значительно ниже аналогичных показателей, полученных в других странах, и может свидетельствовать о необходимости совершенствования системы регистрации этого заболевания и формирования отчетности [18]. Однако количественный учет случаев мужского бесплодия осложняется несколькими обстоятельствами.
Во-первых, бесплодие – болезнь пары, когда трудно однозначно установить, по чьей «вине» отсутствует желанная беременность. Низкий потенциал фертильности одного из супругов может быть компенсирован высоким потенциалом другого [19]. Имеются данные о том, что в определенных ситуациях мы имеем право говорить о «биологической несовместимости партнеров»: смена партнеров позволяет обоим супругам добиваться рождения биологически своих детей [20].
Во-вторых, до сих пор не определены четкие критерии, на основании которых мы вправе говорить о снижении фертильности мужчины, в т.ч. имеем основание ставить диагноз «мужское бесплодие», а не «бесплодие в браке». Исследования показали, что результаты базового анализа спермы малополезны для разграничения успеха и неудачи спонтанной беременности, даже если существуют популяционные корреляции между параметрами спермы и различными исходами фертильности и бесплодия [21, 22].
Формально диагноз «мужское бесплодие» (N 46 по МКБ-10 и GB04.0 по МКБ-11) необходимо ставить, когда в сперме вообще не находят сперматозоидов. А когда они есть, но их мало, или они плохо двигаются, или имеют неидеальную форму? Когда применять другие диагнозы (по новой классификации МКБ-11): GB04.Y – «другое уточненное мужское бесплодие» или GB04.Z – «мужское бесплодие неуточненное»? Где граница нормы, когда пациента надо лечить, а когда нет?
Лабораторные нормативы качества спермы неоднократно пересматривались за последние десятилетия, и в последнем Руководстве ВОЗ [3] допустимые концентрация, подвижность и нормальная морфология сперматозоидов в разы меньше, чем полвека назад.
При этом авторы данного руководства вовсе отказались от понятия «норма», ограничившись указанием «статистический диапазон», внутри которого находятся 95% случаев. Следовательно, при обследовании по поводу бесплодия следует учитывать, что, согласно полученным авторами руководства результатам, 5% фертильных мужчин имели показатели спермограммы ниже, чем референтные значения.
Из представленных в статье данных следует (см. таблицу), что референтные значения базовых исследований эякулята фертильных мужчин-россиян отличаются от международных данных, представленных в Руководстве ВОЗ 6-й редакции, 2021 [3]: нижний 5%-ный процентиль у россиян больше для концентрации сперматозоидов (20 и 16 млн/мл соответственно) и объема эякулята (1,7 и 1,4 мл соответственно), меньше – для доли прогрессивно подвижных сперматозоидов (24 и 30% соответственно). При этом наши данные весьма близки к данным Руководства ВОЗ 4-й редакции 1999 г. [11]: 20 млн/мл, 2 мл и 25% соответственно. Верхний 95%-ный процентиль для аномальной морфологии оказался равным 99%, что подтверждает мнение о крайне низкой предсказательной способности данного показателя в оценке возможности зачатия [23, 24], за исключением некоторых специфических дефектов сперматозоидов (легко обнаруживаемых при поражении 99 или 100% сперматозоидов), которые связаны с генетическими нарушениями (глобозооспермия, макроцефалия, синдром декапитированного спермия и дисплазия фиброзной оболочки) [25]. Сопоставляя полученное нами референтное значение для морфологии с указанными в Рекомендациях ВОЗ [3], следует иметь в виду, что пациенты нашей группы зачали ребенка в естественном цикле, в то время как предложенные F. Kruger и соавт. [26, 27] диапазоны <4%, 4–14%, >14% основаны на результатах экстракорпорального оплодотворения (ЭКО): in vitro оплодотворение в стандартном протоколе при таком проценте нормальных форм, по их данным, имело место в 8%, 64 и 88% соответственною. При этом число обследованных пар с данной морфологией было достаточно скромным: 13, 32 и 71 соответственно [26, 27]. Lars Björndahl, главный редактор актуального Руководства ВОЗ [3], в своей недавней статье подчеркивает, что «в шестом издании парадигматический сдвиг заключается в том, что морфология сперматозоидов рассматривается как предиктор успеха или неудачи ВРТ, а также должна использоваться в качестве индикатора функции яичек и придатков яичек» [21].
Интерпретируя эти данные, необходимо обратить внимание еще на несколько важных методических аспектов.
Во-первых, трактовка результатов спермограммы не может быть дихотомической и категоричной: «фертилен» или «бесплоден».
Приведенные контрольные пределы не представляют собой границы между фертильными и бесплодными мужчинами; это описание распределения результатов референтной популяции, в которую входят не только мужчины с высокой фертильностью. Установленные на основании 5%- или 95%-ных процентилей диапазоны позволяют утверждать, что в 95% случаев у фертильных мужчин показатели спермограммы будут в данных пределах. Но это не означает, что если значения выходят за границы этого диапазона, то мужчина обязательно будет бесплоден [21]. Предметом анализа была выборка только фертильных мужчин, но не бесплодных, поэтому полученные параметры распределения не позволяют судить о бесплодии, наоборот, они дают основание рассчитывать на зачатие естественным путем.
Выполненная несколько лет назад критическая оценка работ по изучению вероятности наступления спонтанной беременности позволила прийти к выводу о том, что определение принадлежности мужчин к классификационной категории, согласно референтным интервалам ВОЗ, имеет низкую ценность для прогнозирования зачатия и выбора метода лечения [28]. Вероятно, лучшей референтной популяцией могут быть мужчины в парах, у которых зачатие произошло в течение четырех циклов попыток, чтобы уменьшить включение пар, которые достигли зачатия, несмотря на возможный мужской фактор [29]. Краеугольные камни для этого теперь доступны в пересмотренном руководстве ВОЗ [3] и в стандарте международной организации по стандартизации (ISO – international organization for standardization) 23162 для базового исследования спермы [30].
Тем не менее, согласно методологии, используемой авторами Руководства ВОЗ [3], при снижении показателя ниже значений 5%-ного процентиля мы вправе говорить о возможном или вероятном вкладе одного или нескольких параметров спермы в многофакторное состояние – неспособность пары зачать ребенка в течение достаточно длительного периода времени, состояние также связанное с состоянием женской репродуктивной системы [31]. Вероятность такого вклада повышается, если подобные нарушения фиксируются неоднократно.
Но речь при этом должна идти не о снижении фертильности как константе, а только о состоянии в настоящий момент времени. Снижение показателей спермограммы ниже референтных значений может быть транзиторным, т.е. временным, вызванным какими-то действующими непродолжительное время внешними неблагоприятными факторами: интоксикацией, перегреванием, стрессами и др. Примером этого является COVID-19 [32]. Спустя время (обычно дольше продолжительности сперматогенеза – ~3 мес.) качество эякулята восстанавливается и может наступить спонтанное зачатие. Этим можно объяснить получение беременности от мужчин, показатели спермограммы которых были существенно хуже нормативных значений [33, 34]. При этом не следует игнорировать обстоятельство, что практически во всех подобных исследованиях отсутствует генетическое подтверждение биологического отцовства, а, по имеющимся данным, от 0,8 до 30% рожденных детей не являются биологически родными своим официальным отцам [35].
Практически однозначно диагноз «мужское бесплодие» мы можем ставить лишь в нескольких ситуациях: при неоднократно подтвержденных «азооспермии» или «криптозооспермии», полной неподвижности сперматозоидов, особых формах тератозооспермии (глобозооспермия или синдром ацефальных сперматозоидов). В связи с этим в Международной статистической классификации болезней и проблем, связанных со здоровьем, 11-го пересмотра (МКБ-11), внедрение которой на территории РФ планируется провести в 2024 г., в определении диагноза мужского бесплодия, согласно результатам исследования эякулята, используется формулировка «отсутствие измеримого числа сперматозоидов».
Еще одна проблема при интерпретации результатов исследования спермы заключается в том, что многопараметрическая оценка представляется более важной, чем интерпретация отдельных параметров. Таким образом, комбинированная оценка продукции спермы (количественная [выход спермы]; качественная [подвижность, жизнеспособность, морфология]) может дать прогностическую информацию, связанную с успехом фертильности [36].
Поэтому перспективным подходом для определения вероятности зачатия естественным путем можно считать применение некоего интегрального показателя, характеризующего общее количества «хороших» сперматозоидов во всем эякуляте. Таким показателем можно считать число прогрессивно подвижных сперматозоидов в эякуляте (ЧППСЭ). Это может иметь место при относительно невысокой подвижности, но достаточно большой концентрации или объеме, и наоборот. По нашим данным (см. таблицу), нижний 5%-ный процентиль составляет 21 млн. О значимом снижении вероятности естественного зачатия в течение 5 лет при ЧППСЭ меньше 20 млн пишут S. Keihani и соавт. [29]; это так же сопровождается ростом числа случаев выраженной (>30%) фрагментации ДНК (ОШ=3,72) [37]. Минимальное значение ЧППСЭ в нашей выборке фертильных мужчин – 5 млн (см. рис. 1Д). Похожие результаты были получены J. A. Hamilton и соавт. [33]: при проведении проспективного исследования 1177 супружеских пар оказалось, что вероятность наступления беременности естественным путем от мужчин, в эякуляте которых число подвижных сперматозоидов превышало 5 млн, была достоверно выше по сравнению с теми, у кого этот показатель был менее 1 млн или варьировался в границах от 1 до 5 млн. Следовательно, с высокой вероятностью можно предположить, что у партнерш мужчин, в эякуляте которых содержится более 5 млн подвижных сперматозоидов, можно ожидать наступление беременности естественным путем.
В-третьих, интерпретируя данные, не следует забывать, что к снижению фертильности приводят не только описанные характеристики: уменьшение объема эякулята, концентрации и подвижности сперматозоидов. Существуют т.н. функциональные нарушения сперматозоидов, которые могут иметь место даже при формальной «нормозооспермии» [10, 38]. К таким функциональным нарушениям относят нарушения индуцируемости акросомной реакции, конденсации хроматина (протаминации), фрагментацию ДНК сперматозоидов, влияние антиспермальных антител (АСАТ), различные дефекты протеомики и метаболомики и др.
Наконец, следует иметь в виду, что «фертильный мужчина», т.е. мужчина, от которого наступила беременность, не тождествен понятию «здоровый» в репродуктивном смысле мужчина, поскольку до 30–40% случаев замершая беременность вызвана низким качеством сперматозоидов [39, 40]. Причиной этого могут быть как врожденные генетические дефекты [41, 42], так и уже упомянутые приобретенные нарушения структуры хроматина, в частности фрагментация ДНК, которая может быть вызвана влиянием активных форм кислорода (оксидативный стресс), нарушением протаминации и другими пока плохо изученными факторами [39, 40, 43]. При этом, чем больше процент аномальных форм сперматозоидов, тем нарушения структуры хроматина сперматозоидов выражены больше (даже при нормальной концентрации и подвижности) [44]. В частности, при 96–99% патологических форм протаминация и фрагментация вне референтных диапазонов в 20 и 27% случаев соответственно, при 100% аномальных форм – в 52 и 55%. Но и у тех, у кого морфологически нормальных форм больше 4% (в данном исследовании 5–14%) протаминация и фрагментация были не в норме в 12 и 23% случаев соответственно [44].
Заключение. При формировании заключения по результатам спермограммы российской популяции мужчин, исходя из значений нижнего 5%-ного процентиля, следует использовать следующие термины:
- «олигоспермия» – при объеме эякулята меньше 1,7 мл;
- «олигозооспермия» – при концентрации сперматозоидов меньше 20 млн/мл;
- «астенозооспермия» – при менее 24% прогрессивно подвижных форм;
- «тератозооспермия» – только при 100% морфологически аномальных форм при специфической окраске по Папаниколау с использованием строгих Тигербергских критериев оценки [11].
Важным в прогнозе естественного зачатия считаем расчетный показатель ЧППСЭ. Поскольку у 95% фертильных мужчин ЧППСЭ превышало 21 млн, у 5% – находилось в диапазоне от 5 до 20 млн, значения ЧППСЭ <5 млн могут считаться одним из признаков существенного снижения мужской репродуктивной функции.
Значения показателей стандартной спермограммы за границей референтного диапазона (5%- или 95%-ные процентили) рекомендуем считать «субфертильностью» – состоянием, при котором вероятность спонтанного зачатия снижена. В этом случае для преодоления бесплодия целесообразно назначать то или иное лечение, направленное на увеличение объема, концентрации, доли прогрессивно подвижных сперматозоидов, и как следствие – ЧППСЭ с целевым показателем больше 20 млн. При этом следует учитывать, что у молодой и репродуктивно здоровой женщины и при мужской субфертильности зачатие в естественном цикле возможно при условии регулярной половой жизни без контрацепции в течение достаточно длительного периода времени (1–2 года).
Снижение плодовитости может наблюдаться и при нормальных показателях базового исследования эякулята («нормозооспермия») в случае функциональных нарушений сперматозоидов, которые выявляют при применении методов расширенного и углубленного исследования [3] – оценки фрагментации ДНК, протаминации, оксидативного стресса сперматозоидов, антиспермальных антител и др. Дальнейшие исследования в этом направлении, основанные на принципах доказательной медицины, позволят получить более полные представления об их диагностической и прогностической ценности, а также сформулировать клинические рекомендации по их применению.
Кроме того, среди специалистов по репродуктивной медицине обсуждается потребность в обозначении самостоятельным классификационным кодом состояния репродуктивной функции мужчины, которому не удалось совместно с супругой добиться зачатия в течение 12 мес., и для которого не в полной мере подходит определение «мужское бесплодие», предложенное в классификаторе заболеваний. В настоящее время многие врачи используют в таких случаях код МКБ-10 «Z31.6 Общее консультирование и советы по восстановлению детородной функции», дополняя его словами «бесплодие в браке (в паре)», что позволяет им при последующем составлении планов обследования и лечения руководствоваться действующими клиническими рекомендациями по мужскому бесплодию, одобренными научно-практическим советом Минздрава РФ. Очевидно, что в связи с предстоящим внедрением на территории РФ Международной статистической классификации болезней одиннадцатого пересмотра (МКБ-11), предусматривающей при описании категории «мужское бесплодие» отдельные коды для азооспермии (GB04.0), других уточненных (GB04.Y) и неуточненных (GB04.Z) форм бесплодия также потребуется формирование согласованной позиции профессионального сообщества по возможностям их применения в различных клинических ситуациях у мужчин, состоящих в бесплодных браках. При этом не вызывает сомнений то, что каждый такой мужчина, в том числе и с «нормозооспермией», должен быть консультирован врачом-урологом для проведения диагностики с целью выявления возможных причин, способствующих снижению репродуктивной функции и, при необходимости, проведения последующего лечения, направленного на повышение вероятности зачатия и рождения здорового ребенка.



