Актуальность. Инфекции мочевыводящих путей (ИМП) – часто встречаемая в амбулаторной практике патология.
В большинстве случаев инфекция имеет восходящий характер, первично поражая уретру, мочеточники, мочевой пузырь. В клинической практике обращаемость пациентов по поводу острого цистита превосходит таковую для случаев острого пиелонефрита. В среднем ИМП до 30 раз чаще встречаются у женщин по сравнению с мужчинами [1]. Для молодых сексуально активных женщин показатели заболеваемости ИМП варьируются от 0,5 до 0,7 на человека в год [2], в возрасте старше 65 лет распространенность ИМП составляет 20% [3], старше 85 лет – до 30%. По данным H. Ahmed et al. [4], осуществившим ретроспективный анализ медицинской документации 931 945 пациентов ≥65 лет, за период наблюдения с марта 2004 по апрель 2014 г. у 196 358 (21%) пациентов отмечен минимум 1 клинически диагностированный эпизод ИМП. Для пациентов мужского пола частота клинически диагностированных случаев ИМП на 100 человеко-лет в группе риска увеличивается с 2,81 до 3,05 в возрастной группе 65–74 лет, с 5,90 до 6,13 в группе 75–84 лет и с 8,08 до 10,54 в возрасте старше 85 лет. Для женщин показатели заболеваемости увеличились с 9,03 до 10,96 в группе 65–74 лет, с 11,35 до 14,34 в группе 75–84 лет и с 14,65 до 19,80 в возрасте старше 85 лет [4]. Инфекции мочевыводящих путей у беременных выявляют в 9,8% наблюдений (95% доверительный интервал [ДИ] – 7,6–12,5) [5]. По данным мета-анализа, проведенного N. Shaikh et al. [6], распространенность ИМП у детей составляет 7,8% (95% ДИ – 6,6–8,9).
Помимо высокой распространенности ИМП значимой проблемой cчитаются рекуррентные формы – рецидивы и реинфекция. Согласно [7], после первого эпизода ИМП у 27% женщин в течение следующих 6 мес. развивался подтвержденный, у 2,7% – второй рецидивы. Факторы риска рекуррентных инфекций затрагивают потенциально очень широкий контингент пациентов [8]. Существенную роль в появлении рецидивирующих форм инфекций играет выбранная стратегия фармакотерапии первичного эпизода инфекции нижних отделов мочевыводящих путей, прежде всего острого цистита, определяющая степень достигнутой санации. Устойчивость основных возбудителей ИМП ко многим антибактериальным препаратам широкого спектра действия, с одной стороны, и риск формирования в последующем резистентности при использовании антибиотиков запаса, таких как фторхинолоны, цефалоспорины III–IV поколений, с другой, делают поиск оптимальной антибиотикотерапии актуальной задачей для клинических фармакологов, урологов и терапевтов.
Этиология ИМП и параметры антибиотикорезистентности основных возбудителей
Лечение ИМП в большинстве случаев эмпирическое, соответственно, знания о структуре возбудителей служат фундаментом построения фармакотерапевтической стратегии. Согласно обобщенным данным российских многоцентровых эпидемиологических исследований, посвященных изучению этиологии неосложненных ИМП (острый или обострение хронического цистита), у женщин основным возбудителем стабильно оказалась E. coli с тенденцией к снижению ее доли с 90,6% в 2000–2001 гг. до 72,4% в 2008–2009-х [9]. Последние данные о распространенности и антибиотикорезистентности возбудителей ИМП в РФ можно получить с помощью AMRmap – онлайн-платформы, анализирующей данные об устойчивости микроорганизмов к антимикробным препаратам в России [10, 11]. Так, среди внебольничных возбудителей ИМП в настоящее время лидирует группа Enterobacterales (86,05%), второе место занимают Enterococcus spp. (5,36%), третье – Staphylococcus spp. (4,53%).
Результаты сравнения параметров устойчивости основных возбудителей ИМП в России в разные периоды указывают на негативные тенденции, касающиеся в первую очередь представителей группы пенициллинов, включая ингибиторзащищенные препараты. Актуальные данные AMRmap свидетельствуют о высокой резистентности E. coli к тикарциллину клавуланату (95% ДИ – 52,12–59,62%), ампициллину (95% ДИ – 47,56–52,57%), амоксициллину клавуланату (95% ДИ – 41,81–47,39%), пиперациллину (95% ДИ – 35,81–43,71%), ампициллину сульбактаму (95% ДИ – 33,32–41,12%). Резистентность к триметоприм-сульфаметоксазолу составляет (95% ДИ) 26,9–31,45%. Наиболее эффективные препараты в отношении E. coli, согласно AMRmap, – амикацин, колистин, нитрофурантоин, фосфомицин, эртапенем, цефтазидим-авибактам, дорипенем, имипенем и меропенем, резистентность к ним составляет (95% ДИ) 0,85–2,01%, 1,48–3,85%, 1,15–3%, 1,22–2,56%, 0,55–1,66%, 0,09–1,25%, 0,03–0,94%, 0,01–0,37%, 0–0,3% соответственно [10, 11]. Результаты второго этапа исследования ДАРМИС (2017–2018, 32 центра, 24 города в России, дети и взрослые с острыми и обострениями хронических внебольничными ИМП), продемонстрировали, что Е. coli у взрослых при неосложненных ИМП выявляется в 74,6% случаев. Динамика продукции β-лактамаз расширенного спектра (БЛРС) штаммами Е. coli при неосложненных ИМП (19,5 против 2,3% для 2010–2011 гг.) свидетельствует о драматическом росте резистентности основного возбудителя ИМП к β-лактамным антибиотикам, прежде всего аминопенициллинам, включая ингибиторозащищенные, а также цефалоспоринам [12]. В исследовании ДАРМИС-2 максимальная чувствительность E. coli отмечена для имипенема и меропенема (по 99,4% соответственно), эртапенема (98,9%), амикацина (97,9%) фосфомицина (97,7%), нитрофурантоина (98,1%) и пиперациллина/тазобактама (87,6%). Максимальная резистентность была характерной для ампициллина (57,7%), амоксициллина/клавуланата (43,0%) и триметоприма-сульфаметоксазола (36,9%). Чувствительность E. coli к цефалоспоринам была следующей: цефепим – 76,5%, цефиксим – 74,6%, цефотаксим – 75,0%, цефтазидим – 76,1%, цефтибутен – 79,5% [13].
 Кишечная палочка как основной возбудитель ИМП имеет ряд особенностей. Было обнаружено, что персистирующие инфекции и рецидивы ИМП связаны с наличием у E. coli генов факторов вирулентности KpsM II K2 и agn43a, способностью формировать внутриклеточные бактериальные сообщества и резервуары хронической инфекции [14, 15]. Результаты оценки устойчивости E. coli к антибактериальным препаратам (АБП), полученные в различных странах, в целом свидетельствуют о высоких уровнях резистентности к аминопенициллинам, прежде всего к ампициллину и таким синтетическим АБП, как триметоприм-сульфаметоксазол. Значительное повышение продукции E. coli БЛРС, характерное, в частности, для России, оказывает значительное влияние на формирование эмпирических подходов к назначению АБП в терапии пациентов с ИМП: имеющиеся данные не позволяют рекомендовать ряд β-лактамных антибиотиков в качестве препаратов выбора. Что касается параметров антибиотикорезистентности K. pneumoniae, необходимо отметить тенденцию к росту устойчивости к цефалоспоринам и фторхинолонам. Продемонстрированные параметры устойчивости E. сoli и K. pneumoniae как возбудителей ИМП отвечают глобальным тенденциям резистентности данных микроорганизмов, о чем свидетельствуют данные ежегодного отчета Европейской сети по наблюдению за антимикробной резистентностью (EARS Net, 2018; табл. 1) [16].
Кишечная палочка как основной возбудитель ИМП имеет ряд особенностей. Было обнаружено, что персистирующие инфекции и рецидивы ИМП связаны с наличием у E. coli генов факторов вирулентности KpsM II K2 и agn43a, способностью формировать внутриклеточные бактериальные сообщества и резервуары хронической инфекции [14, 15]. Результаты оценки устойчивости E. coli к антибактериальным препаратам (АБП), полученные в различных странах, в целом свидетельствуют о высоких уровнях резистентности к аминопенициллинам, прежде всего к ампициллину и таким синтетическим АБП, как триметоприм-сульфаметоксазол. Значительное повышение продукции E. coli БЛРС, характерное, в частности, для России, оказывает значительное влияние на формирование эмпирических подходов к назначению АБП в терапии пациентов с ИМП: имеющиеся данные не позволяют рекомендовать ряд β-лактамных антибиотиков в качестве препаратов выбора. Что касается параметров антибиотикорезистентности K. pneumoniae, необходимо отметить тенденцию к росту устойчивости к цефалоспоринам и фторхинолонам. Продемонстрированные параметры устойчивости E. сoli и K. pneumoniae как возбудителей ИМП отвечают глобальным тенденциям резистентности данных микроорганизмов, о чем свидетельствуют данные ежегодного отчета Европейской сети по наблюдению за антимикробной резистентностью (EARS Net, 2018; табл. 1) [16].
Обзор современных рекомендаций по ведению пациентов с неосложненным острым циститом
Согласно современным рекомендациям (табл. 2) [17–26], основная стратегия антибиотикотерапии острого цистита направлена на снижение риска возникновения резистентных штаммов и колонизации организма пациента полирезистентной микрофлорой (Clostridium difficile, метициллинрезистентным S. aureus – MRSA), что в работах ряда авторов определяется как побочный «экологический», или «коллатеральный», эффект АБП. Использование цефалоспоринов может быть ассоциировано с последующим инфицированием ванкомицинрезистентными энтерококками, штаммами K. рneumoniae, продуцирующими БЛРС, штаммами Acinetobacter и Clostridium difficile, устойчивыми к β-лактамным антибиотикам. Фторхинолоны могут быть причиной формирования резистентности у грамотрицательной микрофлоры, прежде всего Pseudomonas aeruginosa, а также повышения риска возникновения инфекций, вызванных MRSA [22]. В соответствии с заявленной стратегией большинство рекомендаций советует избегать назначения антибиотиков широкого спектра действия (амоксициллина клавуланата, фторхинолонов и цефалоспоринов), отдавая предпочтение АБП узкого спектра. Последние включают фосфомицин, триметоприм (триметоприм-сульфаметоксазол), нитрофурантоин и пивмециллинам, что отражает тенденцию противодействия резистентным урологическим инфекциям.
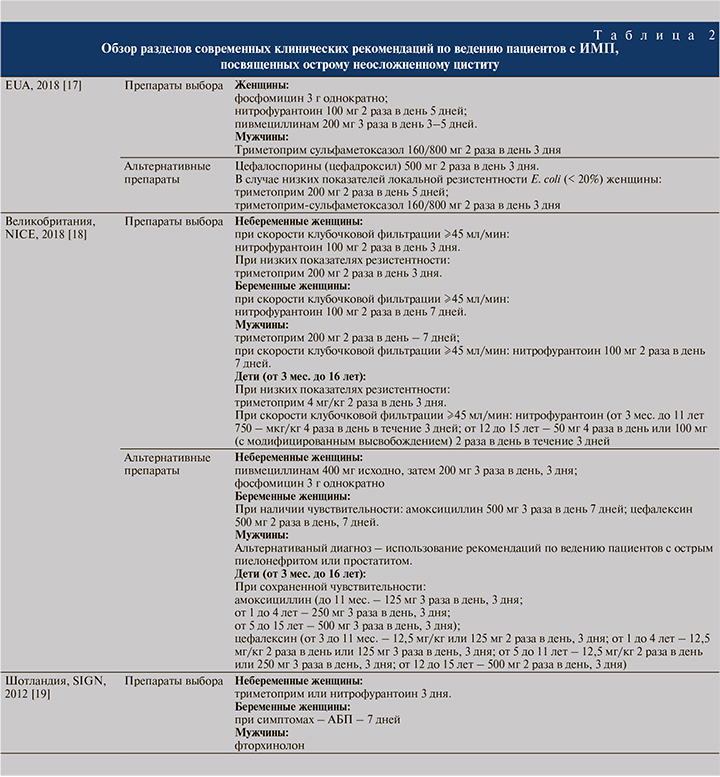
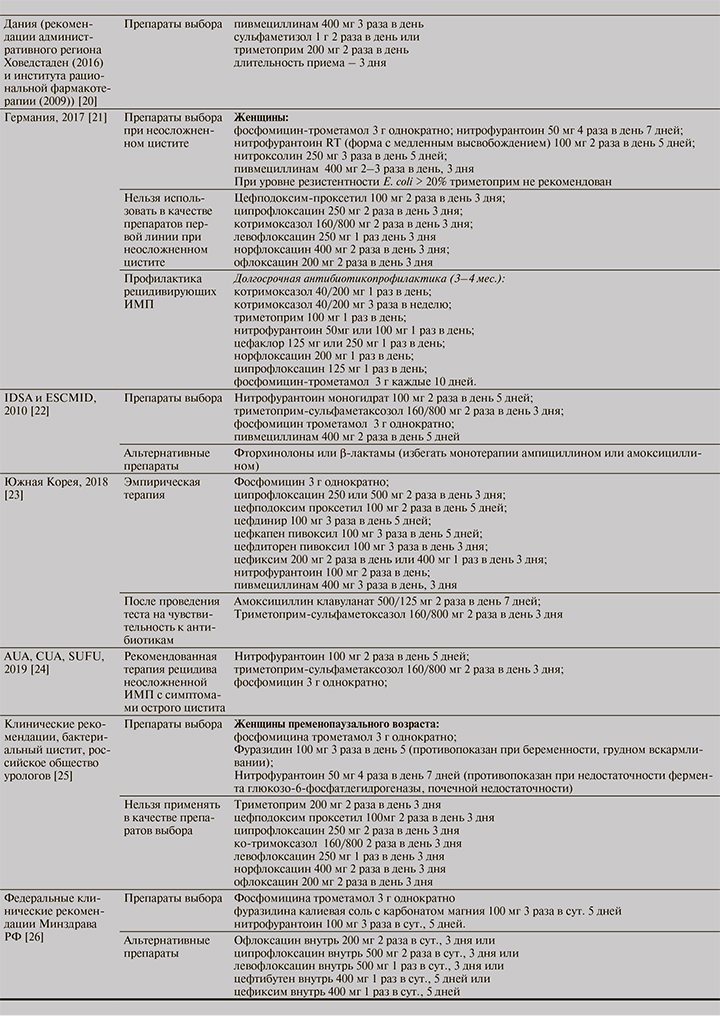
Согласно абсолютному большинству клинических рекомендаций последних лет, фосфомицин является одним из основных препаратов выбора: он приведен в рекомендациях EUA (2018), обновленной версии немецких клинических рекомендаций (2017), рекомендациях AUA, CUA и SUFU (2019), южно-корейских клинических рекомендациях (2018), российских рекомендациях (2019, 2016). По данным оценки антибиотикорезистентности основных возбудителей в различных странах, фосфомицин характеризуется высокой чувствительностью основных возбудителей, включая E. coli, при этом он не оказывает значимого подавляющего воздействия на нормальную микрофлору, что препятствует селекции резистентных микроорганизмов. Фосфомицин проявляет активность широкого спектра в отношении продуцентов БЛРС, AmpC, штаммов E. coli, резистентных к карбапенемам, и штаммов, обладающих множественной лекарственной устойчивостью [27].
Позиции использования триметоприма/триметоприма-сульфаметоксазола в качестве препарата выбора ослабляются современными данными, свидетельствующими о его выраженном влиянии на микробиом человека и значительном возрастании резистентности основных возбудителей.
В исследовании [28] продемонстрирована ассоциация между приемом триметоприма-сульфаметоксазола и повышенным риском острого поражения почек и гиперкалиемии у пациентов старше 65 лет. Пивмециллинам (представитель амидопенициллинов) обладает высокой эффективностью в отношении продуцентов БЛРС. Пивмециллинам является препаратом выбора в терапии ИМП согласно ряду современных клинических рекомендаций (Германия, 2017; Дания, 2016; IDSA и ESCMID, 2010; Южная Корея, 2018; EAU, 2018). Большинство руководств оставляет в качестве препарата выбора нитрофурантоин. Уровень чувствительности возбудителей к нитрофурантоину относительно высок, но при назначении данного препарата следует учитывать параметры рН мочи пациента, так как необходимая минимальная подавляющая концентрация (МПК) нитрофурантоина в отношении E. coli резко возрастает при сдвиге рН в щелочную сторону: от 2,5 мг/л при рН 5,5 до 50 мг/л при рН 8,0. Аналогичная ситуация наблюдается и в отношении P. mirabilis: при рН 5,5 МПК составляет 15 мг/л, при рН 8,0 – уже 100 мг/л [27–30]. В Российских рекомендациях одним из препаратов выбора является фуразидин, производное нитрофуранов, обладающий активностью в отношении ряда стрептококков, стафилококков и грамотрицательной микрофлоры, представленной E. coli, Salmonella spp., Shigella spp., Klebsiella spp.
Оптимальное сочетание фармакодинамических и фармакокинетических характеристик отмечается у таких препаратов, как фосфомицин и пивмециллинам, рациональность использования которых в терапии ИМП подтверждается абсолютным большинством существующих клинических рекомендаций. Фосфомицин выводится из организма в неизменном виде с мочой путем клубочковой фильтрации, пиковая концентрация в моче составляет 4000 мкг/мл, уровень >100 мкг/мл сохраняется в течение 48 ч после однократного приема 3 г per os; коррекции режима не требуется ни пожилым пациентам, ни беременным, ни при почечной или печеночной недостаточности [27]. Пивмециллинам имеет высокую биодоступность при приеме per os, исходное вещество не активно; активный метаболит, мециллинам, образуется в процессе гидролиза под действием эстераз. Применение данного АБП практически не подавляет кишечную и вагинальную микрофлору, что минимизирует риск селекции резистентной микрофлоры, риск возникновения вагинального кандидоза и инфекций, вызываемых Clostridium difficile [31].
Определяющим фактором успешной фармакотерапии служит комплаенс. Следование пациента предписанному режиму приема лекарственных средств максимально в случае назначения наиболее простых и краткосрочных схем, что указывает на дополнительное преимущество применения такого препарата, как фосфомицин, требующего однократного приема.
Помимо АБП – основы этиотропной терапии любых ИМП — в ряде клинических рекомендаций освещается возможность применения препаратов и продуктов растительного происхождения с целью дополнительной профилактики рецидивов ИМП, наряду с использованием лизатов E. coli (ОМ-89), пробиотиков (Lactobacillus spp.) и D-маннозы [17]. В рекомендациях EUA (2018) указано, что ни для продуктов на основе клюквы, на для прочих указанных выше вариантов нет достоверных данных об эффективности, в связи с чем в настоящее время они не рекомендованы пациентам. Аналогичное заключение в отношении этих растительных препаратов звучит в рекомендациях NICE (2018) [18]. Шотландские клинические рекомендации (2012) [19] рассматривают использование препаратов, содержащих экстракт клюквы (таблетки и капсулы, содержащие 200 мг экстракта клюквы, эквивалент 5000 мг свежей клюквы) как возможный дополнительный вариант терапии, предназначенный для профилактики рецидивов ИМП. При этом отмечается, что отсутствуют достоверные свидетельства эффективности клюквы в терапии ИМП с выраженной симптоматикой (острый цистит). Нежелательным явлением, связанным с приемом продуктов на основе клюквы, является повышение МНО и протромбинового времени на фоне приема варфарина. Дополнительный прием эстрогенов женщинами постменопаузального возраста не способствовал значимому снижению риска рецидивов ИМП, равно как и прием анальгетиков не был рекомендован как способ улучшения течения неосложненных симптоматических ИМП (острого цистита) [19]. В обновленной версии немецких национальных рекомендаций [21] дополнительные препараты (лизат E. coli (ОМ-89); парентерально вводимые инактивированные энтеробактерии, манноза (фитотерапия), рассматриваются как средства возможной профилактики рецидивов ИМП у женщин, при их неэффективности необходимо применение долгосрочной антибиотикопрофилактики (3–6 мес.). Согласно Российским клиническим рекомендациям, препараты растительного происхождения (канефрон Н, в состав которого входит трава золототысячника, корень любистока и листья розмарина, а также продукты клюквы [сок, таблетированный экстракт ягод клюквы с витамином С]) могут применяться исключительно для профилактики рецидивирующих форм ИМП [25, 26].
Оценка клинической эффективности АБП в терапии острого цистита
В работе A. Babiker et al. [32] приведены результаты ретроспективного когортного исследования (2011–2018), оценивавшего эффективность монотерапии фосфомицином пациентов с ИМП, вызванными микроорганизмами с множественной лекарственной устойчивостью, включая Enterobacteriaceae, устойчивые к карбапенемам, Enterobacteriaceae – продуценты БЛРС и ванкомицинрезистентные энтерококки. В целом назначение фосфомицина приводило к клиническому излечению в 87 и 94% случаев через 48 ч и 14 дней соответственно [32]. Показатели клинической эффективности пивмециллинама в терапии пациентов с ИМП, вызванных в том числе штаммами E. coli, продуцирующими БЛРС, составили 76% в случае 5-дневного и 73% в случае 3-дневного курсов приема препарата [33]. Согласно результатам мета-анализа [34] 27 контролируемых исследований (4807 пациентов), выполненных за 1946–2014 гг., показатель клинического излечения при использовании нитрофурантоина в терапии неосложненных ИМП варьируется от 79 до 92% для курса длительностью 5–7 дней. Для 3-дневного курса этот показатель составил лишь 61–70%.
В сетевом мета-анализе [35] прием триметоприма в течение 7 дней характеризовался средним уровнем излечения 85,9%, однократный прием 200 мг – 61,1%. Согласно данным S. Sadler et al. (2017) [35], показатель излечения в случае однократного приема 3 г фосфомицина в среднем составил 84,2%, нитрофурантоина 50 мг 4 раза в день в течение 7 дней – 79,9%, нитрофурантоина 100 мг 2 раза в день в течение 7 дней – 85,0%, нитрофурантоина 100 мг 2 раза в день в течение 3 дней – 62,4%, пивмециллинама 200 мг 3 раза в день в течение 7 дней – 75,0%, пивмециллинама 400 мг 2 раза в день в течение 3 дней – 69,8%, пивмециллинама 200 мг 2 раза в день в течение 7 дней – 76,2%.
В целом эффективность стратегии применения антибиотикотерапии в лечении пациентов с неосложненными ИМП подтверждается результатами оценки исходов. M. Pujades-Rodriguez et al. [36] проанализировали когорту пациентов с ИМП (n=300354) за 2011–2015 гг. Немедленное начало антибиотикотерапии имело место у 85,7% пациентов, при этом повторное назначение АБП потребовалось лишь в 4,1% наблюдений. Доля взрослых с рецидивирующими ИМП колебалась от 1% у мужчин 18–64 лет до 2,6% у женщин 65 лет и старше. Анализ эффективности АБП в снижении риска рецидива ИМП, проведенный H. Ahmed et al. [37], выявил снижение риска рецидивов ИМП на 24% в случае долгосрочного приема антибиотиков (три исследования, n=482; объединенное отношение рисков – 0,76; 95% ДИ – 0,61–0,95), данная практика не выявила статистически значимого увеличения риска неблагоприятных явлений в исследуемом когорте пациентов.
Неосложненные ИМП, прежде всего у женщин, являются одними из наиболее распространенных в амбулаторной практике заболеваний, требующих назначения антибиотиков. Принцип необходимости антибиотикотерапии для данного контингента пациентов отражен в существующих клинических рекомендациях стран Европы, Азии и Америки, подтверждающих отсутствие доказательной базы для использования в качестве монотерапии иных подходов, в частности применения растительных препаратов и нестероидных противовоспалительных средств. Современные подходы к выбору АБП подразумевают ограничение формирования резистентности микроорганизмов, в том числе за счет использования препаратов, минимально влияющих на нормальную микрофлору человека. Данным требованиям отвечает применение антибактериальных препаратов узкого спектра действия, способных создавать стабильно высокие концентрации в моче и стенках мочевыводящих путей и имеющих минимальные системные эффекты. Препараты выбора, согласно большинству рекомендаций, включают нитрофурантоин, фосфомицин, триметоприм-сульфаметоксазол и пивмецилинам, незарегистрированный в России антибиотик. Необходимыми условиями выбора АБП помимо высокой активности в отношении основных возбудителей ИМП являются минимальная токсичность, в частности отсутствие повреждающего действия на почки; минимальный потенциал для лекарственного взаимодействия (например, отсутствие клинически значимого связывания с белками плазмы крови, метаболизма в печени под действием изоферментов CYP450); возможность применения пациентами с патологией почек и печени. С точки зрения повышения комплаенса терапии оптимальны пероральные формы АБП с минимальными кратностью приема и длительностью курса.
Анализ фармакологических параметров основных препаратов выбора для терапии острого неосложненного цистита позволяет выделить наиболее значимые факторы, влияющие на эффективность терапии. Нитрофурантоин имеет несколько больший потенциал для межлекарственных взаимодействий, что связано с довольно высоким уровнем связывания с белками плазмы крови (90%). Эффективность данного препарата зависит от рН мочи при сдвиге рН в щелочную сторону МПК в отношении как E. coli, так и P. mirabilis резко возрастает. При почечной недостаточности противопоказан при клиренсе креатинина <30 мл/мин. Фосфомицин не связывается с белками плазмы крови, сохраняется в высокой концентрации в моче на протяжении длительного времени, что позволяет использовать однократный прием вместо нескольких дней терапии. Кроме того, препарат можно назначать без коррекции дозы при печеночной недостаточности и его прием противопоказан лишь при тяжелой почечной недостаточности (клиренс креатинина <10 мл/мин). Триметоприм-сульфаметоксазол, обладая относительно выгодными фармакокинетическими характеристиками, значительно проигрывает вышеуказанным двум препаратам в отношении параметров устойчивости основных возбудителей ИМП: в случае E. coli, согласно последним данным в РФ, резистентность составляет (95% ДИ) 26,9–31,45%; для нитрофурантоина и фосфомицина этот показатель равен (95% ДИ) 1,15–3% и 1,22–2,56% соответственно [10, 11]. С учетом данных клинических рекомендаций, как российских, так и международных, а также ассортимента зарегистрированных в РФ АБП к оптимальным препаратам выбора для терапии неосложненных ИМП относятся фосфомицин и нитрофурантоин, в случае последнего необходимо учитывать возможное изменение рН мочи, которое может стать следствием потенциально возможных в случае данного препарата лекарственных взаимодействий, а также результатом жизнедеятельности определенных возбудителей ИМП. Назначение препаратов растительного происхождения в лечении неосложненных ИМП российскими и международными клиническими рекомендациями регламентируется однозначно: фитопрепараты могут быть использованы исключительно в качестве альтернативных средств для профилактики рецидивов цистита.



