Введение. Уретропластика является основным подходом к лечению протяженных стриктур спонгиозной уретры [1–3]. Современные варианты одно- и многоэтапных реконструкций позволяют добиваться восстановления анатомического просвета уретры в 60–90% случаев [4–10]. А что из хирургических процедур предлагается больному на будущее в остальных 10–40% при неудачной уретропластике? Предполагается какой-либо способ постоянной деривации мочи. Однако какой из тех, что существует? Так или иначе, эта проблема почти не обсуждается в литературе.
Другой не менее важной стороной многоэтапных уретропластик является длительность лечения, ведь порой приходится производить более двух операций, принимая во внимание и коррекцию осложнений первых этапов [2, 7, 9, 11]. В связи с этим всякий раз возникает вопрос о необходимости объяснения больному многоэтапности оперативного лечения, рисков осложнений и в целом – растянутости оперативного лечения на 1,5–2,0 года. Имеют значение и осложняющие факторы стриктурной болезни уретры, и сопутствующие заболевания, влияющие на заживление ран, а также риски развития рецидивов стриктур уретры (СУ). Естественно, в таких случаях складывается ситуация, диктующая целесообразность предложения больному изначального выполнения постоянной промежностной или пенильной уретростомии как разумной альтернативы сложной многоэтапной реконструктивно-пластической хирургии.
Цель исследования – определить клинические различия пациентов, подлежащих многоэтапной уретропластике и постоянной уретростомии.
Материалы и методы. С 2010 по 2019 г. в университетской клинике РостГМУ прооперированы 754 больных со стриктурами уретры. Критерием включения пациентов в исследование стало наличие стриктур спонгиозной уретры, подвергнутых либо многоэтапной уретропластике, либо постоянной уретростомии. Критериями невключения считали возраст моложе 18 лет, стриктуры проксимальной уретры (мембранозные, простатические), стенозы уретровезикального анастомоза и шейки мочевого пузыря, ранее нелеченные врожденные аномалии (гипоспадия и эписпадия) и любые другие операции на уретре, не соответствующие критерию включения, а также многоэтапные уретропластики при условии их незавершенности.
Таким образом, для анализа сформировано две группы пациентов: I группа –73 больных, которым были выполнены многоэтапные уретропластики (≥2 этапов), завершившиеся полным анатомическим восстановлением просвета уретры; II группа – 48 больных, которым в качестве основного метода лечения выбрана постоянная уретростомия.
Предоперационная оценка. В группах подробно изучены жалобы и анамнестические данные, включая сведения о причинах формирования стриктур уретры, длительности заболевания и предшествовавшем лечении. Оценены наличие и характер осложнений стриктурной болезни уретры, хронических сопутствующих заболеваний, результаты физикального обследования, лабораторных тестов крови и мочи, данных ультразвукового исследования мочевой системы, уретроцистографии и уретроцистоскопии. У пациентов с сохраненным мочеиспусканием были исследованы скорость мочеиспускания (максимальная [Qmax] и средняя [Qave] скорость потока мочи) и количество остаточной мочи (post-void residual volume – PVR), а также тяжесть симптомов нижних мочевыводящих путей с помощью опросника IPSS, включая индекс качества жизни, связанный с нарушением мочеиспускания (QoL).
Хирургические техники многоэтапных уретропластик. В исследовании применены техники кожных (36,49%) и буккальных (63,51%) уретропластик. При хирургии с использованием кожных лоскутов на первом этапе выполняли марсупиализацию уретры, на втором – применяли либо продольный островковый вентральный лоскут на питающей dartos fascia (Orandi), либо технику Johanson. В некоторых случаях при бульбозных или бульбознопенильных стриктурах уретры на втором этапе использовали кожу мошонки по модифицированным методикам Orandi–Коган, Duplay или Denis Browne. При хирургии с использованием трансплантата слизистой ротовой полости производили заместительную или аугментационную inlay-пластику через вентральный сагиттальный уретротомический доступ. Варианты этапности и их сочетания (1 – марсупиализация уретры или иссечение измененной уретры, 2 – фиксация трансплантата, 3 – тубуляризация уретры) зависели от выраженности воспалительных изменений в уретре, состояния парауретральных тканей, наличия или отсутствия уретральной площадки, а также степени сужения и протяженности стриктуры. В случаях многофокусных поражений мочеиспускательного канала многоэтапная хирургия могла сочетать кожные и буккальные техники, а также дополнялась использованием влагалищной оболочки яичка или применением резекционных техник. Интервалы времени между первым и последующими этапами составляли 2–38 мес. В целом хирургическое лечение пациентов занимало от 2 до 57, в среднем – 10,97±8,59 мес.
Хирургические техники уретростомий. При выполнении уретростомии использовали непересекающие техники Johanson или Blandy. При ограниченной эластичности кожи промежности или стриктурах с вовлечением проксимальной части бульбозного отдела уретры применяли технику Z-пластики в нижней части разреза промежности для создания уретростомы без натяжения. В 58,3% случаев уретростома сформирована на промежности, в 41,7% – в пеноскротальном углу или на стволе полового члена.
Послеоперационное мониторирование. Наблюдение включило мониторирование симптомов по шкале IPSS, лабораторные тесты крови и мочи, физикальное исследование, урофлоуметрию и при обструктивном мочеиспускании – ретроградную уретрографию и уретроскопию для оценки причин обструктивного мочеиспускания. Обследование проводили через 3, 6 и 12 мес. в течение первого года мониторирования, далее – ежегодно. В случаях ухудшения мочеиспускания пациенты обращались вне плановых сроков мониторирования.
Методы статистического анализа. Статистический анализ проведен в пакете прикладных программ SPSS-26. Были рассчитаны описательные статистики, для тестирования различий между группами использованы t-критерий и критерий Манна–Уитни. Различия групп считали достоверными при уровне значимости 5 и 1%.
Результаты. Базовые характеристики пациентов представлены в табл. 1.
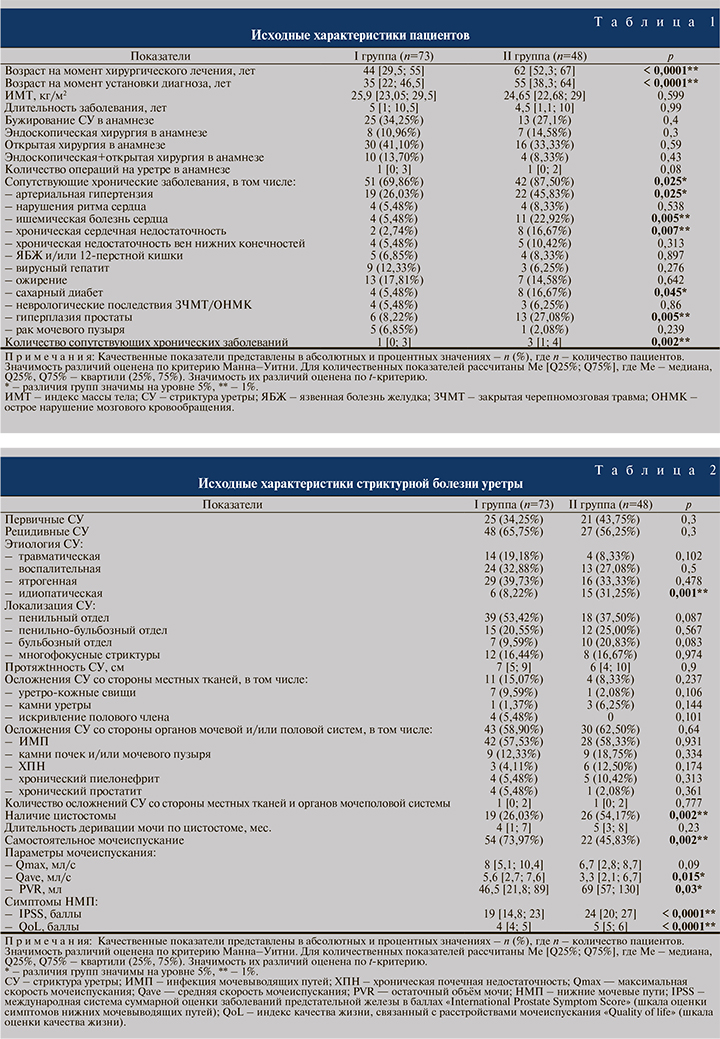
Пациенты II группы по сравнению с таковыми I группы на момент операции были существенно старше (p<0,0001), а также старше на момент установления диагноза (p<0,0001). При этом длительность их заболевания до поступления в клинику была практически идентичной. Аналогично не было найдено различий в анамнезе по операциям на уретре и бужированию стриктур. В то же время количество сопутствующих заболеваний (p<0,002) и частота их встречаемости (p<0,025), среди которых преобладали сердечно-сосудистые, оказались значительно выше во II группе.
Характеристика стриктурной болезни уретры на момент операции приведена в табл. 2.
Существенные отличия группы II от группы I – это более высокая частота идиопатических стриктур, наличия цистостомы и, естественно, меньшая частота сохраненного мочеиспускания с более выраженными отклонениями его показателей от нормы.
Ранние хирургические осложнения в I группе были выявлены у 21 (28,8%) пациента, во II – у 1 (2,1%) (p<0,0001). В 77,3% (17/22) наблюдений осложнения относились к I–II классам Clavien-Dindo (инфекционно-воспалительные изменения послеоперационной раны, уретро-кожные свищи) и были купированы консервативно путем усиления антибактериальной терапии, гигиены раны и уретры растворами антисептиков, пролонгацией сроков дренирования мочевого пузыря, а в 22,7% (5/22) наблюдений потребовалось ушивание уретро-кожных свищей. При этом все ранние осложнения многоэтапной уретропластики развились после завершавшегося этапа лечения – тубуляризации уретры 17/21 (81,0%) или тубуляризации с одновременной фиксацией трансплантата 4/21 (19,0%).
Рецидив стриктур при среднем сроке наблюдения 64,97±30,85 (13–130) мес. диагностирован у 19 (26,0%) пациентов I группы, стеноз уретростом – у 7 (14,6%) II при сроке наблюдения 57,15±31,80 (9 – 129) мес. (p=0,135). В случаях рецидива стриктур произведены повторные кожные и буккальные уретропластики (8), резекция уретры с концевым анастомозом (1), внутренняя оптическая уретротомия (1), промежностная уретростомия (3) или цистостомия (2). Кроме того, 11 (15,1%) пациентам потребовались дополнительные хирургические вмешательства по устранению прогрессирования стриктурной болезни и связанных с ней осложнений на промежуточных этапах уретропластики. Во II группе хирургическая коррекция уретростом выполнена 6 (12,5%) пациентам, 1 (2,1%) больному рекомендовано проведение системного бужирования.
Обсуждение. Постоянная уретростомия является относительно редким методом лечения, используемым в нашей клинике: 6,4% случаев из общего числа пациентов, оперированных за 10 лет. Традиционно считается, что данный вид хирургии может быть приемлемым только для людей пожилого возраста и пациентов с сопутствующими заболеваниями, исключающими длительную анестезию [12, 13]. Однако в литературе последнего десятилетия уретростомия вск чаще обсуждается в контексте рационального выбора лечения мужчин с протяженными (пануретральными), рецидивными стриктурами переднего отдела уретры, а также пациентов с распространенным склероатрофическим лихеном и стриктур, сформировавшихся вследствие неудачных исходов хирургического вмешательства при гипоспадии [14–16]. J. S. Fuchs et al. [17], изучив тенденцию использования различных хирургических техник при сложных стриктурах переднего отдела уретры в специализированном центре штата Юта (США), показали, что доля уретростомий с 2008 по 2017 г. неуклонно росла, увеличившись почти десятикратно – с 4,3 до 38,7% случаев. Авторы объясняют это еще и тем, что показатели успеха лечения выше среди пациентов с уретростомами (94,8%) по сравнению с буккальной и кожной уретропластиками (78,5 и 78,2% соответственно), даже несмотря на то что пациенты, подвергнутые уретростомии, были старше и имели более протяженные стриктуры.
В нашем исследовании первичный успех лечения среди пациентов с постоянными уретростомами был также выше, нежели при многоэтапных уретропластиках (85,4 против 65,8%). Кроме того, во II группе отмечено большее количество наблюдений благоприятного течения послеоперационного периода (97,9 против 71,2%). При этом предоперационная оценка больных показала, что пациенты, подлежавшие постоянной уретростомии, значимо старше и характеризуются более тяжелым коморбидным фоном по сравнению с пациентами, которым выполняют многоэтапную уретропластику. Они значительно чаще подвергаются цистостомии, а пациенты с сохраненным мочеиспусканием имеют более выраженные симптомы нарушенного мочеиспускания, достоверно бо́льший остаточный объем мочи и более низкие скоростные показатели мочеиспускания. В этиологической структуре заболевания данной группы отмечается большее количество пациентов с идиопатическими стриктурами и меньшее – со стриктурами, образовавшимися после оперативной коррекции гипоспадии, а стриктуры, связанные с тупой травмой промежности, мошонки и/или полового члена, вовсе отсутствуют.
Схожее по дизайну исследование недавно опубликовано бельгийскими учеными [18], в котором также лучший хирургический результат получен среди пациентов, подвергнутых конечной промежностной уретростомии (92 против 83%), а сравнительная клиническая характеристика показала, что пациенты данной группы были достоверно старше (p<0,001), значительно чаще страдали от сопутствовавшей сердечно-сосудистых заболеваний (p=0,01), имели более протяженные стриктуры уретры в целом (p=0,02) и большее количество пануретральных стриктур (p=0,02), чем пациенты группы многоэтапной уретропластики. Вместе с тем в это исследование в отличие от нашего вошли пациенты, завершившие лечение на первом этапе реконструкции мочеиспускательного канала, отказавшись от второго в пользу сохранения постоянной уретростомы почти в половине случаев планируемой многоэтапной хирургии. Таким образом, характер оперативного лечения протяженных спонгиозных стриктур уретры был связан как с особенностями поражения уретры, так и с общими соматическими и психологическими факторами здоровья пациента, а также с опытом хирурга в данной области реконструктивно-пластической хирургии.
Заключение. Многоэтапную хирургию протяженных спонгиозных стриктур уретры целесообразно проводить мужчинам молодого и среднего возраста без тяжелых коморбидных заболеваний в случаях осознанности выбора и высокой информированности пациентов, несмотря на риски осложнений и рецидива болезни. Пенильную или промежностную уретростомию изначально следует обсуждать с больным как операцию выбора, принимая во внимание возраст, сердечно-сосудистую коморбидность, сахарный диабет и гиперплазию предстательной железы.



