Введение. Симптомы нижних мочевыводящих путей (СНМП), вызванные доброкачественной гиперплазией предстательной железы (ДГПЖ), распространены среди мужчин среднего и пожилого возраста. Согласно данным эпидемиологических исследований, распространенность СНМП/ДГПЖ линейно увеличивается с возрастом, при этом составляет 14,8%; 20,0; 29,1; 36,8 и 38,4% для возрастных групп 40–49, 50–59, 60–69, 70–79, 80 лет и старше соответственно [1, 2].
В качестве лечения широкое распространение получили методы консервативной фармакотерапии ДГПЖ с использованием α1-адреноблокаторов как «золотого» стандарта. Согласно рекомендациям Европейской ассоциации урологов, при лечении СНМП при ДГПЖ α1-адреноблокаторы являются препаратом первой линии при СНМП у пациентов [3], а тамсулозин – одним из наиболее назначаемых препаратов данной группы.
Тамсулозин является представителем группы селективных α1-адреноблокаторов. Имеет высокий профиль эффективности и безопасности, однако у части пациентов могут развиваться нежелательные побочные реакции, наиболее грозные из которых со стороны сердечно-сосудистой си-стемы [4]. С другой стороны, эффективность консервативной терапии тамсулозином у разных пациентов с СНМП при ДГПЖ вариабельна, а по данным одного из исследований, до 1/3 пациентов могут заявлять о его неэффективности [5]. Очевидно, что проблема повышения эффективности и безопасности проводимой терапии СНМП при ДГПЖ тамсулозином все еще актуальна.
В метаболизме тамсулозина участвуют ферменты CYP2D6, CYP3A4 и CYP3A5. CYP2D6 обладает высокой вариабельностью активности в популяции. В настоящее время активно изучается влияние некоторых аллельных вариантов генов метаболизаторов тамсулозина на фармакокинетический профиль препарата [6–8]. Активность CYP2D6 обусловлена генетическими полиморфизмами и варьируется в зависимости от носительства тех или иных аллельных вариантов гена CYP2D6, вызывая либо отсутствие (нефункциональные аллельные варианты CYP2D6 *3–*6), либо снижение (например, CYP2D6*9, *10, *17, *29 и *41), либо повышение ферментативной активности (например, СYP2D6*1/*1xN, *1/*2xN, *2/*2xN) по отношению к аллелю дикого типа. Известно более 130 аллельных вариантов гена CYP2D6. Практическое значение этого явления заключается прежде всего в том, что при определении у пациента функционально дефектных аллельных вариантов гена CYP2D6 терапию необходимо проводить начиная с минимальных доз препаратов [9].
CYP3A как и многие другие изоферменты суперсемейства цитохромов P-450 является высокополиморфным. Фермент CYP3A участвует в биотрансформации широкого спектра лекарственных препаратов (ЛП) [10]. Для CYP3A5 может наблюдаться изменение ферментативной активности белка, например, при наличии варианта *3 (c.6986A>G, rs776746). Клинически подтверждено влияние полиморфного варианта CYP3A5*3 на активность всего подсемейства [11].
Развитие технологий генетического тестирования и снижение их стоимости позволяют рассматривать фармакогенетику как еще один реальный инструмент оптимизации фармакотерапии. Особые успехи в рамках фармакогенетических исследований были достигнуты в кардиологической практике, для которой справедливо выделить пары ген-препарат: CYP2C9, VKORC1 и CYP4F2 [12] – варфарин (и другие антагонисты витамина К); CYP2C19 и ABCB1– клопидогрел [13]; SLCO1B1 – статины [14]. Помимо клопидогрела полиморфизмы гена ABCB1 детерминируют изменение фармакокинетики антикоагулянтов прямого действия, таких как дабигатран, ривороксабан, апиксабан [15]. Справедливо отметить, что фармакогенетические разработки коснулись препаратов, используемых не только в кардиологической, но и в онкологической, психиатрической практике и с противовирусной целью [16–18].
В настоящее время не существует стандартного метода лечения ДГПЖ, подходящего для любого больного. В зависимости от ряда признаков применяются динамическое наблюдение, медикаментозное лечение в режиме моно- и комбинированной терапии, хирургическое лечение, включая различные малоинвазивные методики.
Монотерапия тамсулозином является наиболее распространенным вариантом стартовой терапии СНМП при ДГПЖ и может применяться у пациентов с любой степенью выраженностью СНМП.
У пациентов с умеренной степенью выраженности СНМП ввиду отсутствия показаний или наличия противопоказаний к оперативному лечению терапия тамсулозином может успешно применяться на протяжении длительного времени, а зачастую и всей жизни. Стоит отметить, что именно эта группа пациентов наиболее многочисленна – примерно 60–70% пациентов с ДГПЖ [19], и применение фармакогенетического тестирования для повышения эффективности и безопасности проводимой терапии у них видится наиболее целесообразным.
С учетом вышесказанного носительство различных аллельных вариантов CYP2D6, CYP3A4 и CYP3A5, участвующих в метаболизме тамсулозина, потенциально может оказывать влияние на вариабельность эффективности и безопасности терапии препаратом. В связи с этим целью настоящего исследования было оценить взаимосвязь между носительством аллельных вариантов генов CYP2D6, CYP3A4, CYP3A5 с изменением параметров эффективности и безопасности тамсулозина у пациентов с СНМП при ДГПЖ.
Материалы и методы. Исследование выполнено на базе кафедры эндоскопической урологии и отдела предиктивных и прогностических биомаркеров НИИ молекулярной и персонализированной медицины ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России (ФГБОУ ДПО РМАНПО Минздрава России).
Исследование одобрено Комитетом по этике научных исследований ФГБОУ ДПО РМАНПО Минздрава России и проводилось в соответствии с Хельсинкской декларацией. Всем пациентам были разъяснены цели и задачи исследования, от всех были получены подписанные информированные согласия на участие в исследовании.
Изучаемая группа. В исследование был включен 131 пациент с СНМП и установленным диагнозом ДГПЖ (N40 по МКБ. 10), из них все этапы закончили 106 пациентов. Терапия на протяжении всего периода наблюдения проводилась тамсулозином в дозировке 0,4 мг/сут. (Омник®, Нидерланды).
Критерии включения: мужчины старше 40 лет; наличие диагноза «доброкачественная гиперплазия предстательной железы (N40)»; жалобы на выраженные симптомы нижних мочевыводящих путей по шкале IPSS (International Prostate Symptom Score) более 8 баллов; объемом остаточной мочи (ООМ) менее 100 мл по данным УЗИ; объемом предстательной железы от 35 до 100 см3 при трансректальном ультразвуковом исследовании (ТРУЗИ ПЖ); уровень простатического специфического антигена в плазме крови (ПСА) < 4 нг/мл.
Критерии невключения: осложненное течение ДГПЖ; любые другие причины, кроме ДГПЖ, которые могут, по мнению исследователя, приводить к дизурии или изменению скорости потока мочи (например, нейрогенные расстройства мочеиспускания, стриктура шейки мочевого пузыря, стриктура уретры, острый или хронический простатит, острые или хронические инфекции мочевыводящих путей), сопутствующие онкологические заболевания; сопутствующие тяжелые сердечно-сосудистые (например, нестабильная стенокардия, недавний инфаркт миокарда или плохо контролируемая артериальная гипертензия) и цереброваскулярные заболевания (недавний инсульт или травмы спинного мозга); почечная и печеночная недостаточность.
Критерии исключения: выявление лекарственной непереносимости; отказ пациента от приема назначаемой терапии; отказ пациента от участия в исследовании.
У всех пациентов после включения в исследование производился забор крови для генетического исследования. Других лекарственных препаратов для терапии ДГПЖ пациенты в течение терапии тамсулозином не получали.
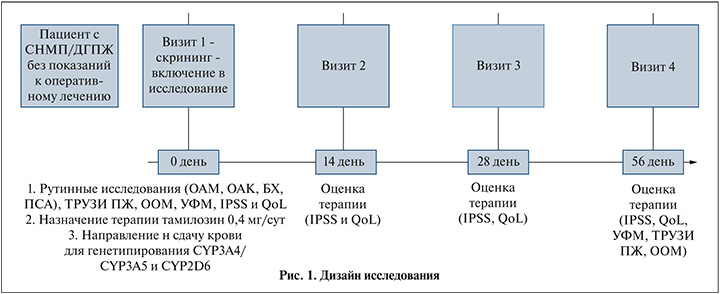
Основная часть исследования включила 8-недельное лечение и наблюдение, включившее визит 1 (скрининг и включение) и три последующих визита через 2, 4 и 8 нед. На визите 1 (1-е сутки) – в момент включения пациента в исследование при первичном обращении собирался анамнез заболевания, проводилось обследование с помощью комплекса клинических (оценка проявления СНМП по международной системе IPSS [с учетом разделения симптомов на субшкалы: обструктивные и ирритативные] и QoL) и инструментальных (урофлоуметрия [УФМ] [с определением максимальной скорости потока мочи [Qmax], ультразвуковое исследование мочевого пузыря и простаты [с определением объема остаточной мочи и простаты]) методов. Пациентам были проведены рутинные лабораторные исследования: общий анализ крови (ОАК), биохимический анализ крови (БХ) (креатинин, мочевина), определение простатспецифического антигена (ПСА) и общий анализ мочи (ОАМ). Больным назначена терапия тамсулозином в дозе 0,4 мг/сут., сдача анализа крови для генотипирования. На визите 2 (14-е сутки) и 3 (28-е сутки) оценивалась динамика назначенной терапии с помощью валидного опросника IPSS и QoL. На заключительном визите 4 (56-е сутки) оценивалась динамика проводимой терапии по данным опросника IPSS и QoL и инструментальных методов (повторная оценка Qmax при урофлоуметрии, определение объема остаточной мочи и объема простаты по данным УЗИ). В анализ результатов были включены данные только тех пациентов, которые прошли все 4 визита (рис. 1).
Генотипирование. Материалом для генотипирования служили 4 мл крови из вен локтевого сгиба, собранные с помощью вакуумной системы для взятия венозной крови VACUETTE (Greiner Bio-One, Австрия) в пробирки с ЭДТА. Выделение ДНК осуществляли с помощью набора реагентов «ДНК-Экстран-1» для выделения геномной ДНК из цельной крови (ООО «Синтол», Москва, Россия).
Носительство полиморфных маркеров генов CYP3A4*3 (c.-392G>A, rs2740574), CYP3A5*3 (c.6986A>G, rs776746), CYP2D6*3 (c.775del, rs35742686), CYP2D6*4 (c.506-1G>A, rs3892097), CYP2D6*10 (c.100C>T, rs1065852) выявлялось методом полимеразной цепной реакции (ПЦР) в режиме реального времени с помощью набора реагентов «SNP-Скрин» (ООО «Синтол», Москва, Россия). Носительство полиморфных маркеров CYP3A4*22 (c.522-191C>T, rs35599367), CYP2D6*9 (c.841_843del, rs5030656) и CYP2D6*41 (c.985+39G>A, rs28371725) выявлялось с помощью наборов реагентов «TaqMan® SNP Genotyping Assays» и TaqMan Universal Master Mix II, без UNG (Applied Biosystems, Foster City, США) в соответствии с инструкцией производителя. ПЦР-анализ проводился на амплификаторе Real-Time CFX96 Touch (Bio-Rad Laboratories, Inc., США).
Статистический анализ. Оценивалось соответствие распределения аллельных вариантов генов закону независимого распределения по Харди–Вайнбергу с использованием критерия Хи-квадрат Пирсона. При сравнении количественных и качественных признаков проводилась оценка нормальности распределения с помощью теста Колмогорова–Смирнова и Шапиро–Уилка. Для проверки различий между двумя выборками парных или независимых измерений использовали непараметрический статистический критерий Вилкоксона. Данные, соответствовавшие нормальному распределению, сравнивались с использованием t-критериев Стьюдента для связанных или несвязанных групп. При нормальном распределении показателя результаты представлялись в виде средних значений (M) и среднеквадратического отклонения (σ). Данные, не соответствовавшие нормальному распределению, сравнивались с использованием U-теста Манна–Уитни для связанных или несвязанных групп. При ненормальном распределении показателя результаты представлялись в виде медианы (Me) и 25% и 75% квартилей. Для оценки различий частоты развития нежелательных побочных реакций (НПР) между группами использовали точный тест Фишера (2х2). Для всех показателей статистически значимым считали значение p<0,05. Полученные данные обрабатывали, используя программы Microsoft Excel. 2010 и STATISTICA v10.0 (StatSoft Inc., США) для Windows. 10.
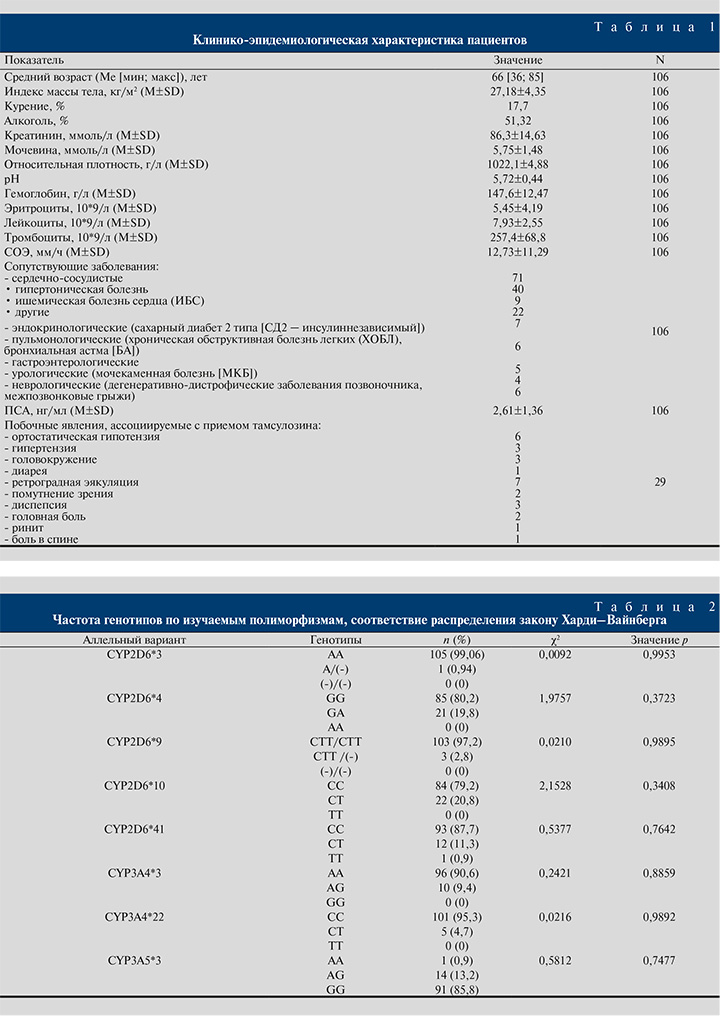
Результаты и обсуждение. Клинико-эпидемиологическая характеристика включенных пациентов, прошедших все этапы исследования, представлена в табл. 1.
Оценка эффективности
У 106 пациентов, завершивших все этапы исследования, было определено носительство полиморфных маркеров: CYP2D6*3, CYP2D6*4, CYP2D6*9, CYP2D6*10, CYP2D6*41, CYP3A4*3, CYP3A4*22 и CYP3A5*3. Распределение генотипов по всем исследуемым аллельным вариантам генов соответствовало закону Харди–Вайнберга (табл. 2).
При сравнении результатов лечения у пациентов в общей выборке (n=106) между группами носителей изучаемых полиморфизмов и неносителями по CYP2D6 и CYP3A статистически значимых различий по всем изученным параметрам (общий балл IPSS, субшкала обструктивных симптомов (ОС) IPSS (вопросы № 2, 4, 7), субшкала ирритативных симптомов (ИС) IPSS (вопросы № 1, 3, 5, 6), QoL, ООМ, УФМ) на протяжении периода наблюдения выявлено не было.
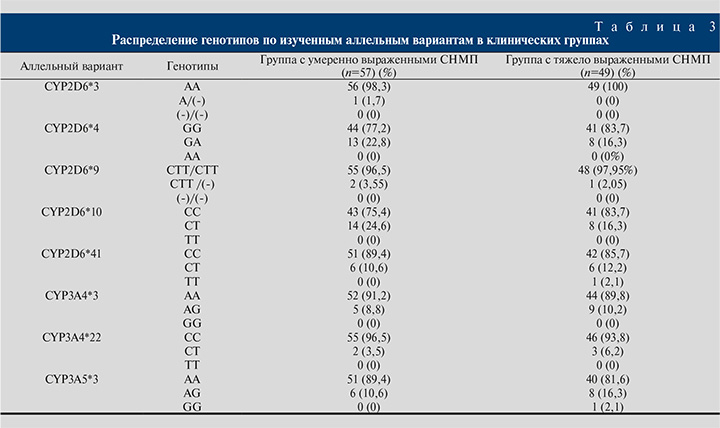
Согласно международной шкале простатических симптомов IPSS, степень выраженности СНМП при ДГПЖ градируется как отсутствие (0 баллов), легкая степень (1–7 баллов), умеренная степень (8–19 баллов) и тяжелая степень (20–35 баллов) [20]. С учетом данной классификации для дальнейшего анализа все пациенты были разделены на две группы. В первую группу вошли 57 пациентов с умеренной выраженностью СНМП, во вторую группу вошли 49 пациентов с тяжело выраженными СНМП. Распределение генопитов по изученным аллельным вариантам в клинических группах представлено в табл. 3.
У пациентов из группы с умеренной выраженностью симптомов носительство полиморфизма CYP2D6*10 ассоциировалось с более значимым снижением общего балла IPSS у пациентов начиная с 4-й недели (p<0,05). Также CYP2D6*10 сказывался на значимом снижении обструктивной симптоматики и ООМ к 8-й неделе по сравнению с базовым значением (p<0.05). Аналогичная динамика снижения обструктивной симптоматики к 8-й неделе наблюдалась у пациентов с полиморфизмов CYP2D6*41 (p<0,05) (рис. 2).
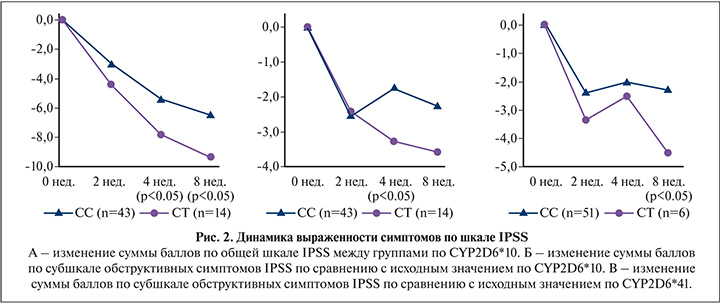
Результаты анализа показывают, что носительство полиморфизмов CYP2D6*10 и *41 у пациентов с умеренно выраженной симптоматикой (8–19 баллов по IPSS) наблюдался более выраженный положительный эффект на терапию тамсулозином, что выражалось снижением общей суммы баллов по IPSS и особенно касалось обструктивных симптомов по субшкале IPSS и ООМ.
В группе с тяжело выраженными СНМП вклад полиморфизмов был менее значимым. У пациентов – носителей CYP2D6*10 выявлялось достоверно большее снижение ООМ на 8-й неделе фармакотерапии (p<0,05) (табл. 4).

По результатам проведенного исследования влияния полиморфизмов CYP3A4 и CYP3A5 на эффективность терапии тамсулозином в группах выявлено не было. Однако пациенты – носители аллеля CYP3A5*3 в группе с тяжело выраженным симптомами начиная со 2-й недели отмечали статистически значимое повышение качества жизни проводимой терапии по сравнению с неносителями (p<0,05) (табл. 4).
Оценка безопасности
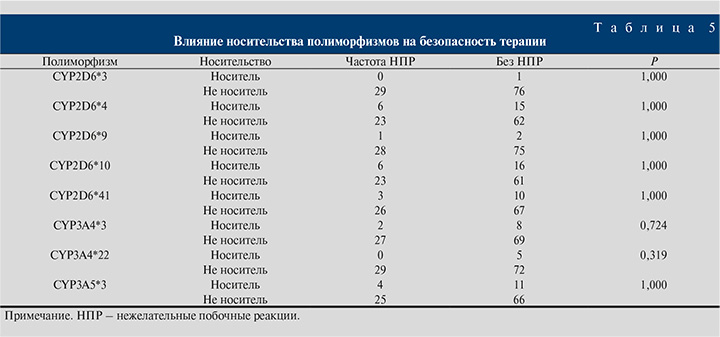
Виды НПР у пациентов, завершивших исследование, представлены в табл. 1, а частота их распределения в зависимости от носительства аллельных вариантов генов CYP2D6, CYP3A4 и CYP3A5 – в табл. 5. При анализе влияния вклада отдельных полиморфизмов CYP2D6, CYP3A4 и CYP3A5 на безопасность тамсулозина при лечении СНМП при ДГПЖ статистически значимых данных выявлено не было (табл. 5). Вопрос требует более подробного изучения с увеличением объема выборки.
Обсуждение. Индивидуальные различия в эффективности и безопасности лекарственных препаратов (ЛП) между пациентами являются существенной проблемой современной фармакотерапии. Фармакологический ответ организма на прием того или иного ЛП определяется множеством факторов: возраст, пол, вес, сопутствующие заболевания, образ жизни, культура, раса/этническая группа, курение, диета пациента, свойства препарата, оптимальная доза и межлекарственные взаимодействия [21]. В то же время до 50% вариабельности фармакологического ответа могут определяться генетической изменчивостью организма. Полиморфные по своей природе гены определяют существование межиндивидуальных различий фармакокинетических или фармакодинамических параметров того или иного ЛП. Выбор ЛП, подбор их доз с учетом молекулярно-генетических особенностей пациента составляют предмет изучения фармакогенетики, являющейся одной из основ персонализированной медицины [22, 23]. Целью же персонализированного подхода является найти препарат в дозе, эффективной и безопасной для лечения заболевания у данного пациента [24].
Приблизительно до 25% лекарств, применяемых в клинической практике, метаболизируются в той или иной степени под действием CYP2D6 [25]. В свою очередь для гена CYP2D6 известно более 130 аллельных вариантов, по некоторым из которых разработаны клинические руководства по персонализации терапии с помощью атомоксетина, ондансентрона, тамоксифена и других ЛП [26]. Возвращаясь к тамсулозину, прием препарата у носителей полиморфизмов, влияющих на скорость метаболизма, может приводить к изменению концентрации препарата в плазме крови, что сказывается на эффективности и безопасности проводимой терапии СНМП при ДГПЖ. Несмотря на то что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) задокументировало предупреждение, что у «медленных» метаболизаторов по CYP2D6 лечение тамсулозином эквивалентно терапии с совместным приемом пароксетина – ингибитора CYP2D6, врачи должны быть осведомлены о рисках проводимой терапии тамсулозином.
Ранее уже сообщалось о влиянии полиморфизмов CYP2D6 на плазменный уровень тамсулозина и изменение его фармакокинетических параметров. В исследовании К. А. Kim и соавт. (2018) у носителей CYP2D6*10/*10 (n=4) или *5/*10 (n=2) значения суммарной концентрации лекарственного препарата в плазме крови в промежутке времени наблюдения AUC (area under the curve, AUC) тамсулозина были выше на 66 и 103% по сравнению с группами пациентов, являющихся носителями полиморфизмов, не приводящих к изменению скорости метаболизма [6].
В другом исследовании, C. I. Choi и соавт. (2012), у носителей генотипа CYP2D6 *10/*10 значения Cmax и AUC были выше на 40 и 64% соответственно по сравнению с носителями генотипа CYP2D6*1/*1 [7]. Однако опубликованные результаты исследований ограниченны, так как исследовалось влияние носительства полиморфизмов на фармакокинетические параметры тамсулозина у здоровых добровольцев. При этом AUC тамсулозина была на 40% выше у добровольцев в возрасте 55–75 лет по сравнению с участниками в возрасте 20–32 лет [27]. Поэтому фармакогенетическое влияние CYP2D6 на тамсулозин может быть более серьезным в старших возрастных группах.
Наше исследование проведено в реальных условиях амбулаторного приема, и впервые сделана попытка оценить влияние носительства полиморфизмов генов – метаболизаторов тамсулозина на эффективность и безопасность проводимой терапии. Результаты работы демонстрируют, что генотип CYP2D6 оказывает клинически значимое влияние на терапию тамсулозином СНМП при ДГПЖ: у пациентов с умеренной симптоматикой, носителей полиморфизмов CYP2D6*10 и CYP2D6*41, наблюдается более выраженный эффект препарата.С учетом того факта, что терапевтическая эффективность тамсулозина более тесно связана уровнем плазменной концентрации, чем с пиковой концентрацией в плазме или системной концентрацией препарата [28], полученные нами наблюдения могут объясняться тем, что снижение метаболической активности CYP2D6 повышает плазменные уровни концентрации препарата в крови и тем самым повышает длительность его воздействия на организм пациента, что клинически проявляется повышением эффективности терапии СНМП. Данные результаты частично соотносятся с ранее полученными выводами К. А. Kim и соавт. [6], C. I. Choi и соавт. [7]. Эти предположения будут проверены в заложенной фармакокинетической части исследования, и результаты будут опубликованы позже. Вместе с тем следует оговориться, что интерпретация результатов по отдельным полиморфным точкам CYP2D6 и CYP3A видится сложной. Оценка должна быть комплексной, учитывающей совместный вклад спектра значимых вариаций этих генов.
Мы также оценили влияние полиморфизма CYP3A4 и CYP3A5 на эффективность и безопасность терапии тамсулозином у пациентов с СНМП при ДГПЖ. Существенного вклада носительства аллельных вариантов CYP3A в оцениваемые клинические показатели выявлено не было. Ранее сообщалось, что при совместном приеме тамсулозина и кетоконазола, мощного ингибитора CYP3A Cmax и AUC тамсулозина повышались в 2,2 и 2,8 раза соответственно [29]. Сообщалось, что полиморфизм CYP3A5*3 может приводить к альтернативному сплайсингу и усечению белка, в результате чего образуется нефункциональный белок CYP3A5 [11]. Также известно, что скорость метаболизма CYP3A5 составляет около 62% от скорости метаболизма CYP3A [30]. Если предположить, что генотипы CYP2D6 играют существенную роль, эффект генотипа CYP3A5 может маскироваться активностью CYP2D6. Возможный вклад CYP3A в вариабельность клинических показателей лечения тамсулозином будет изучен на следующем этапе продолжающегося исследования путем оценки уровня метаболизма эндогенных веществ (кортизол) [31] и экспрессии микро-РНК, коррелирующей с активностью CYP3A. Такой же анализ по оценке фенотипической активности заложен и для CYP2D6.
Считается, что тамсулозин ассоциируется с более низкой частотой нежелательных побочных явлений, чем ранее разработанные блокаторы α1-адренорецепторов, включая альфузозин, доксазозин и теразозин, поскольку тамсулозин более селективен к подтипу α1А-адренорецепторов [32]. Однако при терапии тамсулозином у пациентов могут развиваться следующие НПР: головная боль (14,3%), головокружение (11,9%), насморк (11,2%), ретроградная эякуляция (10,8%), слабость (6%), частота которых также имеет дозозависимый эффект [33]. На данном этапе результаты нашего исследования не подтверждают вклад носительства аллельных вариантов генов CYP2D6 и CYP3A на изменение параметров безопасности тамсулозина у пациентов с СНМП при ДГПЖ.
Однако исследование продолжается и вклад CYP2D6 и CYP3A в клиническую вариабельность эффективности и безопасности лечения тамсулозином СНМП/ДПГЖ будет изучен на следующем этапе путем оценки уровня эндогенным метаболитов (кортизол и пинолин) и экспрессии микро-РНК, о чем будет доложено позже.
Заключение. Полученные результаты по расчету прогностической значимости отдельных полиморфных маркеров указывали на вклад вариантов CYP2D6*10 и CYP2D6*41: у пациентов-носителей терапия тамсулозином СНМП при ДГПЖ эффективнее. На показатели безопасности проводимой терапии изученные полиморфные варианты влияния не оказывали. Было выявлено, что носительство CYP3A5*3 ассоциировалось с увеличением субъективной оценки качества жизни пациента, но окончательные выводы делать рано. Вопрос вклада генетических факторов на эффективность и безопасность лечения СНМП при ДГПЖ требует дальнейшего изучения с увеличением объема выборки и анализируемых параметров.



