Введение. Проблема нарушений уродинамики занимает одно из центральных мест в урологии. Это
обусловлено большой распространенностью и многообразием причин, вызывающих эвакуаторную несостоятельность мочевыводящих путей, а также наличием прямо пропорциональной зависимости между степенью нарушений уродинамики, активностью пиелонефрита и сроками возникновения функциональной недостаточности почек [1]. В последние годы появилась масса работ, в которых указывается на увеличение числа женщин с расстройствами акта мочеиспускания в отсутствие патологических изменений в анализах мочи. Эта особенность для многих исследователей послужила поводом считать причиной возникновения дизурии нейроэндокринные нарушения в организме женщин, расстройства кровообращения в органах малого таза и различные изменения психики больных. Другие авторы рассматривали дизурию как проявление воспалительного процесса в мочевом
пузыре и уретре. Третьи объясняли возникновение дизурии функциональными нарушениями нижних
мочевыводящих путей [2]. В патогенезе пиелонефрита кроме нарушений гемодинамики важная роль принадлежит нарушениям уродинамики [3–7]. По данным отечественных исследователей, до 59% женщин, страдающих хроническим неспецифическим воспалением нижних мочевыводящих путей, имеют признаки инфравезикальной обструкции (ИВО), в большинстве наблюдений зона обструкции локализуется в шейке мочевого пузыря и проксимальной уретре [8, 9]. Пиелонефрит является одним из наиболее распространенных заболеваний почек и мочевыводящих путей, при котором воспалительный процесс развивается не только как первичное, но и как вторичное заболевание. В связи с этим большинство урологов считают, что в возникновении пиелонефрита кроме наличия инфекции немаловажную роль играют уро- и гемодинамические нарушения в почке. Уродинамика нижних мочевыводящих путей зависит от состояния стенки мочевого пузыря (детрузора), проксимального
отдела мочеиспускательного канала (предстательная и перепончатая части у мужчин, 2/3 проксимальной части у женщин) и сфинктера мочеиспускательного канала. Их деятельность определяется особенностями гладкой мускулатуры, ее вегетативной иннервацией и механизмами нервно-мышечной передачи [10]. Пузырно-мочеточниковый рефлюкс возникает при сочетании дисфункции мочевого пузыря и его воспаления. В норме пузырно-мочеточниковый сегмент (ПМС) способен противостоять внутрипузырному давлению жидкости до 60–80 см водн. ст. [11]. Турбулентный поток мочи при нарушении ее пассажа на уровне дистального отдела уретры создает условия для ретроградного заброса микроорганизмов из дистального отдела уретры в мочевой пузырь, что приводит к частым рецидивам хронического воспалительного процесса в нем.
Лечение дисфункций мочевого пузыря продолжает оставаться сложной и во многом еще нерешенной
задачей. Болезнь затрагивает сложнейшие механизмы взаимоотношений детрузорно-сфинктерных систем, нарушает все три функции пузыря – накопление, удержание и эвакуацию мочи. До недавнего времени даже не ставилась задача разработки патогенетически обоснованной схемы лечения дисфункций мочевого пузыря у пациенток с хроническим рецидивирующим циститом и необструктивным пиелонефритом.
Целью исследования явилось изучение функционального состояния нижних мочевыводящих путей
у пациенток с хроническим рецидивирующим циститом и необструктивным пиелонефритом для определения тактики их комплексной патогенетической терапии.
Материалы и методы. В урологической клинике Первого МГМУ им. И. М. Сеченова проведена оценка показателей функционального состояния нижних мочевыводящих путей 116 пациенток с хроническим циститом (средний возраст – 44,56±16,51 года, средняя длительность заболевания от начала первого
эпизода острого цистита – 4,3±1,4 года) и 51 пациентки с хроническим необструктивным пиелонефритом (средний возраст – 37,1±16,28 года) [12]. Было выполнено комбинированное уродинамическое исследование всех этих пациенток с профилометрией уретры для исключения нарушений уродинамики нижних мочевыводящих путей, которое могло быть пусковым механизмом и основной причиной поддержания длительно существующего воспалительного процесса.
Результаты и обсуждение. У 53 (45,68%) пациенток с хроническим циститом (средний возраст –
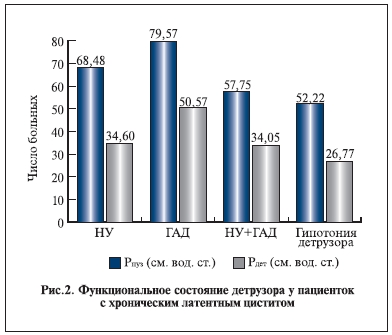
40,72±14,45 года) выявлена нестабильность уретры. Максимальное уретральное давление в этой группе больных – 82,46±29,26 см водн. ст. Колебания максимального уретрального давления составили 34,86±19,6 см водн. ст. Максимальная скорость мочеиспускания у них составила 16,93±6,79 мл/с, внутрипузырное давление при максимальной скорости потока мочи — 68,48±26,39 см водн. ст., детрузорное давление – 34,6±12,1 см водн. ст., вклад детрузорного давления – 55,5±18,6%.
У 10 (8,62%) пациенток с хроническим циститом (средний возраст – 45,55±13,45 года) выявлена гиперактивность детрузора. Колебания детрузорного давления составили 22,16±15,8 см водн. ст., максимальная скорость мочеиспускания – 19,9±10,09 мл/с, внутрипузырное давление при максимальной скорости потока мочи – 79,57±35,22 см водн. ст., детрузорное давление – 50,57±28,98 см водн. ст., вклад детрузорного давления – 62,6±18,1%.
У 26 (22,4%) пациенток с хроническим циститом (средний возраст – 65,16±10,49 года) диагностировано сочетание нестабильности уретры и гиперативности детрузора. Максимальное уретральное давление составило 75,5±21,44 см водн. ст., колебания уретрального давления – 37,45±17,44 см водн. ст. Максимальная скорость мочеиспускания у этих пациенток составила
19,9±10,09 мл/с, колебания детрузорного давления – 23,57±14,48 см водн. ст. Максимальный объем мочевого пузыря у пациенток с гиперактивностью детрузора и ургентными расстройствами составил 239,96± 120,72 мл, объем мочи, при котором возникал первый нестабильный подъем детрузорного давления, – 108,5±46,69 мл. Внутрипузырное давление при максимальной скорости потока мочи составило 57,75±15,6 см водн. ст., детрузорное давление – 34,05±10,67 см водн. ст., вклад детрузорного давления – 59,83±11,9%.
Снижение максимальной скорости потока мочи ниже 15 мл/с выявлено у 47 (40,5%) больных.
Сочетание сниженной максимальной скорости потока мочи с гиперактивностью детрузора зарегистрировано у 7 пациенток, с нестабильностью уретры – у 24, с нестабильностью уретры и гиперактивностью детрузора – у 9.
Гипотония детрузора выявлена у 35 (30,17%) больных. Внутрипузырное давление при максимальной
скорости потока мочи составило 52,22±16,61 см водн. ст., детрузорное давление – 26,77±8,4 см водн.
ст., вклад детрузорного давления – 53,55±17,82%. Снижение максимальной скорости потока мочи в
этой группе имело место у 8 пациенток. Гипотония детрузора 36 пациенток сочеталась с нестабильностью уретры. Максимальный объем мочевого пузыря у этих пациенток составил 425,0±125,14 мл, а у больных с сочетанием гипотонии детрузора и нестабильности уретры – 416,71±142,91 мл. Внутрипузырное давление при максимальной скорости потока мочи составило
53,38±20,15 см водн. ст., детрузорное давление – 32,58±8,85 см водн. ст., вклад детрузорного давления – 66,7±20,1%.
Максимальное уретральное давление у больных без императивных нарушений мочеиспускания составило 60,33±21,82 см водн. ст., максимальная скорость потока мочи — 20,72±7,46 мл/с. Повышенная чувствительность мочевого пузыря выявлена у 30 (31,57%) женщин без гиперактивности детрузора. Возраст этих больных составил 44,30±13,45 года.
Снижение сократительной способности детрузора зарегистрировано у 25 (21,55%) больных, снижение
максимальной скорости потока мочи в этой группе выявлено у 8 пациенток.
Признаки детрузорно-сфинктерной диссинергии отмечены у 29 (25%) больных. Остаточная моча в объеме более 50 мл обнаружена у 12 (12,63%) пациенток.
Максимальный объем мочевого пузыря пациенток с хроническим необструктивным пиелонефритом
составил 450,88±181,25 мл, максимальная скорость мочеиспускания – 19,53±9,44 мл/с. Внутрипузырное
давление при максимальной скорости потока мочи достигало 67,8±34,16, максимальное уретральное
давление – 83,05±29,9 см водн. ст. У 16 (31,37%) пациенток при цистографии был выявлен пузырно-
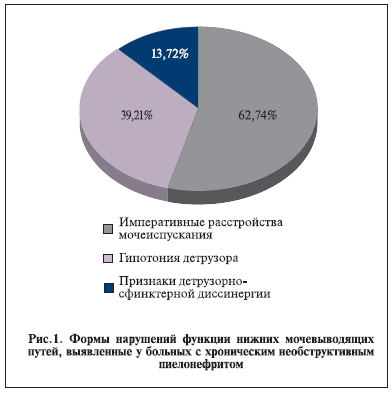
мочеточниковый рефлюкс. Среди этих пациенток у 9 зафиксирована нестабильность уретры, у 4 – выраженная гипотония детрузора, у 5 – гиперактивность детрузора. После обработки данных уродинамических исследований выделены 20 (39,21%) пациенток с выраженной гипотонией детрузора, 18 (35,29%) – с гиперактивностью детрузора, 26 (50,98%) – с нестабильностью уретры (рис. 1). При этом среди этих больных гиперактивность детрузора и нестабильность уретры сочетались у 12, нестабильность уретры и гипотония детрузора – у 6. Признаки детрузорносфинктерной диссинергии выявлены у 7 больных.
В группе пациенток с гиперактивным мочевым пузырем объем мочевого пузыря при первом нестабильном подъеме детрузорного давления составил 124,21±64,85, максимальный объем мочевого пузыря – 314,22±150,8 мл; колебания детрузорного давления – 30,61±24,8 см водн. ст., средняя скорость мочеиспускания достигала 18,49±9,6 мл/с.
В группе пациенток с нестабильностью уретры колебания максимального уретрального давления составили 38,19±26,40 см водн. ст., максимальная скорость мочеиспускания — 19,20±10,02 мл/с.
Объем мочевого пузыря пациенток с гипотонией детрузора составил 573,83±167,9 мл. У пациенток со
сниженной чувствительностью мочевого пузыря первый позыв на мочеиспускание зарегистрирован при
его наполнении до 334,44±67,28 мл. С учетом полученных данных можно говорить о следующем механизме развития инфекционно-воспалительных заболеваний мочевой системы. При развитии императивных расстройств мочеиспускания порция мочи из мочевого пузыря может поступать при подъеме детрузорного давления во время фазы наполнения мочевого пузыря в уретру. Далее отмечается ответный подъем уретрального давления с целью удержания мочи. При наличии колебаний уретрального давления происходит заброс мочи из уретры в мочевой пузырь, т. е. микробная флора дистального отдела уретры попадает в мочевой пузырь, а при наличии пузырно-мочеточникового рефлюкса – в верхние мочевые пути.
По данным литературы, наиболее часто обструкция на уровне ПМС обусловлена так называемым динамическим фактором, т. е. высоким внутрипузырным давлением. Внутрипузырное давление, превышающее 40 см водн. ст., нарушает нормальный отток из верхних мочевыводящих путей. Гидронефроз развивается, когда это высокое давление сохраняется в мочевом пузыре в течение длительного промежутка времени, что наблюдается в мочевом пузыре со сниженными эластичностью и способностью к растяжению (резервуар высокого давления) либо при гиперактивности детрузора с высокими значениями детрузорного давления. По мнению J. Wyndaele [13], максимальное детрузорное давление (70 см водн. ст. и выше) достоверно вызывает нарушение функции верхних мочевыводящих путей. R. Gerridzen и соавт. [14] при обследовании больных с детрузорной арефлексией выявили,
что изменения со стороны верхних мочевыводящих путей имели место при средних значениях детрузорного давления 58 см водн. ст., тогда как нарушения функции почек пациентов со средним детрузорным давлением 24 см водн. ст. отсутствовали.
Согласно результатам проведенной нами работы, у пациенток с нестабильностью уретры и гиперактивностью детрузора внутрипузырное давление при максимальной скорости потока мочи было выше 50 см водн. ст. (рис. 2).
У всех пациенток, у которых при цистографии был выявлен пузырно-мочеточниковый рефлюкс, зарегистрирована дисфункция нижних мочевыводящих путей: у 56,25% – нестабильность уретры, у 25% – выраженная гипотония детрузора, у 31,25% – гиперактивность детрузора.
Таким образом, хронический необструктивный пиелонефрит у обследованных больных имел место и мог быть следствием нарушения функции нижних мочевыводящих путей по типу императивных расстройств мочеиспускания, обусловленных гиперактивностью детрузора и/или нестабильностью уретры (32 [62,74%] пациентки), по типу выраженной гипотонии детрузора (20 [39,21%]), вследствие детрузорно-сфинктерной диссинергии (7 [13,72%] пациенток).
Одним из объяснений более частого инфицирования мочевого пузыря и развития цистита у женщин
может являться особенность мочеиспускания – вращательная гидродинамика мочи в момент опорожнения мочевого пузыря, что может сопровождаться заносом в пузырь инфекции из задней части мочеиспускательного канала (уретровезикальный рефлюкс) [15–17]. Полученные результаты исходного комплексного уродинамического исследования подтвердили суждения Г. З. Хайрлиева [2], а также О. Б. Лорана и соавт. [15] о патогенезе хронического цистита у женщин. Первоначальными могут являться функциональные нарушения нижних мочевыводящих путей, которые приводят к расстройству кровообращения в стенке мочевого пузыря с его ишемией и гипоксией. Замыкается порочный круг. Таковой представляется патогенетическая связь между иннервационными нарушениями нижних мочевыводящих путей и возникновением хронического цистита у женщин.
Воспаление в стенке мочевого пузыря на фоне дисфункции нижних мочевыводящих путей в свою очередь может поддерживать нарушение нормальной работы мочевого пузыря и/или уретры. Таким образом, патогенетическое лечение хронического цистита должно быт направлено на разрыв “замкнутого круга” дисфункция–воспаление.
На основании полученных результатов исследования можно утверждать, что хронический воспалительный процесс в мочевом пузыре и почках женщин может являться не причиной, а следствием функциональных нарушений нижних мочевыводящих путей, связанных с расстройством нервной регуляции этих органов. Подобное утверждение основано на классической концепции нейрофизиологии о существовании постоянного контроля со стороны вегетативной нервной системы за деятельностью мочевого пузыря и уретры. То же можно объяснить и присутствием, а также распределением адрено- и холинорецепторов в функционально активных зонах нижних мочевыводящих путей. Основным способом лечения урологических нарушений у больных дисфункциями нижних мочевыводящих путей является фармакотерапия. Выбор того или иного лекарственного препарата зависит от вида дисфункции мочевого пузыря и/или уретры. Фармакотерапия является одним из самых распространенных методов лечения гиперактивного мочевого пузыря и функциональной ИВО. Главным принципом фармакологического лечения расстройств мочеиспускания является улучшение функции нижних мочевыводящих путей. D. Williams и соавт. [18] обосновали основную направленность действия фармакологических средств, влияющих на адрено- и холинергические рецепторы детрузора и замыкательного аппарата нижних мочевыводящих путей. В фазе накопления необходимо снижать активность детрузора и стимулировать замыкательный аппарат, а в фазе опорожнения – стимулировать сократительную способность детрузора и уменьшать уретральное сопротивление.
В своей практике при выборе лечения больных хроническими воспалительными заболеваниями нижних
мочевыводящих путей помимо антибактериальных и противовоспалительных лекарственных средств мы используем препараты для коррекции функциональных нарушений нижних мочевыводящих путей, выявленных в ходе комбинированного уродинамического исследования.
С учетом полученных нами данных, а именно частым выявлением императивных и обструктивных функциональных расстройств мочеиспускания у пациенток с хроническим рецидивирующим циститом и необструктивным пиелонефритом, можно утверждать, что при их лечении патогенетическое значение имеет использование α-адреноблокаторов и М-холиноблокаторов.
По данным наших исследований, наиболее часто среди данной категории больных в ходе уродинамического исследования выявляется функциональная ИВО, что диктует необходимость использования α-адреноблокаторов, позволяющих повышать эффективность комплексной терапии этих больных. Предпочтение следует отдавать наиболее селективным препаратам. По данным B. Davis и соавт. [19], наибольшей уроселективностью среди α-адреноблокаторов обладает тамсулозин (сонизин), характеризующийся суперселективным действием на α1А-подтип адренорецепторов. Данный факт определяет отличительную особенность сонизина – отсутствие необходимости
титрования дозы препарата. Аффинность данного препарата к α1A-адренорецепторам в 20 раз выше
таковой к α1B-адренорецепторам, расположенным в гладких мышцах сосудов. Благодаря такой высокой селективности препарат не вызывает клинически значимого снижения АД у пациентов как с артериальной гипертензией, так и с нормальным исходным АД. Сонизин не подвергается эффекту “первого прохождения” и медленно биотрансформируется в печени с образованием фармакологически активных метаболитов, сохраняющих высокую селективность к α1A-адренорецепторам. Большая часть активного вещества присутствует в крови в неизмененном виде. Эти особенности в свою очередь позволяют выделять его среди остальных препаратов этой группы и рекомендовать к использованию в комплексном лечении. Сонизин избирательно и конкурентно блокирует постсинаптические α1A-адренорецепторы, находящиеся в гладкой
мускулатуре шейки мочевого пузыря, уретры, а также α1D-адренорецепторы, расположенные преимущественно в теле мочевого пузыря. Это приводит к снижению тонуса гладкой мускулатуры шейки мочевого пузыря, уретры и улучшению функции детрузора. За счет этого уменьшается функциональная ИВО.
Наиболее часто используемыми М-холиноблокаторами в лечении гиперактивности детрузора являются оксибутинин (дриптан), солифенацин (везикар), толтеродин (детрузитол), троспия хлорид (спазмекс). Арсенал селективных препаратов указанной фармакологической группы способствует достижению желаемого положительного результата с минимумом побочных эффектов. В частности, в группе М-холиноблокаторов, наиболее селективным является солифенацин (везикар) [20]. Это преимущество наряду с удобством приема (1 раз в сутки) позволяет рассматриваемой категории пациентов использовать везикар на протяжении длительного времени с минимальным количеством побочных
эффектов. Более того, по данным последних исследований, солифенацин не влияет вообще или оказывает незначимое влияние на когнитивные функции организма, что становится актуальным для социально активных пациентов и пациентов старшей возрастной группы.
Сочетанное использование α-адреноблокатора и М-холиноблокатора в лечении больных гиперактивностью детрузора в сочетании с функциональной ИВО является наиболее эффективным, так как оно направлено одновременно на нивелирование самой детрузорной гиперактивности и устранение динамического компонента ИВО, которая в свою очередь может быть и причиной, и фактором поддержания гиперактивности мочевого пузыря. Использование наиболее селективных препаратов обеих фармакотерапевтических групп (сонизин в комбинации с везикаром) имеет свои
преимущества, поскольку позволяет избегать нежелательных побочных реакций, которые могут иметь
место при применении других менее селективных α-адреноблокаторов и М-холиноблокаторов.
Заключение. Выявленные функциональные расстройства мочевого пузыря и/или уретры у пациентов с хроническими воспалительными изменениями мочевыводящих путей можно объяснить нарушением существующего в норме функционального равновесия между α- и β-адренергическими влияниями симпатического отдела вегетативной нервной системы на детрузор. Повышение активности адренорецепторов уретры и шейки мочевого пузыря может приводить к дискоординации деятельности детрузора и проксимального отдела уретры, так называемого функционального стеноза уретры, или детрузорно-сфинктерной диссинергии. Вышеизложенное предполагает, что для устранения функциональных нарушений нижних мочевыводящих путей и улучшения деятельности этих органов оправданно использование лекарственных препаратов, влияющих на функцию симпатических и парасимпатических элементов вегетативной нервной системы. При длительно существующей дисфункции нижних мочевыводящих путей возникший воспалительный процесс со временем прогрессирует, соответственно, без нивелирования нарушенной функции мочевого пузыря и уретры проводимая антибактериальная и противовоспалительная терапия может оказаться недостаточной. На основании полученных результатов исследования можно говорить о том, что у женщин хронический необструктивный пиелонефрит может являться не причиной, а следствием функциональных нарушений нижних мочевыводящих путей, связанных с расстройством нервной регуляции этих органов.



