Введение. Хронический пиелонефрит (ХП) является одним из самых частых заболеваний почек. За последние годы число таких больных увеличилось, а заболеваемость составляет 18 случаев на 1000 человек. Женщины болеют в 2–5 раз чаще мужчин. Распространенность ХП как заболевания, приведшего к смерти, колеблется от 8 до 20% [1, 2]. Хронический пиелонефрит – неспецифическое инфекционно-воспалительное заболевание почек с преимущественным поражением интерстициальной ткани, канальцев, чашечно-лоханочной системы.
В связи с большой распространенностью ХП и значительными трудопотерями из-за обострений и осложнений вопросы его диагностики и терапии представляют определенный научно-практический интерес и огромную социальную значимость [3].
Течение инфекционно-воспалительного процесса в мочеполовой системе сопровождается нарушением микроциркуляции в почечной паренхиме, изменением в гуморальном и клеточном звеньях иммунитета, повышением уровня провоспалительных цитокинов [6]. В настоящее время для лечения пиелонефрита чаще всего используют антибактериальные, противовоспалительные препараты, иммуномодуляторы, а также растительные препараты в составе комплексной терапии.
Однако, несмотря на многообразие лекарственных средств, результаты терапии ХП нельзя признать удовлетворительными. Так, по данным многих авторов, полное выздоровление происходит в 15–20% случаев [3, 4]. Изучение альтернативных немедикаментозных методов в профилактике, лечении и реабилитации ХП является актуальной задачей. Применение природных лечебных факторов, в том числе фитотерапии, весьма перспективное направление в лечении данной патологии.

В зависимости от состава растительные препараты могут стимулировать защитные силы организма, обладать антибактериальной активностью. Как правило, они менее токсичны по сравнению с синтетическими и лучше переносятся пациентами, что позволяет применять их длительно – месяцами и даже годами [5].
К числу лекарственных растительных препаратов относится Канефрон® Н («Бионорика СЕ», Германия). Это комбинированный препарат, состоящий из травы розмарина, корня любистока и травы золототысячника, который выпускается в форме раствора и драже для приема внутрь. Препарат обладает противовоспалительным, антибактериальным, диуретическим и спазмолитическим свойствами, улучшает клубочковую фильтрацию, в эксперименте подавляет адгезию E. coli к уротелию, демонстрирует обезболивающий эффект (табл. 1). При этом препарат не вызывает привыкания и синдрома отмены.
Известно, что противовоспалительный эффект Канефрона Н связан с наличием в его составе розмариновой кислоты, которая блокирует неспецифическую активацию комплемента. В результате снижается уровень провоспалительных цитокинов и скорейшее формирование иммунного ответа.
Целью исследования было улучшить результаты лечения больных ХП путем включения в стандартную терапию растительного лекарственного препарата Канефрон Н, а также оценить его влияние на показатели гуморального и клеточного иммунитета и микроциркуляцию в почках.
Материал и методы. В исследование включены 48 пациентов, страдавших первичным ХП в стадии латентного воспаления. Все пациенты находились на диспансерном наблюдении с диагнозом ХП и проходили очередной контрольный осмотр у уролога поликлиники. Преимущественно это были женщины – 77%. Продолжительность заболевания на момент обращения составляла от 3 до 18 лет.

Критерии включения больных в исследование: первичный ХП (в отсутствие аномалий развития мочевой системы и нарушений уродинамики); ХП в фазе латентного воспаления (симптомы слабо выражены или отсутствуют, но уровни провоспалительных цитокинов (ИЛ-6, ИЛ-1β, ФНО-α) в сыворотке крови повышены).
Критерии исключения: ХП в фазе активного воспаления или ремиссии; все урологические заболевания в острой стадии; наличие у больных ХП явлений интермиттирующей или терминальной почечной недостаточности; гидронефроз, пионефроз; туберкулез мочеполовой системы; злокачественные и доброкачественные новообразования мочеполовой системы; другие соматические или системные заболевания в стадии декомпенсации.
Пациенты, соответствующие критериям включения, методом случайной выборки были рандомизированы на две группы, сопоставимые по возрасту, полу, клиническим проявлениям ХП, длительности заболевания. Пациенты 1-й (n=23) группы получали стандартную терапию. Во 2-й (n=25) группе больные дополнительно к стандартному лечению с первого дня принимали Канефрон Н по 2 драже 3 раза в день в течение 30 дней.
Пациенты обеих групп получали стандартную терапию согласно Клиническим рекомендациям [1]. Антибактериальную терапию назначали с учетом чувствительности возбудителя по результатам посева мочи. Во всех случаях это была терапия одним антибактериальным препаратом внутрь в течение 10 дней. Применяли левофлоксацин 500 мг 1 раз в день, ципрофлоксацин 500 мг 2 раза в день, цефиксим 400 мг 1 раз в день, амоксициллина клавуланат 625 мг 3 раза в день.
В качестве спазмолитика использовали дротаверин внутрь по 40 мг 3 раза в день, 7 дней.
У пациентов обеих групп до лечения и через 30 дней от начала лечения оценивали клиническую симптоматику. Жалобы выявляли с помощью анкет-опросников (повышение температуры тела, боль в области почек, слабость, тошнота и т.д.), проводили пальпацию области проекции почек, измерение температуры тела в аксиллярной впадине, АД, ЧСС. Выполняли клинический анализ крови, общий анализ мочи, биохимический анализ крови, бактериологическое исследование мочи. В сыворотке крови оценивали содержание иммуноглобулинов классов G, А, М, показатели цитокинового профиля – ИЛ-6, ИЛ-1b и ФНО-α. Для определения уровня иммуноглобулинов и цитокинов использовали метод ИФА и наборы реагентов (для иммуноглобулинов – иммуноскрин-G, M, A-ИФА-Бест), выпускаемые ЗАО «Вектор-Бест» (Новосибирск), по прилагаемым инструкциям.
Микроциркуляцию в почках оценивали косвенным (непрямым) методом лазерной допплеровской флоуметрии в точке проекции почек на коже V 21, на уровне промежутка между остистыми отростками ThXII и L1 на 1,5 см кнаружи от задней срединной линии (первая боковая линия спины). Исследования проводили на аппарате ЛАКК-02 (НПП «ЛАЗМА», Россия) с помощью программного обеспечения LDF, запись осуществляли в течение 1–2 мин. Использовали светопроводимый зонд с излучением из инфракрасной области спектра (длина волны – 1,15 мкм) и толщиной слоя зондирования около 1,8 мм.
Разработанный способ косвенной оценки микроциркуляции в точках проекции почек на коже с помощью метода лазерной допплеровской флоуметрии подтвержден патентом на изобретение (патент № 2338465 от 20.11.2008).
Результатом флоуметрии было определение показателя микроциркуляции (перфузии; ПМ), показателя шунтирования (ПШ) и индекса эффективности микроциркуляции:
ПМ=К×Nэр×Vср,
где ПМ – показатель микроциркуляции; К – коэффициент пропорциональности (К=1); Nэр – количество эритроцитов; Vcp – средняя скорость эритроцитов в зондируемом объеме.
Амплитуда сигнала, пропорциональная указанному произведению, измеряется в перфузионных единицах (перф. ед.).
Показатель микроциркуляции (перфузии) можно представить следующим выражением:
ПМ=М+дПМ,
где М – постоянная составляющая перфузии; дПМ – переменная составляющая перфузии.
Показатель шунтирования вычислен по формуле:
ПШ=МТ/НТ,
где МТ – миогенный тонус, НТ – нейрогенный тонус сосудов.
Индекс эффективности микроциркуляции (ИЭМ), характеризующий взаимоотношения между колебаниями кровотока в разных областях частотного спектра, определен по формуле:
ИЭМ=AтахLF/(AтахHF+AтахCF),
где АтахCF – амплитуда кардиальных колебаний; АтахLF – амплитуда медленных колебаний; АтахHF – амплитуда быстрых колебаний.
Статистическая обработка полученного материала проведена с использованием программ Statistica v 7.0, Microsoft OfficeExcel 2007. В случаях нормального распределения, а также равенства выборочных дисперсий для сравнения средних использовалн t-критерий Стьюдента. Равенство выборочных дисперсий оценивали по F-критерию. Для сравнения связанных выборок использован парный t-критерий Стьюдента. Когда распределение отличалось от нормального, а также при неравенстве дисперсий применен U-критерий Манна–Уитни (для независимых выборок) и T-критерий Вилкоксона (для связанных выборок).
Результаты. После лечения у пациентов 2-й группы, получавших фитотерапию, все жалобы купировались полностью, а у ряда пациентов 1-й группы сохранялись слабость – у 18%, потливость – у 5% и головная боль – у 6%. Таким образом, клинический эффект терапии был более выражен в группе, где пациенты применяли фитопрепарат (табл. 2).
У 100% пациентов обеих групп до лечения отмечалось клинически значимое повышение числа лейкоцитов в общем анализе мочи. На фоне проводимой терапии через 30 дней число пациентов с повышенным уровнем лейкоцитурии снизилось в обеих группах, но более значимо – во 2-й (до 4%) по сравнению с 1-й группой (17,4%).
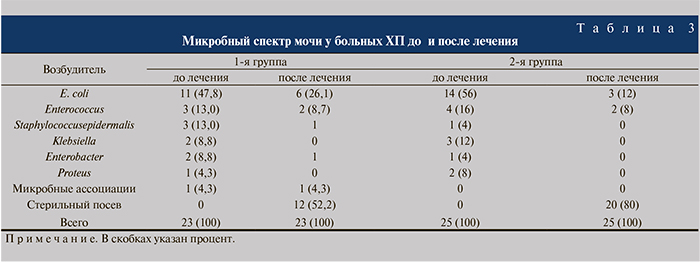
По данным микробиологического исследования мочи до лечения у всех пациентов обеих групп высевался тот или иной штамм возбудителя (табл. 3).
После проведенного лечения анализ микробного спектра показал, что положительная динамика прослеживается в обеих группах пациентов. Однако количество стерильных посевов было больше во 2-й группе и составило 20 (80%) случаев, по сравнению с 1-й – 12 (52,2%), что свидетельствует о более выраженном антибактериальном эффекте в группе с применением фитотерапии.
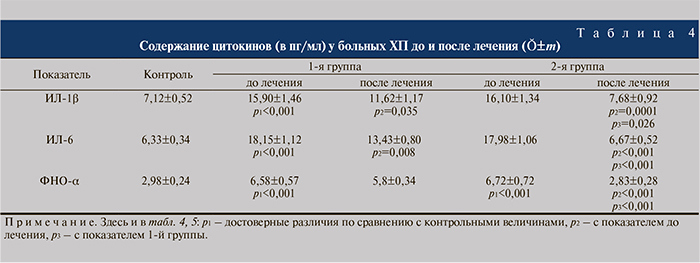
Как видно из табл. 4, после лечения в 1-й группе содержание цитокинов ИЛ-1, ФНО-α, ИЛ-6 оставалось высоким, что свидетельствовало о сохраняющемся воспалительном процессе в почечной паренхиме. У пациентов 2-й группы отмечено статистически значимое снижение концентрации цитокинов до контрольных величин, что было расценено как нормализация цитокинового профиля на фоне снижающегося воспалительного процесса в почечной паренхиме.
При исследовании концентраций иммуноглобулинов классов G, А, М в сыворотке крови до лечения у больных обеих групп отмечено увеличение уровня Ig G, уменьшение – Ig A и Ig M, что было расценено как подавление гуморального звена иммунитета.
В результате лечения в 1-й группе концентрации иммуноглобулинов не имели статистически значимой динамики и превышали контрольные показатели, что свидетельствовало о медленном формировании иммунного ответа. У больных 2-й группы отмечено восстановление уровней всех изучавшихся иммуноглобулинов до контрольных величин, что было расценено как скорейшее формирование иммунного ответа (табл. 5).
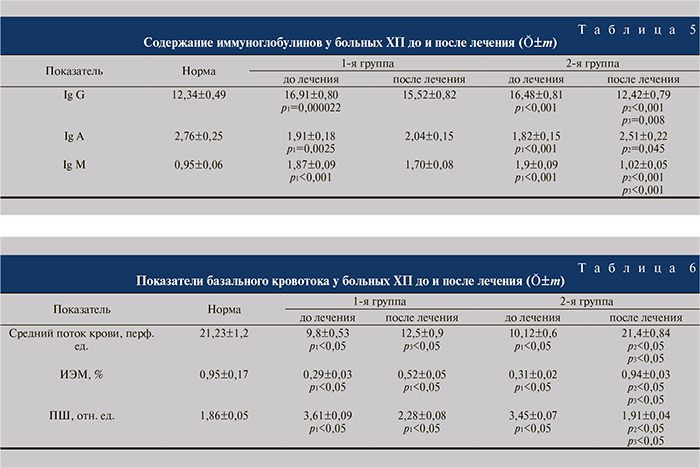
При исследовании состояния микроциркуляции почек у больных ХП до лечения были выявлены значительные изменения базального кровотока, выразившиеся в снижении среднего потока крови, ИЭМ и повышении ПШ по сравнению с контрольными величинами, что свидетельствует о функциональном подавлении интенсивности перфузии и ухудшении микроциркуляции в почках (ишемия, застой; табл. 6).
Это можно объяснить недостаточной эффективностью активных вазомоторных механизмов регуляции микроциркуляции, что является следствием воспалительного процесса в почках.
На фоне стандартной терапии (1-я группа) произошло статистически значимое повышение среднего потока крови, который, однако, не достиг контрольной величины. Индекс эффективности микроциркуляции имел тенденцию к повышению, но также не достиг контрольных показателей. Вместе с тем отмечена положительная динамика ПШ, но статистически незначимая (см. табл. 6).
При оценке показателей микроциркуляции после комплексного лечения с применением препарата Канефрон Н (2-я группа) отмечено восстановление перфузии, ИЭМ статистически значимо повысился и приблизился к контрольному значению. Показатель шунтирования снизился до контрольных величин. Это можно объяснить усилением активных вазомоторных механизмов регуляции микроциркуляции, снижением застойных явлений в почках.
Как видно из проведенного исследования, у больных ХП в фазе латентного воспаления высока вероятность перехода заболевания в активную фазу в связи с бактериальной обсемененностью мочи, нарушением микроциркуляции почек, нарушением гомеостаза цитокинов.
Включение в комплекс лечебных мероприятий препарата Канефрон Н у пациентов с ХП позволило статистически значимо эффективнее по сравнению со стандартным лечением улучшить микроциркуляцию почек, увеличить частоту стерильных посевов мочи, ускорить восстановление гомеостаза цитокинов, это привело к снижению воспалительного процесса в почечной паренхиме, что способствует предупреждению дальнейшей хронизации процесса.
Выводы
- Применение препарата Канефрон Н в комплексном лечении больных ХП дает возможность более эффективно воздействовать на основные звенья патогенеза заболевания.
- Включение препарата Канефрон Н в комплекс лечебных мероприятий при латентном ХП увеличивает частоту стерильных посевов мочи, улучшает микроциркуляцию почек, что приводит к снижению воспалительного процесса в почечной паренхиме.
- Использование препарата Канефрон Н пациентами с ХП более эффективно, чем стандартное лечение, снижает уровни провоспалительных цитокинов, позволяет ускорять иммунный ответ, что способствует предупреждению дальнейшей хронизации процесса.



