Введение. Неудовлетворительные результаты лечения поверхностных (неинвазивных) опухолей мочевого пузыря, высокая вероятность рецидивирования (50–70%) [1] диктуют необходимость разработки и внедрения новых медицинских технологий, использование которых позволит улучшить результаты лечения пациентов с данным заболеванием.
Основная тенденция при выборе метода лечения заболеваний мочевого пузыря в настоящее время – это малая травматичность и высокая эффективность в разрушении патологических участков при возможности контроля за лечебным процессом и профилактики осложнений. Потенциальными преимуществами малоинвазивных технологий являются короткие сроки госпитализации, раннее возвращение к нормальной активности, меньшие затраты на лечение и возможность выполнять операцию пациентам с высоким анестезиологическим риском.
В зависимости от типа лазера и выходных параметров излучения лазеры используют для абляции, коагуляции и/или резекции опухолей мочевого пузыря [2]. Краткий анализ основных достоинств и недостатков применения лазерных методов в лечении поверхностных опухолей мочевого пузыря представлен в табл. 1.
Основным преимуществом применения лазеров в лечении опухолей мочевого пузыря по сравнению с трансуретральной резекцией (ТУР) служит значительное (более чем в 3 раза) сокращение частоты локальных рецидивов [3]. Достоинством лазерных технологий является и то, что при их использовании минимизированы болевые ощущения пациентов по сравнению с методами электрохирургии. По мнению некоторых авторов, при воздействии лазера происходит быстрое разрушение невральной ткани, тогда как электрохирургическое вмешательство сопровождается распространением электрического тока вдоль нервных волокон. Потенциально это дает возможность осуществления процедуры под локальной анестезией в амбулаторных условиях. Кроме того, воздействие лазерного излучения не сопровождается возбуждением запирательного нерва, позволяя полноценно воздействовать на опухоли, локализующиеся на боковой стенке мочевого пузыря. Лазерные технологии эффективны также в лечении дивертикулов мочевого пузыря, опухолей передней стенки мочевого пузыря, когда ТУР невыполнима. Кровопотеря при применении лазеров по сравнению с методами диатермии меньше, что снижает требования к ирригации при проведении вмешательства. Становится возможным лечение пациентов с коагулопатиями, а также больных, принимающих антикоагулянты. Ввиду снижения требований к ирригации появляется возможность оперировать без применения катетеров, что обеспечивает сокращение сроков пребывания в клинике. Интраоперационно для ирригации используется физиологический раствор, что помогает избежать нечастого осложнения – ТУР-синдрома [3].

Основным недостатком лазерных методов при лечении поверхностных опухолей мочевого пузыря является потеря ткани для гистологического анализа, что часто ограничивает их использование. Проникновение излучения в ткани наряду с эффективной коагуляцией стенки мочевого пузыря может вызывать трансмуральную коагуляцию стенки и приводить к повреждению тканей тазовых органов за мочевым пузырем, например кишечника, в отсутствие повреждения самой стенки пузыря [4]. Учет этого фактора важен при воздействии на более тонкие участки пузыря (например, в области верхушки); в этих случаях для уменьшения риска перфорации стенки мочевого пузыря операцию проводят при наполненном пузыре. Частота подобных осложнений относительно невысока. В серии вмешательств из более 2000 случаев с использованием Nd:YAG лазера частота перфораций не превысила 0,1% [5].
Возможности использования разных комбинаций органосохраняющего лечения рака мочевого пузыря изучены недостаточно. Мало публикаций об эффективности ТУР в сочетании с лазерной вапоризацией и обработкой ложа опухоли при дистанционной коагуляции. Данных об изменении тканей мочевого пузыря при интерстициальной лазерной коагуляции с использованием Nd:YAG-лазера в доступной литературе нам не встретилось.
Целью исследования стала разработка технологии воздействия на поверхностные слои мочевого пузыря с использование лазерного излучения в импульсно-периодическом режиме генерации на длине волны излучения 1064 нм как сочетанной процедуры после ТУР, так и самостоятельной процедуры, при которой лечение производится с использованием только лазерного излучения. Для достижения результата требуется определение степени и дозы воздействия лазерного излучения на ткани мочевого пузыря.
Материалы и методы. Работа выполнена на базах Института общей физики им. А. М. Прохорова РАН, кафедры эндоскопической урологии ГБОУ ДПО РМАПО Минздрава РФ (клиника НУЗ НКЦ ОАО «РЖД»), отделения экспериментальных животных ФГУ «НИИ урологии росмедтехнологий».
На доклиническом этапе исследований была рассчитана математическая модель для определения в условиях in vivo, на экспериментальных животных, безопасной дозы воздействия на ткани мочевого пузыря излучения лазерного хирургического комплекса [6]. Механизм взаимодействия лазерного излучения с биологическими тканями определяется как параметрами самого излучения: длиной волны, плотностью энергии падающего лазерного излучения, длительностью лазерного импульса, так и оптическими свойствами ткани, на которую оказывается воздействие.

Ткань стенки мочевого пузыря – сильно рассеивающая биологическая среда (μaºμ′s), в которой выполняются условия диффузионного приближения. Было рассмотрено взаимодействие импульсного излучения Nd:YAG-лазера с длиной волны λ 1,064 мкм и длительностью импульса 200 мкс, с тканью стенки мочевого пузыря человека, оптические характеристики которой представлены в табл. 2.
В этом случае ткань принималась как полубесконечная среда, на которую падает лазерный пучок диаметром d 0,6 мм с энергией в импульсе E, равной 0,4 Дж. Выбранное значение энергии импульса типично при лазерной коагуляции и вапоризации поверхностных тканей мочевого пузыря.
При частоте повторения импульсов 100 Гц за время между двумя импульсами процессы переноса тепла лазерной энергии начинают играть значительную роль в установлении картины распределения температуры тканей. Размеры зоны повреждения при длительном воздействии от 1 до 10 c (много больше длительности импульса) определяются балансом процессов генерации тепла и теплопереноса в ткани. При работе в импульсно-периодическом режиме и при длительностях воздействия большего характерного времени диффузии тепла из области воздействия (несколько секунд), область термического повреждения ткани расширяется и становится больше области, где температура ткани приближается к 60ºС.
В экспериментах на животных [8] при поверхностном воздействии лазера измеренная глубина термического повреждения ткани мочевого пузыря составила 2,62 мм при мощности излучения Nd:YAG-лазера, равной 50 Вт, и продолжительности воздействия 4 с, а при 40 Вт выходной мощности и продолжительности воздействия 2 с глубина воздействия не превышала 1 мм.
Эксперименты выполнены на 6 кроликах-самцах массой тела от 3 кг старше года. Забор образцов тканей из зоны повреждения для проведения гистологических исследований осуществлен через 1, 3, 7, 14, 21 день после воздействия. Материал фиксировали в нейтральном формалине, заливали в парафин и окрашивали гематоксилином, эозином, пикрофуксином.
В качестве источника излучения использован лазерный хирургический комплекс, предназначенный для рассечения и коагуляции тканей при выполнении эндоскопических и лапароскопических операций (табл. 3).
В состав комплекса входят:
- лазерный излучатель на основе алюмината иттрия с неодимом (Nd:YAG) с оптоволоконной доставкой выходного излучения (литотриптор);
- лазерный излучатель на основе иттрий-алюминиевого граната с неодимом (Nd:YAG) с оптоволоконной доставкой выходного излучения (скальпель-коагулятор);
- система обработки и отображения видеоинформации хода операции в реальном времени и управления комплексом на основе компьютера и сенсорного монитора.
Режим работы лазеров, входящих в состав комплекса, – импульсно-периодический. Комплекс имеет встроенную автономную систему охлаждения. Питание комплекса осуществляется от сети (220 Вт, 50 Гц, 16 А). Управление комплексом производится с 17” сенсорного монитора. Встроенная система обработки видеосигнала позволяет отображать ход оперативного вмешательства на экране монитора в режиме реального времени.
 Воздействие осуществлено контактно дистальным торцом кварцевого волоконно-оптического катетера с прямым выводом излучения и диаметром сердцевины 600 мкм, по которому произведена доставка излучения на внутреннюю поверхность стенки мочевого пузыря. В ходе экспериментов на ткани воздействовали в четырех различных режимах. Плотность энергии излучения на поверхности ткани варьировалась в диапазоне значений от 64 до 195 Дж/см2 (табл. 4). На каждый образец мочевого пузыря (кроме пузыря в острой форме, изъятие которого проведено сразу после процедуры) воздействовали в четырех точках на расстоянии около 5 мм друг от друга.
Воздействие осуществлено контактно дистальным торцом кварцевого волоконно-оптического катетера с прямым выводом излучения и диаметром сердцевины 600 мкм, по которому произведена доставка излучения на внутреннюю поверхность стенки мочевого пузыря. В ходе экспериментов на ткани воздействовали в четырех различных режимах. Плотность энергии излучения на поверхности ткани варьировалась в диапазоне значений от 64 до 195 Дж/см2 (табл. 4). На каждый образец мочевого пузыря (кроме пузыря в острой форме, изъятие которого проведено сразу после процедуры) воздействовали в четырех точках на расстоянии около 5 мм друг от друга.
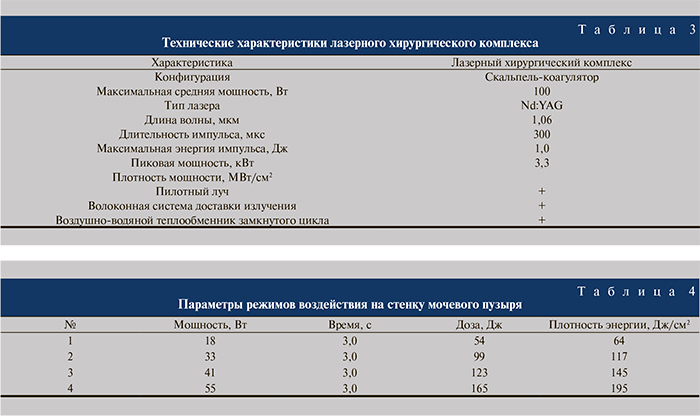
Результаты. Макроскопическая картина изменений в тканях мочевого пузыря при каждом из выбранных режимов воздействия представлена на рис. 1. На 7-е сутки после воздействия во всех образцах наблюдалось слияние зон повреждения по поверхности пузыря с образованием общего коагуляционного струпа, затрудняющего четкое позиционирование каждого из подходов. Воздействие в 3-м и 4-м режимах сопровождалось образованием полости на поверхности пузыря и частичной абляцией ткани, наблюдаемой в реальном времени. Микроскопически ни при одном из режимов воздействия не наблюдалось перфорации стенки мочевого пузыря.
Результаты гистоморфологического исследования стенки мочевого пузыря после контактной лазерной коагуляции в зависимости от дня получения материала, мощности, времени воздействия и энергии были следующими.
1-й день. 18 Вт, 4 с, 77 Дж: полость не сформирована, имеется мелкий поверхностный очаг некробиоза покровного уротелия и подслизистого слоя диаметром 3,5 мм с отеком и фрагментацией соединительнотканных волокон. Незначительный отек поверхностных отделов мышечного слоя стенки. Толщина стенки пузыря вместе с клетчаткой в зоне повреждения составляет 6 мм. 33 Вт, 3 c, 98 Дж: полость не сформирована, имеется мелкий поверхностный очаг некробиоза покровного уротелия и подслизистого слоя диаметром 3 мм с отеком и фрагментацией соединительнотканных волокон, мышечный слой интактен. Толщина стенки пузыря вместе с клетчаткой в зоне повреждения составляет 9 мм. 41 Вт, 3 с, 139 Дж: в толще слизистой оболочки и подслизистом слое имеется полость диаметром 0,75 мм, стенки которой представлены коагуляционным некрозом с обугливанием, ширина зоны некроза составляет 1 мм. За зоной некроза отмечается незначительный отек подслизистого и мышечного слоев. Эпителий у края полости некротизирован на протяжении 2,5 мм.
Толщина стенки пузыря вместе с клетчаткой в зоне повреждения составляет 3 мм. 55 Вт, 3 с, 175 Дж: в толще слизистой оболочки, подслизистом слое и поверхностных отделах мышечного слоя имеется полость диаметром 1 мм, стенки которой представлены коагуляционным некрозом с обугливанием, ширина зоны некроза составляет 1 мм. За этой зоной отмечается отек подслизистого, мышечного слоев и парапузырной клетчатки. Эпителий у края полости некротизирован на протяжении 2 мм. Толщина стенки пузыря вместе с клетчаткой в зоне повреждения составляет 5 мм.
3-й день. 18 Вт, 4 c, 76 Дж: полость не сформирована, имеется очаг некроза слизистой оболочки, подслизистого и мышечного слоев до середины его толщи (2 мм), мышечные волокна некротизированы лишь частично. Диаметр зоны некроза составляет 3 мм.
Вокруг зоны некроза – отек, эпителий в краях изъязвления в состоянии некробиоза на протяжении 2 мм. Толщина стенки в зоне повреждения – 4 мм. 33 Вт, 3 с, 97 Дж: полость не сформирована, имеется очаг некроза слизистой оболочки, подслизистого и поверхностных отделов мышечного слоев, мышечные волокна некротизированы лишь частично. Диаметр зоны некроза составляет 1,5 мм. Вокруг зоны некроза – отек, эпителий в краях изъязвления в состоянии некробиоза на протяжении 2,5 мм. Толщина стенки в зоне повреждения 3,5 мм. 41 Вт, 3 с, 140 Дж: имеется очаг коагуляционного некроза покровного уротелия протяженностью 4 мм, эпителий в краях зоны некроза в состоянии некробиоза на протяжении 2 мм. Подслизистый и мышечный слои стенки некротизизованы на всю глубину (4 мм), диаметр зоны повреждения составляет от 3 до 7 мм, мышечные волокна некротизированы частично. Кровеносные сосуды вблизи зоны повреждения резко расширены и полнокровны. 55 Вт, 3 с, 175 Дж: эпителий некротизирован в области диаметром 8 мм по поверхности пузыря, по краям зоны некроза эпителий в состоянии некробиоза на протяжении 2 мм. В стенке по всей ее глубине до клетчатки имеется щелевидная полость, стенки которой представлены коагуляционным некрозом без обугливания. Полость окружена зоной неравномерного некроза и некробиоза диаметром от 6 до 13 мм. Толщина стенки в зоне повреждения – 6 мм.
7-й день. 41 Вт, 3 с, 139 Дж: соответственно макроскопическому участку повреждения отмечается зона коагуляционного некроза глубиной 4 мм, покрытая тонким струпом, представленным скоагулированной до обугливания тканью. Толщина стенки в зоне повреждения – 5 мм. 55 Вт, 3 с, 175 Дж: соответственно макроскопическому участку повреждения, отмечается зона коагуляционного некроза глубиной до 6 мм. Толщина стенки в зоне повреждения – 7,5 мм. Имеется скудная перифокальная воспалительная инфильтрация. Толщина стенки вне зоны повреждения – 7 мм.
 14-й день. 41 Вт, 3 с, 139 Дж: соответственно макроскопическому участку повреждения отмечается зона коагуляционного некроза глубиной 2,0–2,5 мм с обугливанием по поверхности. Толщина стенки в зоне повреждения составляет 3,5 мм, вне зоны повреждения – 4 мм. 55 Вт, 3 с, 175 Дж: соответственно макроскопическому участку повреждения отмечается зона коагуляционного некроза глубиной 2,5 мм с обугливанием по поверхности. Толщина стенки в зоне повреждения составляет 4 мм, вне зоны повреждения – 4 мм.
14-й день. 41 Вт, 3 с, 139 Дж: соответственно макроскопическому участку повреждения отмечается зона коагуляционного некроза глубиной 2,0–2,5 мм с обугливанием по поверхности. Толщина стенки в зоне повреждения составляет 3,5 мм, вне зоны повреждения – 4 мм. 55 Вт, 3 с, 175 Дж: соответственно макроскопическому участку повреждения отмечается зона коагуляционного некроза глубиной 2,5 мм с обугливанием по поверхности. Толщина стенки в зоне повреждения составляет 4 мм, вне зоны повреждения – 4 мм.
21-й день. 41 Вт, 3 с, 139 Дж: соответственно макроскопическому участку повреждения отмечается зона коагуляционного некроза глубиной 3,5 мм, покрытая тонким струпом, представленным скоагулированной до обугливания тканью. Толщина стенки в зоне повреждения – 5,5 мм. Толщина стенки вне зоны повреждения – 7 мм. 41 Вт, 3 с, 175 Дж: соответственно, макроскопическому участку повреждения отмечается отсутствие слизистоподслизистого слоя стенки мочевого пузыря. Непосредственно на мышечном слое расположен струп, представленный скоагулированной до обугливания тканью. Толщина стенки в зоне повреждения составляет 2 мм, вне зоны повреждения – 7 мм.
Обсуждение. При проведении ИЛК мочевого пузыря в эксперименте ни при одном режиме воздействия не было зарегистрировано перфорации стенки мочевого пузыря.
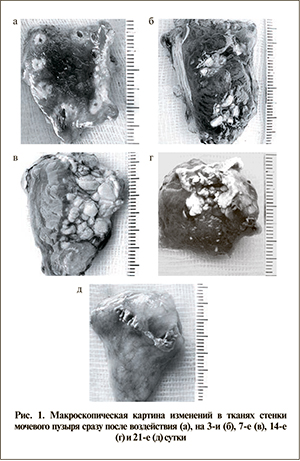
Воздействие на ткани пузыря лазерного излучения с выходной мощностью в диапазоне значений 18–33 Вт (диапазон плотностей энергии – 64–117 Дж/см2) приводит к умеренной коагуляции тканей на глубину до 2 мм мышечного слоя мочевого пузыря (рис. 2 а). Толщина стенки в зоне повреждения не отличается от таковой вне зоны. В процессе взаимодействия не происходит абляции ткани мочевого пузыря. Средняя доза излученной энергии находится в диапазоне 77–98 Дж.
Лазерное излучение с выходной мощностью в диапазоне значений 41–55 Вт (диапазон плотностей энергии 145–195 Дж/см2) обусловливает коагуляцию тканей на глубину до 4–6 мм (рис. 2б) мышечного слоя мочевого пузыря на 7-й день после воздействия и уменьшение толщины стенки в зоне воздействия примерно на 1 мм. Отмечается уменьшение толщины стенки мочевого пузыря на 21-й день после воздействия на 1,5–2,0 мм в зоне воздействия по сравнению с толщиной стенки вне зоны повреждения, что указывает на частичную абляцию ткани при взаимодействии. Средняя доза излученной энергии в этом режиме воздействия соответствовала диапазону 139–175 Дж.
В результате проведенных исследований установлено, что излучением скальпеля-коагулятора лазерного хирургического комплекса достигается эффективная коагуляция тканей стенки мочевого пузыря. Глубина зоны воздействия зависит от дозы, излученной на поверхность, и плотности энергии падающего излучения.
Заключение. Проведен расчет распределения интенсивности лазерного излучения в ткани стенки мочевого пузыря по данным литературы, получено расчетное значение эффективной глубины проникновения (2 мм) и глубины оптической зоны (4,8 мм) излучения с λ 1064 нм в диффузном приближении.
Экспериментально определены диапазоны плотностей энергии для эффективной и безопасной коагуляции стенки мочевого пузыря:
- в режиме воздействия в диапазоне 18–33 Вт 3 с (доза энергии – 77–98 Дж) глубина зоны коагуляции составляет 2 мм в отсутствие абляция ткани;
- в режиме воздействия в диапазоне 41–55 Вт 3 с (доза энергии – 139–175 Дж) глубина зоны коагуляции достигает 4–6 мм и сопровождается частичной абляцией тканей стенки мочевого пузыря и уменьшением толщины в зоне воздействия на 1,5–2,0 мм.
Результаты проведенного исследования доказывают возможность безопасного и эффективного воздействия лазерного излучения в определнных при исследовании параметров на стенку мочевого пузыря для удаления измененных тканей при сохранении функции здоровых.



