Введение. Рак мочевого пузыря (РМП) является распространенным онкологическим заболеванием, встречается в 15 из 100 тыс. случаев и занимает второе место после рака простаты среди онкозаболеваний мочеполовой системы [1, 2]. По данным официальной статистики за 2010 г., в РФ было зарегистрировано 13 562 случая РМП, при этом в России на долю данного вида рака приходится 4,5% всех злокачественных новообразований.
Диагностика РМП и оценка степени распространенности опухолевого процесса основываются на использовании лабораторных, ультразвуковых, рентгенологических (КТ, МРТ), эндоскопических методов. «Золотым» стандартом диагностики РМП остается цистоскопия. С помощью цистоскопии с последующей ТУР-биопсией стенки мочевого пузыря можно установить не только диагноз, но и стадию РМП. Данный метод диагностики является высокоинформативным, но инвазивным. Цитологическое исследование мочи – неинвазивный метод диагностики РМП, однако его чувствительность и специфичность не очень высоки и составляют, по разным данным, 44 и 98% соответственно[3, 4].
Как известно, РМП характеризуется высоким риском рецидивирования. Цистоскопия при РМП является наиболее часто используемым методом для обнаружения возможного рецидива РМП. Обследование должно проводиться каждые 3 мес в течение 2 лет после лечения, через каждые 6 мес в следующие 2 года и далее 1 раз в год. При обнаружении рецидива протокол возобновляется. Ввиду инвазивности цистоскопии больной может не соблюдать предписанной выше схемы обследования, что может стать причиной несвоевременного выявления рецидива РМП, а значит, обусловить неблагоприятный исход болезни. В связи с этим большой интерес представляет внедрение неинвазивных методов диагностики, в частности исследование онкомаркеров РМП в клеточном материале мочи.
Выявление рецидива РМП на ранней стадии считается важным условием успешности лечения, в связи с этим актуальной задачей современной онкологии является поиск онкомаркера, позволяющий рано диагностировать рецидив заболевания [6]. Определение онкомаркеров в клеточном материале мочи, возможно, приведет к сокращению числа контрольных цистоскопий, что позволит повысить качество жизни пациентов, находящихся под наблюдением [5, 6]. Одним из таких онкомаркеров является теломераза.
Ключевым признаком опухолевой клетки является способность к неограниченному делению, что делает ее условно бессмертной [7]. Пролиферативный потенциал опухолевых клеток тесно связан с наличием в них активной теломеразы. Теломераза – фермент, синтезирующий теломерные повторы ДНК (ТТАGGG у млекопитающих) на 3’-концах хромосом. Функционально теломераза является холоферментом, состоящим из двух главных субъединиц: РНК-компонента hTR и каталитической белковой субъединицы hTERT. В большинстве здоровых тканей hTR экспрессируется конститутивно, а экспрессия hTERT, необходимая для проявления активности теломеразы (АТ), индуцирована [8]. Экспрессия hTERT непосредственно связана с регуляцией активности фермента, в то время как экспрессия hTR осуществляется независимо от АТ [9]. Многие авторы считают, что информация об АТ может иметь большое значение в диагностике рака [8–10]. Возможность использования теломеразы в диагностических тестах довольно велика, так как позитивный результат может быть получен при наличии в образце всего лишь нескольких опухолевых клеток, при этом важно, что для диагностики могут оказаться пригодными образцы, полученные неинвазивными и минимально инвазивными способами. Согласно данным литературы, АТ присутствует в большинстве злокачественных опухолей [16, 17], в том числе и в клетках РМП [18].
 Например, АT в случае карциномы МП была обнаружена в эксфолиативных раковых клетках мочи и промывной жидкости [11, 12]. Чувствительность определения АТ в клеточном материале мочи у больных РМП составляет 70–94%, специфичность – 88–99% [13]. Предполагают, что кроме диагностики АT может найти применение и в прогнозировании исхода болезни. Как показывают результаты экспериментов, для некоторых видов опухолей существует корреляция между АT и определенными клинико-патологическими показателями. Диагностический и прогностический потенциал теломеразы требует дальнейшего изучения с привлечением большего числа больных с более длительными сроками наблюдения. Для этих целей также необходимо усовершенствование методов количественного определения АT.
Например, АT в случае карциномы МП была обнаружена в эксфолиативных раковых клетках мочи и промывной жидкости [11, 12]. Чувствительность определения АТ в клеточном материале мочи у больных РМП составляет 70–94%, специфичность – 88–99% [13]. Предполагают, что кроме диагностики АT может найти применение и в прогнозировании исхода болезни. Как показывают результаты экспериментов, для некоторых видов опухолей существует корреляция между АT и определенными клинико-патологическими показателями. Диагностический и прогностический потенциал теломеразы требует дальнейшего изучения с привлечением большего числа больных с более длительными сроками наблюдения. Для этих целей также необходимо усовершенствование методов количественного определения АT.
Цель исследования: оценить возможность применения определения АТ в клеточном материале мочи для неинвазивной диагностики РМП.
Материалы и методы. Обследованы 60 пациентов, среди них 48 (80%) мужчин и 12 (12%) женщин. Возраст мужчин составил 64 (34–84) года, женщин – 59 (39–81) лет. Локальный Этический комитет Первого МГМУ им. И. М. Сеченова одобрил протокол исследования (протокол № 02-14 от 19.02.2014), а все участники дали информированное согласие в письменной форме на участие в исследовании. Работа проведена в урологической клинике Первого МГМУ им. И. М. Сеченова и в лаборатории МНИИМЭ.
Были исследованы клеточные материалы мочи (до и после операции) и образцы опухолевой ткани (операционный материал) от 48 пациентов с подозрением на РМП (основная группа). Опухолевую ткань получали после трансуретральной резекции стенки мочевого пузыря (n=38), открытой резекции мочевого пузыря (n=4), цистэктомии (n=6). Полученная после запланированного оперативного пособия опухолевая ткань была подвержена гистологическому исследованию, диагноз РМП подтвержден во всех случаях. Из них у 30 пациентов установлена стадия Т1N0M0, у 4 – Т2aN0M0, у 5 – Т2вN0M0, у 5 – T3aN0M0, у 3 – T3вN0M0 и у 1 – Т4N1M1. У 15 пациентов диагностирована высокая степень дифференцировки (G1) опухоли, у 23 – умеренная (G2) и у 10 – низкая (G3). Контрольную группу составили 12 человек с гистологически подтвержденным диагнозом «цистит». От этих пациентов было получено 12 образцов клеточных материалов мочи и ткани после запланированной цистоскопии и при необходимости – биопсии стенки мочевого пузыря.
Получение клеточных материалов мочи. Все процедуры центрифугирования при получении клеточного материала мочи проводили при комнатной температуре. Для промывки клеточных материалов применяли охлажденный до 4оС стерильный однократный раствор PBS (0,145 M NaCl, 0,76 M NaH2PO4, 2.24 M Na2HPO4). Для получения клеточных материалов использовали вторую утреннюю порцию мочи. Каждую пробу в течение 30 мин охлаждали при температуре 4оС. Далее 100 мл каждой пробы равномерно распределяли по культуральным пробиркам на 15 мл и центрифугировали со скоростью 2500 об/мин в течение 10 мин (центрифуга ELMI CM-6MT, ротор 6M, Латвия). Супернатант отбрасывали, и осадки в каждой пробирке ресуспендировали в 1 мл однократного раствора PBS. Далее содержимое всех пробирок равномерно распределяли по двум культуральным пробиркам на 15 мл и центрифугировали в течение 10 мин при 2500 об/мин, после чего повторяли процедуру промывки осадков в 1 мл однократного раствора PBS. После этого осадок в каждой пробирке ресуспендировали в 1 мл раствора PBS и переносили в две микропробирки на 1,5 мл, затем центрифугировали на микроцентрифуге (Eppendorf 5415, ротор 14000 RPM, Германия) 10 мин при 2500 об/мин. Супернатант отбрасывали, а остаток капель жидкости в пробирке с осадком аккуратно удаляли полоской фильтровальной бумаги («Wha tman», Великобритания). Часть осадка отбирали для подсчета в нем числа клеток, который осуществляли в камере Горяева с использованием 0,4%-ного раствора красителя Trypan blue Stain («Sigma», США). Далее осадок клеток замораживали в жидком азоте и хранили при -70ºС.
Определение активности теломеразы. Перед приготовлением белковых экстрактов образцы клеточных материалов мочи размораживали на льду. Далее к ним добавляли холодный лизирующий CHAPS-буфер, содержащий 10 мМ Трис-HCl (рН 7,5), 1 мМ MgCl2, 1 мМ EGTA, 0,1 мМ PMSF, 5 мМ β-меркаптоэтанола, 0,5% (в/о) CHAPS и 10% (в/о) глицерина. CHAPS-буфер добавляли из расчета 1 мкл на 1000 клеток осадка. Затем клеточный материал мочи интенсивно ресуспендировали в буфере и инкубировали на льду в течение 30 мин. В процессе инкубации осадок интенсивно перемешивали через каждые 5 мин на аппарате Vortex в течение нескольких секунд. Полученный клеточный экстракт центрифугировали со скоростью 12000 g в течение 30 мин при 4ºС (Eppendorf 5415, ротор 14000 RPM, Германия). Супернатант, не касаясь осадка, аккуратно переносили по 25 мкл в чистые микропробирки и быстро замораживали в жидком азоте. Готовые экстракты хранили при -70 ºС.

При использовании операционного материала непосредственно перед стадией лизирования осуществляли гомогенизацию образца. Для этого около 30 мг размороженного образца помещали в стеклянный мини-гомогенизатор и проводили первую гомогенизацию на льду в течение 1 мин в 300 мкл лизирующего CHAPS-буфера. CHAPS-буфер добавляли из расчета 10 мкл на 1 мг ткани. Затем каждые 5 мин проводили еще 6 стадий гомогенизации продолжительностью не более 1 мин каждая. Далее, как и при обработке клеток, гомогенат центрифугировали, аккуратно отбирали супернатант, разделяли его на аликвоты по 25 мкл, которые быстро замораживали в жидком азоте и хранили при -70 ºС.
Концентрацию белка в экстрактах клеток и тканей определяли с помощью красителя Coomassie Brilliant Blue G-250 («Sigma», США) по методу Брэдфорд [16].
 Активность теломеразы определяли с помощью метода TRAP [13] с неизотопной модификацией [15].
Активность теломеразы определяли с помощью метода TRAP [13] с неизотопной модификацией [15].
Элонгацию олигонуклеотидного субстрата и последующую амплификацию проводили в 50 мкл реакционной смеси, содержащей 67 мМ Трис-HCl (рН 8,8); 16,6 мМ (NH4)2SO4; 0, 01% Tween-20; 1,5 мМ MgCl2; 1 мМ EGTA; 50 мМ каждого dNTP; 0,1 мкг TS-праймера (5ATTCCGTCGAGCAGAGTT-3) и 1–16 мкл исследуемого экстракта, содержащего 8; 4; 2 и 0,7 мкг белка. В качестве положительного контроля использовали 1 мкл клеточного экстракта опухолевой клеточной линии К562 (хронический миелоидный лейкоз), разбавленного лизирующим буфером CHAPS и эквивалентного 1000 клеток опухолевой линии, с концентрацией белка 0,04 мкг/мкл.
В качестве отрицательного контроля вместо экстракта использовали 1 мкл буфера CHAPS. Опосредованное теломеразой удлинение TS-праймера происходило при инкубации реакционной смеси при 37ºС в течение 25 мин. По окончании инкубации смесь выдерживали 5 мин при 94ºС для инактивации теломеразы. Затем в каждую пробу добавляли 0,1 мкг СХ-праймера (5СССTTACCCTTACCCTTACCCTAA-3) и 2,5 ЕД SmarTaq ДНК-полимеразы («Диалат», Россия). Реакционную смесь амплифицировали в течение 35 циклов ПЦР в следующем режиме: 94ºС – 60 с, 50ºС – 60 с, 72ºС – 90 с. Разделение амплификационных продуктов осуществляли методом электрофореза в 10%-ном неденатурирующем ПААГ, использовав 1 Трис-боратный-ЭДТА (1хТБЕ) буфер (0,1 М борная кислота, 0,1 М Трис, 2 мМ ЭДТА). Образцы после ПЦР вносили в лунки геля в объеме 10 мкл, предварительно смешав их с 2 мкл лидирующего красителя Orange G (шестикратный раствор). Электрофорез проводили в течение 20 мин при напряженности электрического поля 25 В/см в случае одного геля и 40 В/см в случае парных гелей.
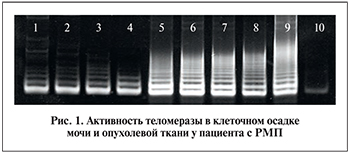
Визуализацию разделенных TRAP-продуктов проводили на УФ-трансиллюминаторе (λ 300 нм) после окрашивания геля в течение 30 мин в растворе красителя SYBR Gold («Molecular Probes», США), разведенного 1 TBE-буфером в соотношении 1:10000 при комнатной температуре в темноте. Окрашенные гели фотографировали цифровой камерой. Интенсивность TRAP-продуктов оценивали визуально и с помощью программы для анализа изображений ImageJ 1.35I («Kodak», США). При этом интенсивность TRAP-продуктов исследуемых проб сравнивали с TRAP-продуктами в контрольном образце, содержащем экстракт (0,04 мкг клеточного белка), полученный из теломеразопозитивных клеток линии К562 (хронический миелоидный лейкоз человека). Теломеразную активность в контрольном образце принимали за единицу (100%). Исследуемый образец считался теломеразопозитивным и подлежал обсчету при выявлении в TRAP-продуктах трех и более горизонтальных полос, располагавшихся на расстоянии длины одного теломерного повтора (6 п.н.) друг от друга (рис. 1).
Данные описаны с применение методов описательной статистики. Указана медиана, 5-й и 95-й перцентили. Сравнение данных выполняли с применение критерия хи-квадрат, Манна–Уитни, Крускалла–Уоллиса. Статистически значимыми различия признавались при уровне Р менее 0,05. С целью уточнения чувствительности и специфичности построены ROC-кривые и уточнена площадь под кривой.
Результаты. Из 48 образцов клеточного материала мочи, полученных от больных с подозрением на РМП в предоперационном периоде, теломеразопозитивных образцов было 45 (93,75%), теломеразонегативных – 3 (6,25%). У всех больных данной группы был гистологически верифицирован РМП. Ни в одном из 48 образцов клеточного материала мочи, полученных от тех же пациентов в послеоперационном периоде, АТ зарегистрировано не было. Из 12 образцов клеточного материала мочи пациентов с гистологически верифицированным циститом в 11 (97,9%) АТ не отмечено, в 1 (2,1%) детектировалась слабая АТ. Таким образом, у больных РМП статистически значимо чаще выявлялась АТ в моче (р=0,001).

Все 48 образцов опухолевой ткани пациентов с гистологически верифицированным РМП были теломеразопозитивными, тогда как ни в одном из 12 образцов контрольной группы пациентов с АТ зарегистрировано не было. Отмечено также статистически значимое преобладание АТ в ткани больных РМП (р=0,001).
Нами была предпринята попытка установить корреляцию между АТ в моче и ткани и стадией РМП (классификация по ТNM). Значимых различий содержания АТ в моче (р=0,067) и ткани (р=0,308) при разных стадиях опухолевого процесса отмечено не было. Однако необходимо отметить, что средняя АТ в клеточном материале мочи практически была в 2,13 раза меньше, чем АТ в ткани (табл. 1).
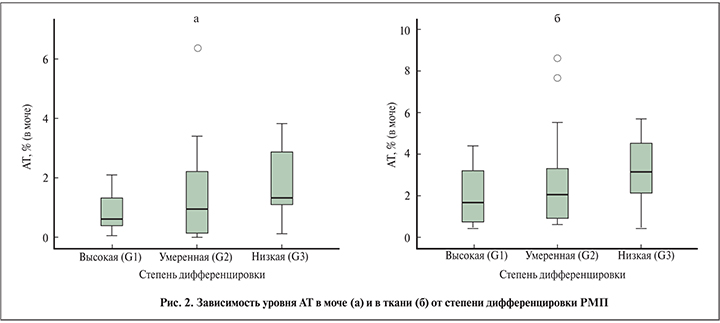
Также мы проанализировали зависимость уровня АТ в моче и ткани от степени дифференцировки РМП. В клеточных материалах мочи у больных высокодифференцированным РМП (n=15) средняя АТ составила 0,61%, умереннодифференцированным РМП (n=23) – 0,95%, низкодифференцированным РМП (n=10) – 1,33%, т.е. имеет место повышение уровня АТ в моче по мере снижения степени дифференцировки (рис. 2 а).
Также отмечено повышение уровня АТ в ткани по мере снижения степени дифференцировки рис. 2 б). Таким образом, нами выявлена тенденция между уровнем АТ и степенью дифференцировки РМП, что может стать важным диагностическим критерием в прогнозировании дальнейшего течения РМП.
Для того чтобы доказать, что АТ в образцах клеточного материала мочи пациентов с РМП определялась наличием именно опухолевых клеток, а не лейкоцитов, была проанализирована зависимость АТ в моче и ткани от степени лейкоцитурии (табл. 2). В подгруппах пациентов с лейкоцитурией и без нее значимых различий в АТ в моче (р=0,592) и в ткани (р=0,895) не выявлено. Таким образом, присутствие в клеточном осадке мочи лейкоцитов не влияет на АТ в исследуемом белковом экстракте.
Далее была проанализирована зависимость АТ от присутствия эритроцитов в составе клеточного осадка мочи пациентов (табл. 3). Эритроциты содержат белок гемоглобин, гем которого может снижать эффективность TRAP-анализа. В подгруппах пациентов с эритроцитурией и без нее значимых различий в АТ в моче (р=0,3) и в ткани (р=0,464) не выявлено. Проведенный анализ показал отсутствие связи между этими параметрами и как следствие – отсутствие значимого влияния элементов крови в осадке мочи на результаты TRAP-анализа. Таким образом, образцы мочи с высоким содержанием крови не обязательно исключать из исследования.
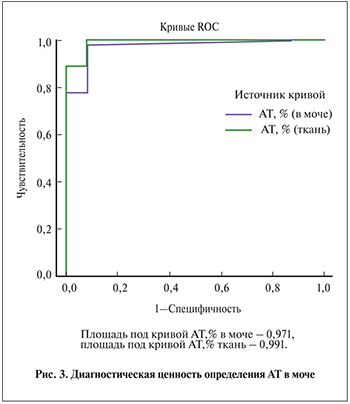
Для оценки диагностической ценности оценки АТ в моче при разработке неинвазивной диагностики РМП был проведен ROC-анализ с определением чувствительности и специфичности. В качестве контрольной группы были выбраны 12 пациентов с неонкологической патологией мочевого пузыря – циститом. Была построена характеристическая кривая и рассчитана площадь под кривой (AUC), позволяющая определить предсказательную способность теста (рис. 3).
Обсуждение. Активность теломеразы была обнаружена во всех образцах опухолевой ткани (100%) и большинстве (93,75%) клеточных материалов мочи пациентов с различной стадией РМП.
Показатели чувствительности и специфичности разрабатываемого в данном исследовании метода превосходят аналогичные параметры цитологического исследования мочи, которое применяется в настоящее время как неинвазивный тест при диагностике РМП. Таким образом, исследование АТ может быть внедрено в практику и способно заменить низкочувствительное цитологическое исследование.
Также установлено повышение уровня АТ в моче и ткани по мере снижения степени дифференцировки опухоли, что говорит о возможности прогнозирования течения заболевания на основании уровня АТ у данной группы пациентов.
Для разработки методики неинвазивной диагностики рака мочевого пузыря был проведен анализ АТ в образцах опухолевой ткани и клеточном материале мочи пациентов неизотопным методом TRAP (telomerase repeat amplification protocol). Данные, полученные нами, показывают возможность проведения неинвазивной диагностики РМП с использованием неизотопного метода TRAP (telomerase repeat amplification protocol).
Заключение. В ходе настоящего исследования подтверждено положение о том, что теломераза напрямую связана с процессами злокачественной трансформации клеток мочевого пузыря. АТ была обнаружена в большинстве образцов клеточного материала мочи, полученных от пациентов с РМП в предоперационном периоде. Отсутствие АТ в трех образцах клеточного материала мочи с исследуемой онкопатологией, вероятнее всего, связано с инактивакцией теломеразы ингибиторами, содержащимися в клеточном материале мочи. АТ в образцах опухолевой ткани, полученной от пациентов в РМП, была обнаружена во всех образцах.
На основании полученных данных следует отметить, что диагностический и прогностический потенциал теломеразы достаточно велик, но требует дальнейшего исследования с привлечением большего числа больных, а также увеличения периода наблюдения за ними.



