Введение. Роль стрессовых факторов в патогенезе многих заболеваний человека в настоящее время ни у кого не вызывает сомнений [1, 2]. Патофизиологическими посредниками влияния острого (в том числе операционного) стресса на системный и органный метаболизм являются медиаторы вегетативной нервной системы – биогенные амины [3–6]. Изучение их обмена в ткани предстательной железы больных по понятным причинам невозможно, поэтому экспериментальные модели острого стресса у лабораторных животных могут представлять уникальные данные о начальных патофизиологических изменениях в ткани предстательной железы, которые сопутствуют острому стрессу и, очевидно, могут быть триггером ее дальнейших повреждений – сначала функционального, а затем и органического характера [7, 9–11]. Роль стресса в механизмах нарушения простатического органного метаболизма в настоящее время продолжает активно изучаться, хотя еще в конце XX в. описаны так называемые стресс-простатиты [12]. Экспериментальное моделирование позволит получить новые сведения о роли нейрогуморальных факторов в патогенезе заболеваний предстательной железы у человека, являющихся актуальной и достаточно дискутабельной проблемой современной урологии, и это может стать теоретической базой для клинического прорыва в указанном направлении.
Цель исследования – изучить влияние острого операционного стресса на обмен биогенных аминов
в ткани предстательной железы и плазменный уровень тестостерона в эксперименте на лабораторных
животных.
Материалы и методы. В качестве лабораторной модели операционного стресса была выбрана нефрэктомия. Этот вариант органоуносящих оперативных вмешательств по-прежнему находится в
арсенале хирургов-урологов и нередко выполняется при раке или травме почки, а также симультанно при тяжелых сочетанных повреждениях органов брюшной полости и забрюшинного пространства.
Исследования выполнены на 100 белых беспородных крысах-самцах массой 180–200 г. Поскольку
клиницист имеет дело с весьма неоднородной популяцией людей, больший интерес представляют беспородные животные, имеющие более широкую, чем линейные, норму реакции. Это позволяет с большой точностью экстраполировать результаты эксперимента на человеческую популяцию.
С лабораторными животными работали в соответ ствии с действующими Правилами проведения работ
с использованием экспериментальных животных и Международными рекомендациями по проведению
медико-биологических исследований с использованием животных (1985). Все животные находились в
одинаковых условиях обитания (древесная подстилка из опилок и стружки, температура в помещении
22–24⁰С, 12-часовой режим смены освещения) и кормления (стандартный брикетированный корм). Все
опытные животные были разделены на две группы. Семидесяти крысам основной группы была выполнена нефрэктомия (модель острого операционного стресса). Тридцать животных составили контрольную группу. Операцию нефрэктомии проводили под нембуталовым наркозом (40 мг/кг внутрибрюшинно), удаляли левую почку без надпочечника в условиях стерильности. После нефрэктомии операционную рану зашивали послойно и обрабатывали.
В обеих группах животным определяли уровень тестостерона в крови и уровень основных биогенных аминов (адреналин, норадреналин, серотонин, дофамин, гистамин) в ткани предстательной железы
перед операцией, на 7-е, 16 и 30-е сут после моделирования острого операционного стресса.
Анализ данных исследования проводили с помощью набора статистических стандартных программ Excell, XP SP2 и Statistica for Window v.6.0. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых межгрупповых различий) принимали равным 0,05. Статистически значимым для всех показателей считался критерий достоверности p<0,05. Исследования проводили в течение 1 мес (1 мес жизни лабораторных крыс соответствует примерно 1 году жизни человека).
Результаты. В ходе экспериментального моделирования острого операционного стресса выявлены нарушения обмена биогенных аминов как в крови испытуемых животных, так и в ткани предстательной железы, которые протекали на фоне снижения уровня эндогенного тестостерона, что свидетельствовало об ухудшении функционального состояния яичек и, соответственно, тестикулярного стероидогенеза (рис. 1).
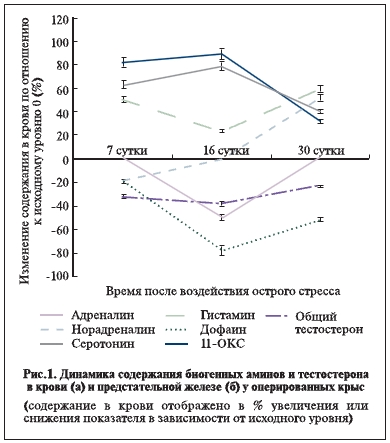
Установлено, что к 7-му дню эксперимента уровень адреналина в крови у животных основной группы повышался на 52%, но затем снижался на 50% от нормы и к концу наблюдения соответствовал норме
(p<0,05).
Динамика содержания норадреналина была иной: на 7-е сутки после острого стресса его уровень в
крови несущественно снизился на 18% от исходного, а затем постепенно увеличивался на 25 и
52% соответственно к 16-му и 30-му дню наблюдения (p<0,05). Таким образом, в целом динамика
содержания основных сосудосуживающих биогенных аминов в крови отличалась превалированием
их физиологического эффекта в организме, о чем свидетельствовало также снижение “дофаминового”
показателя основной группы животных.
На протяжении всего эксперимента в крови у оперативных животных наблюдалось достоверное и стойкое повышение уровней серотонина и гистамина, что свидетельствовало о глубоких нарушениях микроциркуляторного русла в условиях острого стресса.
Одновременно на протяжении всего эксперимента у них наблюдалась повышенная функциональная
активность коры надпочечников, что, с одной стороны, можно рассматривать как ответную реакцию
симпатоадреналовой системы на воздействие стресса, с другой – как фактор потенцирования негативного влияния избытка катехоламинов (в частности, норадреналина) на сосудистую стенку и системную гемодинамику в целом.
Вместе с тем в системном кровотоке наблюдался абсолютный дефицит сосудорасширяющих факторов, одним из которых является дофамин.
В ходе исследования были выявлены существенные нарушения обмена биогенных аминов непосредственно в ткани предстательной железы, часть из которых носила транзиторный характер, а некоторые отличались длительностью и выраженностью негативного эффекта на простатическую гемодинамику. Именно биогенные амины являются одним из посредников влияния различных гуморальных факторов на кровоснабжение и метаболизм предстательной железы (рис. 2).
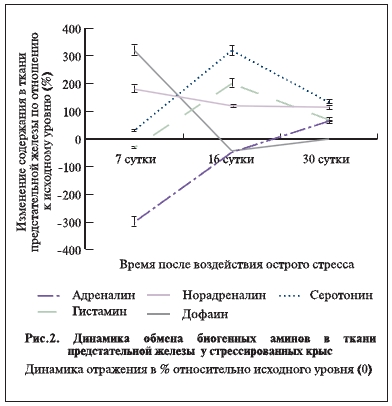
После воздействия острого стресса в предстательной железе животных к 7-му дню эксперимента
уровень адреналина падал в 3,2 раза, затем несколько повышался к 16-му дню (+60% к 7 дню, но -48% – к контролю) и выраженно возрастал на 65% к окончанию эксперимента (p<0,05).
Концентрация норадреналина в предстательной железе у оперативных животных в 1,8 раза повышалась на 7-й день после воздействия острого стресса, а затем до конца эксперимента стабилизировалась на повышенном уровне (+15–20% относительно контроля (p<0,05).
Уровень дофамина на 7-й день резко увеличивался в 3,2 раза, затем резко снижался к 16-му дню (-81%
по сравнению с 7-м днем и -43% – с контролем) и нормализовался к 30-му дню.
Начиная с 16-х суток эксперимента и вплоть до его завершения в предстательной железе у животных
основной группы, подвергшихся стрессу, отмечались достоверно более низкие значения “дофаминового” показателя по сравнению с группой контроля (p<0,05).
Наряду с указанными изменениями в предстательной железе животных основной группы наблюдались
существенные нарушения обмена гистамина – так называемые качели: его уровень к 7-му дню достоверно падал на 31%, затем к 16-му дню в 2 раза поднимался и оставался достоверно высоким (+69% по отношению к контролю) до окончания эксперимента (p<0,05). Кроме того, отмечались значимые изменения обмена серотонина. На 7-й день его уровень повышался на 31%, затем к 16-му дню резко увеличивался в 3,2 раза и оставался достоверно более высоким (+132%) до завершения исследования (p<0,05).
Обсуждение. В ходе проведенной работы установлено, что в течение 30 сут после воздействия острого стресса в ткани предстательной железы оперированных крыс наблюдался выраженный медиаторный дисбаланс. Повышение уровня адреналина, норадреналина, гистамина и серотонина, а также снижение “дофаминового” показателя свидетельствовали о преобладании в ткани предстательной железы сосудосуживающих реакций, способных приводить к нарушению гемодинамики с последующими ишемией и гипоксией органа. Очевидно, что при запредельном остром стрессе воздействия или на фоне стресса меньшей выраженности, но более длительного по времени
воздействия (например, при хроническом стрессе) следует ожидать более глубоких и стойких нарушений метаболизма в предстательной железе, что в конечном итоге способствует развитию в ней стойкого патологического процесса.
Проведенное экспериментальное исследование подтвердило выраженное ингибирующее действие острого стресса на синтез и секрецию тестостерона у самцов крыс. На протяжении всего эксперимента
наблюдался абсолютный гипогонадизм (от -32% от исходного уровня общего тестостерона крови на 7-е сутки эксперимента до -23% к его окончанию). Это свидетельствует о грубых нарушениях тестикулярного стероидогенеза, обусловленных превалированием влияния сосудосуживающих эффектов над сосудорасширяющими. С учетом одной из основных функций тестостерона – обеспечение андрогензависимого процесса синтеза оксида азота (NO) в сосудистой стенке и нервных окончаниях (основной вазодилататор) – можно предположить, что острый стресс-индуцированный андрогенный дефицит являлся как отражением негативных сосудосуживающих эффектов стресса на системный и местный кровоток и стероидогенез, так и причиной прогрессирования вазоконстрикторных патологических реакций в этих условиях. Подобные изменения в клинике могут обусловливать формирование “порочного круга” патогенеза заболеваний предстательной железы (в частности, при синдроме хронической тазовой боли [хроническом простатите] – СХТБ/ХП).
В ходе эксперимента были также выявлены существенные сдвиги в биохимизме основных медиаторов
вегетативной нервной системы, которые с учетом выявленной динамики каждого из них по отдельности и всех в целом могут играть роль триггеров и посредников патофизиологических реакций стрессового, вазоконстрикторного и дисциркуляторного характера, ведущих к нарушениям органной трофики и метаболизма предстательной железы. Они сопровождаются выраженным и стойким угнетением стероидогенеза в яичках с уменьшением выработки тестостерона уже на 7-е сут после начала воздействия острого стресса, а развивающийся при этом функциональный гипогонадизм сохранялся вплоть до 30-х сут эксперимента.
Обобщая полученные собственные данные и данные литературы последних лет, мы предлагаем следующую патогенетическую схему влияния острого стресса на органный метаболизм предстательной железы (рис. 3).
Рисунок 3. Общие звенья гипотетического патогенеза заболеваний предстательной железы.
Заключение. Острый операционный стресс играет существенную патофизиологическую роль в нарушениях системного гомеостаза, закономерно приводящих к органным и тканевым нарушениям, в частности, в яичках и ткани предстательной железы. Можно предполагать, учитывая андрогензависимость простаты и обнаруженные в ходе эксперимента в ее ткани патологические медиаторные реакции с активным участием разнонаправленно действующих биогенных аминов, что в ряде случаев именно стресс является триггером запуска патологических процессов, которые могут быть доклиническими стадиями многих заболеваний предстательной железы, прежде всего конгестивновоспалительного характера. Сохраняясь и накапливаясь, особенно при повторяющихся стрессовых реакциях, они на фоне интермиттирующего андрогенного стрессиндуцированного дефицита тестостерона являются той патофизиологической основой, на которой впоследствии развивается весь драматизм клинического течения заболеваний предстательной железы. Выявленные нарушения гормонально-медиаторного обмена следует активно внедрять в концепцию современного патогенеза заболеваний простаты, что позволит по-иному посмотреть на эту группу актуальных и по-прежнему дискутабельных урологических заболеваний. Очевиден факт, что прорыв в вопросах ранней диагностики и патогенетического лечения заболевания предстательной железы сегодня возможен лишь с позиций междисциплинарности и полиэтиологичности, а без экспериментальных исследований прогресс клинической лечебной и профилактической урологии скорее всего невозможен.



