Введение. Как отмечал Л. И. Дунаевский [1], основываясь на данных литературы, исходным пунктом аденомы является не простата, а рудиментарные железы простатической части уретры, называемые периуретральными. Поиск рациональных методов лечения аденомы периуретральных желез ведется более 120 лет. Предложены различные методы консервативного, медикаментозного и оперативного лечения. В настоящее время «золотым» стандартом оперативного лечения принято считать трансуретральную электрорезекцию (ТУР) простаты. Несмотря на то что существует много различных методов лечения аденомы периуретральных желез, надлобковая чреспузырная аденомэктомия остается наиболее распространенным и радикальным методом лечения пациентов, страдающих аденомой периуретральных желез. Однако в определении тактики оперативного лечения имеются противоречивые высказывания. Так, например, большинство клиницистов завершают надлобковую чреспузырную аденомэктомию эпицистостомией, полагая, что это обеспечивает профилактику послеоперационных воспалительных и обструктивных осложнений [2–4].
Общеизвестно, что эпицистостома не является методом профилактики гнойно-воспалительных и обструктивных послеоперационных осложнений чреспузырной аденомэктомии. Поэтому считаем, что стремление урологов к завершению чреспузырной надлобковой аденомэктомии глухим швом мочевого пузыря вполне оправданно, так как это позволяет в кратчайшие сроки восстанавливать накопительную и эвакуаторную функцию мочевого пузыря и обеспечивает профилактику воспалительных осложнений.
Важным условием успеха операции является надежность гемостаза ложа аденомы периуретральных желез. Предложены различные методики гемостаза, основными из которых помимо тампонады ложа марлевыми тампонами являются поперечное или продольное ушивание шейки мочевого пузыря. Некоторые клиницисты применяют съемные гемостатические лигатуры в различных модификациях. Однако преимущества таких методов гемостаза теряются в связи с завершением аденомэктомии надлобковым дренированием мочевого пузыря, что не позволяет достигать восстановления раннего мочеиспускания и тем самым обеспечивать профилактику воспалительных осложнений со стороны органов мочеполовой системы.
Целью клинического исследования являлось определение возможности расширения показаний к первичному глухому шву мочевого пузыря, обеспечивающему раннее восстановление уретрального мочеиспускания после надлобковой чреспузырной аденомэктомии.
Материалы и методы. Проанализированы результаты лечения 524 больных, подвергнутых одномоментной и двухэтапной надлобковой чреспузырной аденомэктомии с первичным и отсроченным глухим швом мочевого пузыря после различных методов гемостаза ложа аденомы периуретральных желез. Возраст пациентов колебался в пределах от 60 до 80 лет. Чаще (83,8%) оперативное лечение выполнялось больным старше 60 лет.
 Стадию заболевания устанавливали на основании клинических проявлений в соответствии с классификацией Гюйона и с учетом выраженности симптомов по шкале IPSS. Из 524 госпитализированных 110 больных поступили в клинику с эпицистостомой, наложенной в отделениях неотложной хирургии, 83 – с острой задержкой мочеиспускания, возникшей в первые три года с момента заболевания.
Стадию заболевания устанавливали на основании клинических проявлений в соответствии с классификацией Гюйона и с учетом выраженности симптомов по шкале IPSS. Из 524 госпитализированных 110 больных поступили в клинику с эпицистостомой, наложенной в отделениях неотложной хирургии, 83 – с острой задержкой мочеиспускания, возникшей в первые три года с момента заболевания.
Среди воспалительных осложнений аденомы периуретральных желез хронический простатит диагностирован у 25% пациентов, хронический пиелонефрит – у 25,2%, цистит – у 20,9%. Эти осложнения выявлялись преимущественно у пациентов, поступавших в клинику с надлобковым мочепузырным свищом, камнями мочевого пузыря. Из 149 больных с хронической почечной недостаточностью двусторонняя эктазия мочеточников диагностирована у 50 человек, односторонняя – у 99. Нарушения уродинамики верхних мочевыводящих путей были признаками хронического пиелонефрита у 25,2% больных.
Методика операции. Под спинномозговым обезболиванием после дренирования семявыносящих протоков и трансуретрального пересечения уретры выше семенного бугорка у верхушки удаляемой аденомы общепринятым нижнесрединным доступом вскрывали полость мочевого пузыря. Рассекали слизистую над аденомой по методу Чайка, производили вылущение аденомы без повреждения остающейся части простатического отдела уретры. После удаления аденомы ложе промывали горячим раствором фурацилина и в течение 2–3 мин тампонировали марлевым тампоном. В последующем на заднюю и две боковые губы шейки мочевого пузыря накладывали 3 гемостастатические съемные кетгутовые лигатуры, которые выводили через наружное отверстие уретры рядом с постоянным уретральным катетером. Натяжение лигатур осуществляли соответствующим по массе грузом. Через 18–24 ч натяжение лигатур устраняли, а в отсутствие интенсивной гематурии удаляли. В течение первых суток по дренажу семявыносящего протока в ложе аденомы подводили капельно раствор аминокапроновой кислоты с целью уменьшения послеоперационной гематурии. В последующем этот дренаж в течение 2–3 дней использовали для орошения раствором антибиотиков ложа удаленной аденомы с целью профилактики воспалительных осложнений со стороны органов мошонки. Одномоментную надлобковую чреспузырную аденомэктомию завершали наложением двухрядного глухого шва мочевого пузыря. Первый ряд выполняли двумя полукисетными швами, второй – двумя Z-образными кетгутовыми швами. В предпузырное пространство устанавливали резиновый выпускник. Операционную рану ушивали послойно. Накладывали повязку.
Материал для гистологического исследования из ложа удаленной аденомы забирался по общепринятой методике во время контрольной цистоскопии. Цистоскопия при нормальном течении послеоперационного периода выполнялась отдельным больным с целью изучения состояния слизистой мочевого пузыря и определения сроков эпителизации ложа после аденомэктомии на этапе проведения соответствующих научных исследований.
Результаты и обсуждение. Установлено, что заживление ложа аденомы периуретральных желез происходит путем заполнения ее грануляционной тканью и последующей эпителизацией. Наши исследования показали, что в случаях воспаления ложа аденомы и гнойного расплавления грануляций, нередко отмечающегося при эпицистостомии и ушивании шейки мочевого пузыря, процесс заживления протекает длительно путем репаративного воспаления с последующим формированием грубой рубцовой ткани, обусловливающим развитие обструктивных осложнений. В связи с этим важное значение приобретает использование преимуществ одномоментной аденомэктомии с глухим швом мочевого пузыря и при выполнении двухэтапной чреспузырной аденомэктомии.
После троакарной эпицистостомии надлобковая чреспузырная аденомэктомия в техническом плане не отличается от одномоментной чреспузырной аденомэктомии с глухим швом мочевого пузыря. Гемостатические лигатуры в послеоперационном периоде удаляли также к концу первых суток, а постоянный катетер – на 3–4-й день от момента операции. Однако при выполнении аденомэктомии больным, подвергнутым открытой эпицистостомии, имелись некоторые технические особенности операции в связи с обширными рубцовыми изменениями тканей в зоне эпицистостомы. В этих случаях мочевой пузырь вскрывали без иссечения рубцов. Выполняли аденомэктомию. Накладывали съемные гемостатические лигатуры, а для достижения герметичности мочевого пузыря в послеоперационном периоде использовали два восьмиобразных шва, накладываемых предварительно на края разреза мочевого пузыря и операционной раны. Концы нитей фиксировали на коже в зоне операционной раны на марлевом шарике. После удаления надлобкового дренажа предварительно наложенный восьмиобразный шов мочевого пузыря затягивали над операционной раной. Герметичность мочевого пузыря проверяли путем наполнения его раствором фурацилина в объеме 150 мл.
Восьмиобразный отсроченный съемный глухой шов мочевого пузыря целесообразно использовать, во-первых, при невозможности наложения первичного глухого шва, при гемостазе ложа аденомы марлевыми тампонами и при необходимости завершения аденомэктомии временной эпицистостомией с целью контроля надежности гемостаза ложа аденомы. Во-вторых, при выраженных послеоперационных рубцовых изменениях тканей области эпицистостомы и операционной раны, когда подкожная клетчатка, апоневроз, прямые мышцы живота, предпузырная клетчатка и передняя стенка мочевого пузыря представляют собой единый конгломерат, являющийся следствием мочевых затеков. Радикальное иссечение рубцово измененных тканей при надлобковой аденомэктомии таит опасность развития послеоперационной вентральной грыжи, в последующем требующей проведения пластической операции. Важное значение в профилактике послеоперационных воспалительных осложнений имеют сроки восстановления уродинамики верхних и нижних мочевыводящих путей. Нами установлено, что после одномоментной надлобковой чреспузырной аденомэктомии с первичным глухим швом мочевого пузыря нормализация анатомофункционального состояния мочеточников наступает среди 80,2% больных в сроки до 2 нед. После двухэтапной аденомэктомии с вторично отсроченным глухим швом мочевого пузыря нормализация сократительной деятельности мочеточников происходила в те же сроки у 68,9%. У всех больных с восстановленной уродинамикой верхних мочевыводящих путей мочеиспускание по уретре осуществлялось самостоятельно на 2–4-е сутки после операции.
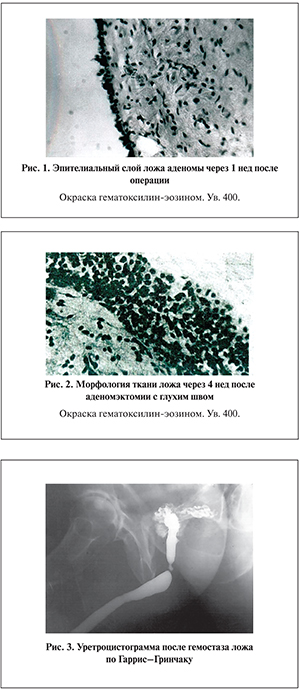
Раннее восстановление физиологических принципов мочеиспускания обеспечивает эпителизацию ложа аденомы без выраженных в нем воспалительных проявлений (рис. 1, 2).
Таким образом, важное значение в профилактике нарушений уродинамики верхних мочевыводящих путей, а следовательно, и воспалительных осложнений приобретают сроки нормализации накопительной и эвакуаторной функций мочевого пузыря. При послеоперационной обструкции в области пузырноуретрального сегмента (рис. 3), что часто наблюдается при гемостазе ложа аденомы путем сшивания противоположных краев шейки мочевого пузыря, нормализация уродинамики затягивалась до устранения обструкции (1,5–2,0 мес).
Обследование 12 пациентов после аденомэктомии с гемостазом ложа по Гаррис–Гринчаку, обратившихся с обструктивной симптоматикой через 3–6 мес после операции, подтвердило наличие обструкции в пузырно-уретральном сегменте, а снижение показателей скорости мочеиспускания определило показания к ТУР-коррекции шейки мочевого пузыря. Показатели урофлоуметрии, выполненные до и после ТУР шейки мочевого пузыря, представлены в таблице.
Положительная динамика всех показателей, представленных в таблице, убедительно подтверждает эффективность проведенного эндоскопического вмешательства, ставшего оптимальным патогенетическим методом лечения в подобной ситуации.

Продолжительность послеоперационного периода после одномоментной аденомэктомии с глухим швом мочевого пузыря колебалась в пределах 7–10 дней. К этому сроку мочеиспускание осуществлялось широкой струей, ирритативная симптоматика отсутствовала, остаточной мочи по данным УЗИ не было. Объем мочеиспускания достигал 197±8,5 мл, максимальная скорость мочеиспускания (Qmax) – 22,25±1,4 мл/с, средняя скорость мочеиспускания (Qср) – 15,48±2,7 мл/с, время мочеиспускания – 17,7±1,2 с. Частота мочеиспускания составляла 5–6 раз в дневное время.
Таким образом, раннее восстановление мочеиспускания после аденомэктомии обеспечивает нормализацию физиологической деятельности мочевыводящих путей, что является важным условием профилактики воспалительных осложнений со стороны почек и мочевыводящих путей.
Воспалительные осложнения после операции чреспузырной аденомэктомии с глухим швом мочевого пузыря и гемостазом ложа аденомы съемными гемостатическими лигатурами имели место лишь у 1,34% пациентов. Незначительную частоту послеоперационных воспалительных осложнений мы объясняем ранним восстановлением акта физиологического мочеиспускания, так как при уретральном мочеиспускании происходит вторичное очищение ложа аденомы от раневого отделяемого, детрита, слизи, сгустков крови и микрофлоры. Это создает условия для нормального процесса эпителизации ложа аденомы и пузырно-уретрального сегмента. Проведенная отдельным больным цистоскопия на 7–10-е сутки после аденомэктомии с первичным глухим швом мочевого пузыря подтверждает, что данная методика операции, обеспечивая раннее уретральное мочеиспускание на 2–4-е сутки, способствует ликвидации цистита, диагностированного еще в предоперационном периоде, и дает представление о состоянии предпузыря. Цистограммы через 2 нед (рис. 4) и 6 мес (рис. 5) после аденомэктомии дают представления об этом.
Согласно нашим данным, поздние воспалительные осложнения характерны для пациентов, которым гемостаз ложа аденомы осуществлялся поперечными или продольными швами. Так, цистит имел место у 33% больных, а простатит – у 16%, оперированных по этой методике. Высокая частота поздних воспалительных и обструктивных осложнений связана с ушиванием ложа, длительным надлобковым и уретральным дренированием мочевого пузыря. В течение 2 мес после аденомэктомии это приводит к обструктивным осложнениям, выявленным нами у 75% больных. При применении же съемных гемостатических лигатур обструкции в области пузырноуретрального сегмента нами не отмечено. Это объясняется тем, что после удаления гемостатических лигатур края шейки мочевого пузыря не соприкасаются и не срастаются, т.е. ложе аденомы сообщается с полостью мочевого пузыря широким соустьем. У больных с вторичным и щелочным циститом раннее восстановление уретрального мочеиспускания за счет глухого шва мочевого пузыря является эффективным методом не только профилактики воспалительных осложнений, но и их лечения, что подтверждается данными цистоскопии, цистографии и уродинамическими показателями.
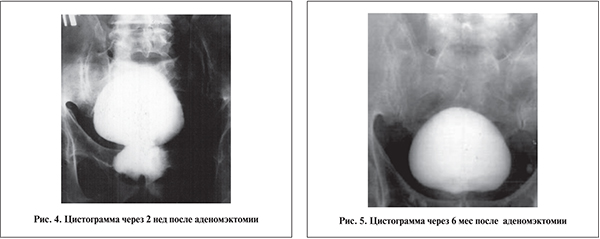
Заключение. Все вышеизложенное свидетельствует о возможности расширения показаний к операции аденомэктомии с глухим швом мочевого пузысгустков крови и микрофлоры. Это создает условия для нормального процесса эпителизации ложа аденомы и пузырно-уретрального сегмента. Проведенная отдельным больным цистоскопия на 7–10-е сутки после аденомэктомии с первичным глухим швом мочевого пузыря подтверждает, что данная методика операции, обеспечивая раннее уретральное мочеиспускание на 2–4-е сутки, способствует ликвидации цистита, диагностированного еще в предоперационном периоде, и дает представление о состоянии предпузыря. Цистограммы через 2 нед (рис. 4) и 6 мес (рис. 5) после аденомэктомии дают представления об этом.
Согласно нашим данным, поздние воспалительные осложнения характерны для пациентов, которым гемостаз ложа аденомы осуществлялся поперечными или продольными швами. Так, цистит имел место у 33% больных, а простатит – у 16%, оперированных по этой методике. Высокая частота поздних воспалительных и обструктивных осложнений связана с ушиванием ложа, длительным надлобковым и уретральным дренированием мочевого пузыря. В течение 2 мес после аденомэктомии это приводит к обструктивным осложнениям, выявленным нами у 75% больных. При применении же съемных гемостатических лигатур обструкции в области пузырноуретрального сегмента нами не отмечено. Это объясняется тем, что после удаления гемостатических лигатур края шейки мочевого пузыря не соприкасаются и не срастаются, т.е. ложе аденомы сообщается с полостью мочевого пузыря широким соустьем. У больных с вторичным и щелочным циститом раннее восстановление уретрального мочеиспускания за счет глухого шва мочевого пузыря является эффективным методом не только профилактики воспалительных осложнений, но и их лечения, что подтверждается данными цистоскопии, цистографии и уродинамическими показателями.
Заключение. Все вышеизложенное свидетельствует о возможности расширения показаний к операции аденомэктомии с глухим швом мочевого пузыря, которую следует считать «идеальным» методом радикального оперативного лечения аденомы периуретральных желез, обеспечивающим профилактику воспалительных и обструктивных осложнений, значительно улучшая результаты оперативного лечения. Своевременное выполнение операции способствует сохранению трудоспособности и улучшению качества жизни больных с аденомой периуретральных желез. Оптимальный срок дренирования мочевого пузыря по уретре катетером при этом составляет 2–4 дня.



