Радикальная простатэктомия (РПЭ) – широко используемая в мире операция, выполняемая пациентам с локализованной формой рака простаты. Однако осложнения данного вмешательства, к одним из которых относится нарушение эректильной функции различной степени выраженности, могут серьезно отразиться на качестве жизни пациента. С каждым годом увеличивается число относительно молодых мужчин, которым диагностируют рак простаты [1–3]. В связи с этим сохранение сексуальной функции и, соответственно, качества жизни приобретает все большее значение. Вместе с тем проводимые в мире исследования показывают, что частота развития эректильной дисфункции (ЭД) после РПЭ весьма высока и колеблется от 25 до 75% [3]. Известно, что сохранение нервно-васкулярных пучков во время операции служит основным условием успешного восстановления эректильной функции в послеоперационном периоде. При этом принципиальное значение имеет не столько операционный доступ (открытый или эндоскопический), сколько квалификация хирурга [4–6, 7–12].
Патогенез развития ЭД после РПЭ – многофакторный. Установлено, что повреждение кавернозных нервов во время операции вызывает апоптоз гладкомышечных клеток кавернозной ткани, усиливает в ней образование коллагена и развитие фиброза. Эти явления усугубляются нарушением оксигенации кавернозной ткани вследствие повреждения питающих ее артериальных сосудов [13–17].
Эректильная дисфункция развивается практически у всех пациентов немедленно после операции. Исчезают как спонтанные (ночные пенильные тумесценции, утренние эрекции), так и адекватные эрекции [18]. Некоторые пациенты отмечают возникновение эрекции в ответ на раздражение уретры катетером, однако эти случаи весьма редки и являются исключением. Как показали последние исследования, причиной столь внезапного нарушения эректильной функции после операции считается интраоперационная нейропраксия (травма нерва, ведущая к временному нарушению его проводимости) [19]. Роль возможного нарушения кровоснабжения кавернозной ткани изучена недостаточно. Процесс естественного восстановления эректильной функции после операции протекает исключительно медленно и продолжается в течение 18–24 мес [20]. Он заключается в постепенном восстановлении нервной проводимости, при этом могут появиться ночные пенильные тумесценции, а также адекватные эрекции.
В официальных руководствах, посвященных восстановлению эректильной функции у пациентов, перенесших РПЭ, обычно описываются методы коррекции ЭД, которые применяются поочередно или вместе в зависимости от достигнутого эффекта. При этом основной упор делается на сравнении эффективности того или иного метода лечения, механизмов их действия и т.д., стремлении достичь и поддержать у больного максимально выраженную эрекцию, что является конечной целью лечения.
В то же время, по мнению ряда авторов, проблема восстановления половой функции у таких пациентов должна рассматриваться намного шире. Выбирая стратегию лечения пациента, необходимо учитывать множество факторов, например возраст пациента, его половую конституцию, особенность сексуального поведения, уровень сексуальной мотивированности, семейное положение, наличие постоянной половой партнерши, сексуальную мотивированность партнерши, наличие сопутствующих заболеваний, влияющих на половую функцию пациента и/или ограничивающих спектр возможных методов восстановления эрекции, и т.д. [21]. Так, вероятно, не следует предлагать эндокавернозное протезирование пациенту с выраженными сопутствующими заболеваниями, имеющему минимальную сексуальную мотивацию.
В беседе с пациентом врачу следует обсудить вопросы о серьезности онкологического заболевания, сложности операции, вероятной степени нарушения половой функции после операции, подготовить пациента к возможному ухудшению эрекции после операции и необходимости ее коррекции. Очевидно, что ключевую роль играет стадия заболевания и возможность сохранения сосудисто-нервных пучков во время РПЭ. Однако, как показал ряд исследований, для достижения пациентом удовлетворенности свой половой функцией после операции более важно приведение в соответствие его ожиданий относительно эрекции до операции с реальным положением дел после нее. Так, широкое использование новых диагностических средств в оценке распространенности опухолевого процесса в простате (МРТ, гистосканирование и т.д.) позволяет еще до операции прогнозировать возможность сохранения сосудисто-нервных пучков с одной или двух сторон, о чем сообщается пациенту. Однако возможность выполнения РПЭ с сохранением сосудисто-нервных пучков с обеих сторон часто воспринимается больными как гарантия сохранения потенции в послеоперационном периоде на дооперационном уровне. В действительности восстановление эректильной функции часто возможно только в случае постоянного использования стимуляторов эрекции [22]. Таким образом, «управление ожиданиями» пациента – по сути единственно важное условие для помощи пациенту после операции.
Чтобы осуществить эту задачу, необходимы всесторонняя оценка состояния пациента в дооперационном периоде, а также подробное его консультирование с разъяснением всех вышеуказанных моментов. Очевидно, что эректильная функция после операции не может быть лучше изначального уровня. Поэтому, если пациент страдал ЭД и проходил лечение по этому поводу до операции, он должен быть готов к тому, что после операции ему придется перейти к более интенсивным методам (например, если он использовал ингибиторы фосфодиэстеразы 5-го типа [ФДЭ-5], после операции, вероятно, потребуется интракавернозное введение вазоактивных препаратов). Разумеется, для таких пациентов в предоперационной подготовке справедливы все рекомендации по диагностике, изложенные в соответствующих руководствах по лечению ЭД, например оценка гормонального профиля, уровня холестерина и липопротеидов низкой плотности, АД и т.д. По существу, восстановление эрекции после РПЭ – это лечение пациентов с ЭД смешанного генеза (нейрогенного, васкулогенного и психогенного). Отличием от обычной ситуации является только то, что эти изменения резко наступают в послеоперационном периоде.
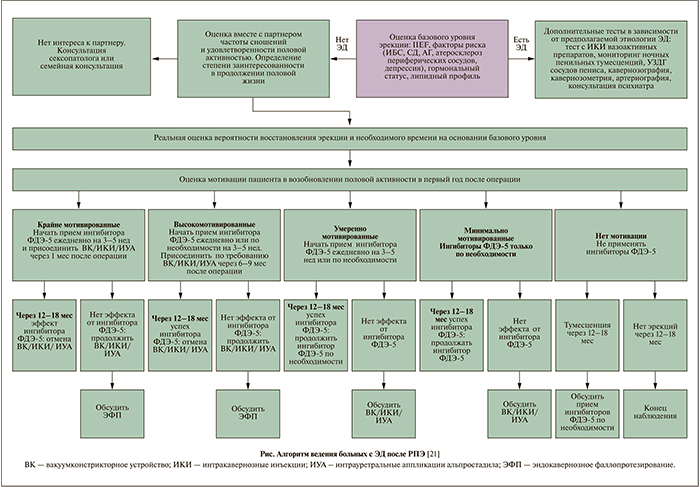
Для практического осуществления поставленной задачи предложен алгоритм действий (см. рисунок). Этот алгоритм разработан для пациентов, перенесших нерв-берегающую РПЭ, но также справедливо для пациентов, перенесших РПЭ по обычной методике, однако в этой ситуации прием ингибиторов ФДЭ-5 неэффективен.
Представленный алгоритм отражает использование общих методов коррекции ЭД. Вместе с тем в случае выявления на дооперационном этапе дополнительных факторов ЭД также необходимо их устранение (андрогензаместительная терапия в случае снижения уровня тестостерона плазмы, нормализация уровня глюкозы крови при сахарном диабете, лечение диабетической полинейропатии и васкулопатии, оптимизация антигипертензивной терапии, психотерапия в случае психогенной ЭД и т.д.). Более подробно рассмотрим особенности применения каждого метода коррекции ЭД после РПЭ.
Ингибиторы ФДЭ-5. Положительная роль применения стимуляторов эрекции после РПЭ известна давно. Однако с момента создания ингибиторов ФДЭ-5 возможность коррекции ЭД значительно увеличилась. Простота использования этих препаратов, высокая эффективность, хорошая переносимость были доказаны в ходе многочисленных исследований. Благодаря этим свойствам ингибиторы ФДЭ-5 на сегодня являются препаратами первой линии для восстановления эректильной функции у пациентов, перенесших РПЭ [11, 23, 24].
В эксперименте на животных было показано, что прием ингибиторов ФДЭ-5 способствует сохранению эндотелия и гладкомышечных волокон кавернозной ткани. Однако прямого подтверждения этих данных на примере человека пока не получено [25].
Изучение клинической эффективности различных ингибиторов ФДЭ-5 показало, в частности, что ежедневное использование в высокой дозе силденафила после РПЭ приводит к значительно более частому восстановлению эрекции по сравнению с плацебо у пациентов, не имевших эректильных нарушений до операции. Частота ответа на прием силденафила по результатам разных исследований колеблется от 35 до 75% у пациентов, перенесших РПЭ по нервсберегающей методике, и от 0 до 15% в случае, если нервные пучки не сохранялись [26–28].
Эффективность тадалафила и варденафила оценивали в режиме приема препарата по необходимости. Так, по результатам мультицентрового исследования в Европе и США был сделан вывод об улучшении эректильной функции после РПЭ, проведенной по нервсберегающей методике, при приеме 20 мг тадалафила в 71% случаев по сравнению с 24% при приеме плацебо. При этом частота удачных половых актов при приеме препарата составила 52 против 26% [29].
Другое мультицентровое рандомизированное плацебо-контролируемое исследование в отношении варденафила показало, что после РПЭ с сохранением сосудистонервных пучков с обеих сторон улучшение эрекции отмечено в 71 и 60% наблюдений при приеме соответственно 10 и 20 мг варденафила [30].
Единого мнения исследователей относительно наиболее эффективного ингибитора ФДЭ-5 в коррекции ЭД после радикальной простатэктомии до сих пор не сформировалось. Вероятной причиной служит сильная зависимость конечного результата от квалификации хирурга, возраста пациента и техники нервсберегающей операции [11].
Другой вопрос связан с регулярностью приема и дозой препаратов. Имеется две тенденции – ежедневный прием препарата (обычно в уменьшенных дозировках, например 5 мг тадалафила) или использование по необходимости. В настоящее время с учетом всех факторов, в том числе и фактора цены, некоторые авторы сходятся во мнении, что у пациентов, не имевших до РПЭ эректильной дисфункции (более 26 баллов в секции ЭД по шкале МИЭФ), прием ингибиторов ФДЭ-5 по необходимости предпочтительнее ежедневного приема [31].
В недавно завершившемся мультицентровом исследовании, проведенном с целью сравнить эффект приема тадалафила (5 мг ежедневно и 20 мг по потребности) на эректильную функцию пациентов, перенесших РПЭ по нервсберегающей методике, приняли участие 4023 пациента из 9 стран Европы и Канады – всего 50 центров [32]. В работе применен стандартный двойной слепой плацебо-контролируемый метод. Для исследования были отобраны пациенты моложе 68 лет, перенесшие операцию по поводу рака простаты (не более 7 по шкале Глисона) и не имевшие проблем с эрекцией до операции. Период лечения составил 9 мес с последующим перерывом в 6 нед и дальнейшим приемом препарата после раскрытия его состава. Первый прием препарата – через 6 нед после операции. Результаты исследования свидетельствовали о заметном преимуществе ежедневного приема тадалафила в дозе 5 мг по сравнению с приемом препарата по необходимости (20 мг) и плацебо в отношении количества удачно проведенных половых актов. Эта разница (около 10–18% по отношению к плацебо) стала очевидной к концу открытого периода исследования. Однако после окончания приема препарата статистически достоверного различия в состоянии эректильной функции у пациентов трех групп (тадалафил 5 мг ежедневно, 20 мг по потребности и плацебо) выявлено не было. Вместе с тем лишь в группе больных, принимавших тадалафил по 5 мг ежедневно, отмечено наименьшее сокращение длины полового члена к 9-му месяцу исследования (в среднем на 2,2 мм по сравнению с 7,9 мм [тадалафил 20 мг] и 6,3 мм [плацебо]). Поскольку уменьшение длины полового члена косвенно отражает дегенеративные изменения в кавернозной ткани после операции, авторы исследования пришли к выводу об обнадеживающих перспективах ежедневного приема тадалафила в дозе 5 мг с целью профилактики повреждения кавернозной ткани и восстановления эректильной функции у пациентов после РПЭ.
Следует отметить, что эффективность этих препаратов в ранний период после РПЭ обычно низкая. Причиной служит описанная выше итраоперационная нейропраксия. Однако отсутствие эффекта в первый год после операции не должно служить основанием к прекращению лечения, поскольку в процессе постепенного восстановления нервной проводимости в поврежденных нервных пучках (что может проявляться появлением ночных пенильных тумесценций) восстанавливается и чувствительность к ингибиторам ФДЭ-5. По некоторым данным, этот процесс может занимать от 1 до 3 лет [22].
С целью ускорения восстановления эректильной функции после РПЭ ряд авторов используют сочетание ингибиторов ФДЭ-5 с другими стимуляторами эрекции, в частности с интрауретральным или интракавернозным введением простагландина Е1 (ПГЕ1). Физиологическим обоснованием эффективности такого сочетания препаратов является следующий факт: расслабление гладкомышечной мускулатуры кавернозных тел и, таким образом, возникновение эрекции происходит при увеличении синтеза цАМФ (циклический аденозинмонофосфат) и цГМФ (циклический гуанозинмонофосфат) в кавернозной ткани. Простагландин Е1 усиливает синтез обоих этих медиаторов. Таким образом, при недостаточной эффективности монотерапии ингибиторами ФДЭ-5 их сочетание с ПГЕ1 может дать синергический эффект. Так, А. Nehra и соавт. [33] сообщили, что в группе из 28 пациентов, перенесших РПЭ и не ответивших на монотерапию отдельно ингибиторами ФДЭ-5 (100 мг силденафил) и внутриуретральным ПГЕ1 (мьюз 1000 мкг), комбинированное лечение с уменьшением дозы мьюз до 500 мкг через 30 мес обеспечило адекватную для коитуса эрекцию у всех 28 пациентов.
Следует отметить, что в некоторых наблюдениях с успехом использовались дозы ингибиторов ФДЭ-5, превышающие максимально рекомендуемые в два и более раз. Однако опасность развития побочных эффектов объясняет отсутствие крупных исследований на эту тему.
Вакуумконстрикторные устройства применяются в основном в сочетании с другими методами (ингибиторами ФДЭ-5). Эффективнсть как монотерапии после РПЭ до конца не установлена. При использовании пациентами с ЭД (неоперированных) эффект достигает 60–80%. Однако при длительном наблюдении примерно 50% пациентов прекращают его применение (большинство в течение первых трех месяцев лечения) [34]. Эффективность этого метода в поддержании эректильной функции после РПЭ не вполне ясна. Теория повышенной оксигенации кавернозной ткани в данном случае сомнительна, так как тумесценция происходит в основном благодаря венозной, малооксигенированной крови. Тем не менее ряд авторов указывают на хорошие результаты использования вакуумконстрикторных устройств после РПЭ. Рекомендуются ежедневные сеансы в течение 6–9 мес. Для использования в лечебной практике предпочтительны устройства с ограничителями давления [35].
Препараты для интракавернозных инъекций. Для использования сертифицирован только альпростадил. Однако применяются также комбинации с фентоламином и папаверином (триплекс) и папаверин+фентоламин (дуплекс), что дешевле и позволяет уменьшать побочные действия каждого препарата. Наиболее эффективным остается триплекс. Доза альпростадила, рекомендуемая для лечения ЭД после РПЭ, достигает 40 мкг. В раннем послеоперационном периоде обычно рекомендуется 3 инъекции в неделю (8–10 мкг), продолжительность курса составляет до нескольких месяцев [36, 37].
Интракавернозное фаллопротезирование обычно применяется для коррекции ЭД в последнюю очередь – в случае неэффективности оральных препаратов, интракавернозных инъекций, внутриуретральных препаратов ПГЕ1 и вакуумконстрикторных устройств. Исследования показали, что активную половую жизнь после РПЭ с последующим эндокавернозным фаллопротезированием ведут 70% пациентов и лишь 41% пациентов, использующих интракавернозные инъекции ПГЕ1.
Вместе с тем ряд авторов предлагают рассматривать эндокавернозное фаллопротезирование как первую лечебную опцию после РПЭ для пациентов, готовых вести активную половую жизнь после операции и не желающих зависеть от приема оральных медикаментов с их ненадежным и отсроченным эффектом [38].
Таким образом, восстановление эректильной функции у больных после РПЭ зависит от множества факторов, начиная от стадии заболевания и, следовательно, от возможности выполнения нервсберегающей операции и далее – от квалификации хирурга, состояния эректильной функции пациента до операции, сроков начала лечения, правильного подбора препаратов, мотивированности пациента в строгом соблюдении врачебных рекомендаций и т.д. Накопленный медицинским сообществом опыт позволяет пациенту вернуться к нормальной половой жизни в большинстве случаев. Однако этот процесс, как правило, занимает продолжительный период времени, требует тесного и доверительного взаимодействия с пациентом на протяжении всего периода реабилитации.