Введение. Размер полового члена традиционно очень важен для любого мужчины. Принимая во внимание историко-психологический аспект проблемы увеличения полового члена, становится неудивительным, что и в настоящее время многие мужчины придают ключевое значение именно размеру своего пениса [1, 2]. Размеры полового члена у мужчины в норме варьируются в очень широких пределах, что зависит от генетических, расово-этнических, гормональных и множества других факторов. Определение «микропенис» относится к понятию длины полового члена при растяжении, которое впервые ввели в своей работе Schonfeld и Beebe (1942) [3]. Эта длина характеризует размер полового члена при максимальном вытяжении за головку в неэрегированном состоянии. Для каждого возраста имеются свои показатели стандартной длины пениса (СДП) и стандартного отклонения (СО) [4]. Для взрослых мужчин нормальная длина полового члена, по мнению ряда экспертов, составляет не менее 12 см, а микропенис (микропения) определяется по формуле: СДП – 2,5 СО [4]. Таким образом, диагноз микропении для взрослых мужчин может быть поставлен в том случае, если длина не- эрегированного полового члена при максимальном его растяжении меньше популяционных средненормальных величин более чем на 2,5 сигмальных отклонения, что соответствует длине менее 10 см [5].
С клинической точки зрения различают изолированную микропению у мальчиков и мужчин с нормальным гормональным фоном (чаще всего как изолированный генетический дефект различных структурных компонентов кавернозных тел) и микропению как одну из клинических составляющих разнообразных врожденных симптомокомплексов, которых сегодня насчитывается более 20 [6–8]. Одной из причин малого размера полового члена может быть недостаточность синтеза и/или эффектов мужского полового гормона тестостерона и/или его активного метаболита 5α-дигидротестостерона, которая может быть врожденной или приобретенной до периода пубертата [9, 10]. Согласно мнению ряда экспертов, эффективная терапия микропениса у таких пациентов не может быть полноценной и патогенетической без активного выявления и ранней медикаментозной коррекции основной причины микропениса — дефицита тестостерона, отвечающего за формирование, развитие и рост мужских гениталий. При этом гормональная терапия микропении наиболее эффективна для мальчиков раннего возраста с врожденным гипогонадизмом, когда процесс формирования гениталий еще окончательно не завершен [11, 12]. В то же время целесообразность и эффективность гормональной терапии взрослых мужчин с уже сформировавшимися гениталиями препаратами тестостерона для лечения микропении, ассоциированной с гипогонадизмом, до сих пор остаются дискутабельной научно-практической проблемой [13]. Согласно единичным доступным аналитическим работам зарубежных авторов, эффективная коррекция микропении у взрослых мужчин независимо от ее этиологии может быть достигнута только путем хирургической фаллопластики, которая считается «золотым» стандартом лечения [14, 15]. Доступных же отечественных исследований высокого уровня доказательности по этой проблеме мы не нашли вовсе. Таким образом, проблема микропении у взрослых мужчин с гипогонадизмом далека от разрешения, эффективность и безопасность терапии мужчин с малыми размерами полового члена препаратами тестостерона практически не изучены.
Цель исследования. Оптимизировать консервативную терапию микропении у мужчин с гипогонадизмом за счет комбинации стандартной тракционной терапии с андрогензаместительной терапией (АЗТ) пролонгированным инъекционным препаратом тестостерона ундеканоата (небидо) и оценить безопасность АЗТ в отношении риска развития карциномы простаты при комбинированном лечении микропении обоими методами в течение 12 мес.
Материалы и методы. С 2010 по 2014 г. наблюдались и проходили лечение 16 мужчин с впервые установленным диагнозом «микропения», каждый из которых подписал информированное письменное согласие на обследование, лечение и использование их результатов в научных целях. Возраст пациентов колебался от 22 до 62 лет (средний возраст – 39,3±3,5 года). Ни один из пациентов ранее не имел сексуального опыта по причине малых размеров полового члена, никогда не подвергался комплексному обследованию для уточнения этиологических причин микропении и потому никакой гормональной терапии ранее не получал.
Стандартное обследование выполняли всем пациентам до начала терапии, а затем каждые 3 мес в течение 12 мес лечения. Оно включало осмотр пациентов, измерение длины полового члена в расслабленном состоянии при максимальном вытяжении и при эрекции, УЗИ предстательной железы (ПЖ), определение уровня общего простатспецифического антигена (ПСА) в крови, а также оценку андрогенного статуса, проведенную всем мужчинам в ходе настоящего исследования впервые в жизни. В каче- стве интегративного объективного маркера андрогенного статуса был выбран сывороточный уровень общего тестостерона, который определяли радиоиммунным методом в образце утренней венозной крови, взятой из локтевой вены. Референсными считали значения уровня общего тестостерона в крови 12,1–33 нмоль/л [16, 17]. Для уточнения формы гипогонадизма (первичный или вторичный) у всех больных исходно определяли уровень лютеинизирующего гормона (ЛГ) в утреннем образце венозной крови радиоиммунным методом (референсные значения – 1–10 мМЕ/мл) [16, 17]. Ультразвуковое исследование ПЖ выполняли по стандартной методике трансабдоминальным датчиком. Нормальным считали объем ПЖ 18–20 см3. Уровень общего ПСА в крови определяли стандартными методиками ИФА, за норму принимали показатели <4 нг/мл. Больных с содержанием общего ПСА выше 4 нг/мл в исследование не включали.
В качестве базовой консервативной терапии микропении у мужчин с гипогонадизмом применялась АЗТ пролонгированным препаратом тестостерона ундеканоата, к которому после получения первого достоверного клинического эффекта в виде увеличения длины полового члена присоединяли тракционную терапию пенильными экстендерами Penimaster Pro. Общая длительность лечения составила 12 мес.
Обработку и анализ результатов исследования проводили с использованием стандартных программ Statistica for Window v. 6.0. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых межгрупповых различий или факторных влияний) принимали равным p<0,05.
Результаты. До начала лечения длина полового члена у пациентов в состоянии максимального вытяжения колебалась от 4 до 8 см (в среднем 5,8±1,2 см), в состоянии эрекции она находилась в пределах от 5 до 9 см (в среднем 6,8±1,1 см). По данным УЗИ ПЖ во всех случаях отмечалась гипоплазия органа: объем ПЖ у всех пациентов не превышал 5 см3 (диапазон колебаний от 2 до 5 см3, средний объем – 3,4±1,2 см3). Таким образом, выявленные макроморфометриче- ские характеристики полового члена и предстательной железы у всех пациентов с микропенией являлись относительно гомогенными.
По данным гормонального обследования у всех 16 мужчин выявлен крайне низкий уровень общего тестостерона в крови — от 1,8 до 4,2 нмоль/л (в среднем 3,2±0,8 нмоль/л), что свидетельствовало о выраженном дефиците тестостерона (гипогонадизме). При этом уровень ЛГ у обследованных мужчин характеризовался разнонаправленными изменениями. У 10 (62,5%) пациентов уровень ЛГ крови оказался существенно выше нормы (13,0–25,5 мМЕ/мл), составив в среднем 18,5±2,4 мМЕ/мл, что соответ- ствовало гормональной характеристике первичного (гипергонадотропного) гипогонадизма. У 6 (37,5%) пациентов с микропенией и низким уровнем общего тестостерона крови уровень ЛГ оказался низким – 0,2–1,5 мМЕ/мл (среднее значение – 0,8±0,4 мМЕ/мл), что свидетельствовало о наличии у них вторичного (гипогонадотропного) гипогонадизма. Это позволило нам на первом этапе исследования предварительно распределить пациентов с микропенией по виду гипогонадизма.
Таким образом, за сравнительно однородными макроморфометрическими характеристиками пациентов с микропенией скрывались гетерогенные этио- логические гормональные факторы, прежде всего различные виды гипогонадизма, что поставило перед нами важную практическую задачу выбора патогенетического метода коррекции каждого вида выявленного дефицита тестостерона у пациентов с микропенией. Согласно общепринятой точке зрения, для коррекции первичного гипогонадизма следует применять заместительную терапию препаратами тестостерона [16, 17]. Такая терапия была назначена всем 10 пациентам с диагнозом микропении на фоне выявленного первичного гипогонадизма. Для коррекции вторичного гипогонадизма традиционно рекомендуется стимулирующая терапия препаратами человеческого хорионического гонадотропина (ЧХГ) при условии сохранения чувствительности тканей яичек к ЧХГ [16]. В связи с этим для определения чувствительности тканей яичек к ЧХГ всем 6 пациентам с микропенией на фоне вторичного гипогонадизма мы провели стандартный 3-дневный тест с ЧХГ, который рассматривается как ценный тест на сохранность функции клеток Лейдига яичек [18]. При хорошей резервной функции яичек уровень общего тестостерона в крови после 3-дневных инъекций 2000 МЕ ЧХГ должен увеличиваться на 50% и более от исходного уровня и превышать 12 нмоль/л, при более низких показателях пробной ЧХГ-стимуляции функция клеток Лейдига признается недостаточной и рекомендуется терапия препаратами тестостерона [19]. В нашем исследовании у всех мужчин с вторичным гипогонадизмом на фоне стимуляции ЧХГ уровень общего тестостерона крови через 3 дня вырос лишь до 8,3–9,6 нмоль/л (в среднем до 8,9±0,4 нмоль/л), что расценено нами как недостаточная чувствительность тканей яичек к ЧХГ, не позволившая рассчитывать на эффективную и полноценную ликвидацию дефицита тесто- стерона (гипогонадизма) как причины микропении. Руководствуясь полученными данными, в качестве базовой консервативной терапии для всех мужчин с микропенией на фоне как первичного, так и вторичного гипогонадизма был выбран пролонгированный инъекционный препарат тестостерона ундеканоата. Однократная доза составила 1000 мг. Препарат вводили внутримышечно. Вторая инъекция выполнялась через 6 нед после первой, третья и все последующие с периодичностью 1 раз в 12 нед.

Все мужчины были информированы о возможном обратимом угнетении сперматогенеза в течение всего периода терапии тестостерона ундеканоатом, однако каждый был заинтересован преимущественно в увеличении размеров полового члена, поэтому ни один не отказался от предложенного вида гормонального лечения.
Через 3 мес после начала терапии тестостерона ундеканоатом уровень общего тестостерона в плазме крови у всех пациентов повысился с 3,2±0,8 до 22,0± 3,2 нмоль/л (р<0,05), что свидетельствовало о полноценной лабораторной компенсации андрогенного дефицита у всех мужчин с микропенией. Однако существенной и достоверной динамики длины полового члена за истекший период достигнуто не было: длина полового члена в состоянии максимального вытяжения через 3 мес составила 6,0±0,5 см против 5,8±1,2 см до начала АЗТ (р<0,1), а в состоянии эрекции – 6,9±0,6 см против 6,8±1,1 см соответственно (p<0,1).
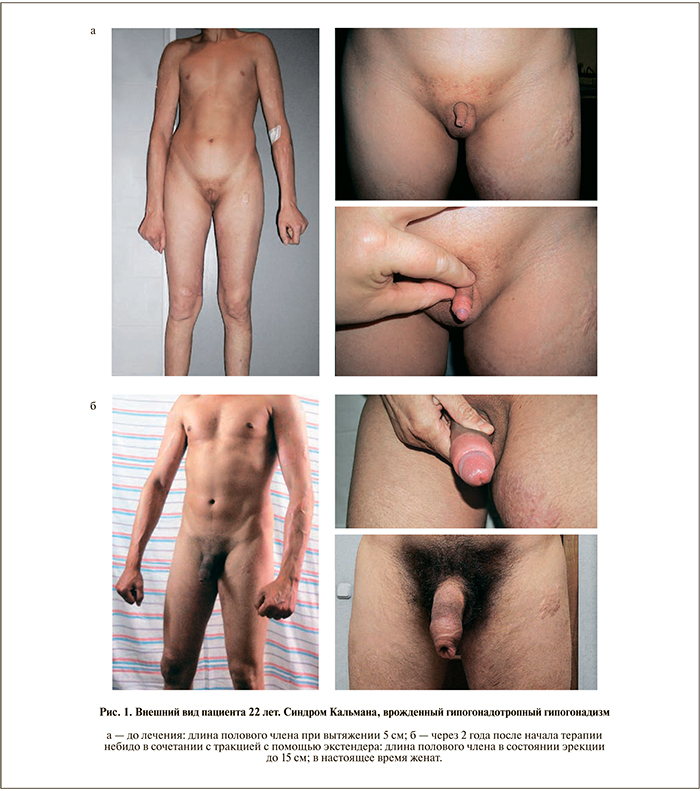
По прошествии 6 мес АЗТ на фоне сохраняющегося стабильного эугонадного статуса у всех мужчин (средний уровень общего тестостерона крови – 20,6±3,3 нмоль/л) длина полового члена при максимальном растяжении увеличилась с 6,0±0,5 до 8,3±1,2 см (р<0,05), а длина эрегированного полового члена – с 6,9±0,6 до 11,8±0,9 см соответ-ственно (р<0,05). Так как только к 6-му месяцу был достигнут первый достоверный клинический позитивный ответ структур полового члена на проводимую системную АЗТ, лечение пролонгированным тестостерона ундеканоатом для всех пациентов было дополнено использованием пенильных экстендеров в течение еще 6 мес. Отмечено дальнейшее увеличение длины полового члена, которая по окончании курса составила в вялом состоянии при максимальном растяжении 9,2±0,8 см, а в состоянии эрекции – 14,6±1,2 см, что статистически значимо выше исходных показателей (р<0,05) и практически соответствует нормальным размерам полового члена. Данный факт позволяет рассматривать результат такой терапии как удовлетворительный (рис. 1, 2).
На фоне терапии тестостерона ундеканоатом кон- статировали также нормализацию размеров гипо- плазированной ПЖ: по данным УЗИ ее объем за 12 мес терапии достоверно увеличился с 3,4±1,2 до 16,3±1,2 см3 (р<0,05). Одновременно с нормализацией объема предстательной железы имело место увеличение уровня общего ПСА в крови с исходного 0,72 ±0,03 до 1,4±0,05 нг/мл к концу лечения (р<0,05), что соответствовало референсным значениям данного показателя для здоровых мужчин.
Обсуждение. Стартовое назначение пролонгированной формы тестостерона ундеканоата уже через 3 мес АЗТ полностью ликвидирует лабораторный дефицит тестостерона у всех гипогонадных мужчин с микропенией, однако достоверное увеличение размеров полового члена у них отмечено только к 6-му месяцу терапии. За это время средняя длина полового члена в вялом состоянии при максимальном вытяжении увеличилась с исходных на 43% (р<0,05), а в состоянии эрекции – на 73% (р<0,05). Мы считаем, что стандартную тракционную терапию пенильными экстендерами мужчинам с гипогонадизмом и микропенией следует начинать только после ликвидации гормонального дефицита с помощью АЗТ и, согласно полученным данным, не ранее через 6 мес терапии тестостероном. Подтверждением служат результаты следующих 6 мес комбинированной терапии, в течение которых продолжалось увеличение длины полового члена, которая к 12-му месяцу увеличилась в вялом состоянии при максимальном растяжении на 58% от исходной, в состоянии эрекции – на 114% (р<0,05).
Терапия пролонгированным инъекционным препаратом тестостерона ундекаоната кроме достоверного положительного эффекта в отношении длины полового члена также продемонстрировала свою безопасность с точки зрения рисков развития карциномы предстательной железы, поскольку в течение всего периода лечения уровень общего ПСА крови не выходил за границы референсных значений для здоровых мужчин (0–4 нг/мл). К сожалению, мы не располагаем результатами иных аналогичных исследований взрослых мужчин, так как нами не обнаружено ни одного достоверного исследования подобного рода, поэтому сравнить собственные результаты терапии с таковыми других авторов на данном этапе не представляется возможным. По этой причине в рамках настоящей статьи мы ограничиваемся декларацией лишь собственного клинического опыта. Однако следует отметить, что единичные данные литературы свидетельствуют об эффективности заместительной гормональной терапии мальчиков с микропенией вследствие врожденного гипогонадизма и чем раньше начата гормональная терапия, тем больше шансов для достижения приемлемой длины полового члена [9, 12]. У взрослых мужчин результаты гормонзаместительной терапии микропении более скромные. Однако полученные нами данные позволяют сделать следующий вывод: чувствительность структур полового члена к тестостерону может сохраняться у мужчин с гипогонадизмом в течение всей жизни.
Заключение. У взрослых мужчин с микропенией нередко имеется длительно не диагностированный ранее гипогонадизм, который резко снижает эффективность традиционной консервативной (тракционной) терапии, наиболее часто назначаемой данной категории пациентов без учета их гормонального статуса. Всем взрослым мужчинам с впервые уставленным диагнозом микропении перед планированием любого вида лечения в обязательном порядке необходимо определять в крови как минимум уровень общего тестостерона и ЛГ для диагностики латентного гипогонадизма и его вида. Отказ от этой простой диагностической процедуры ведет к снижению эффективности негормональных консервативных методов коррекции микропении. При выявлении гипогонадизма у взрослых мужчин с микропенией назначение системной АЗТ патогенетически обосновано, эффективно и безопасно с точки зрения риска развития карциномы предстательной железы методом лечения, без которого ликвидация гипогонадизма как ключевого патогенетического звена микропении не представляется возможной. Начинать тракционную терапию с использованием пенильных экстендеров у мужчин с гипогонадизмом и микропенией целесообразно не ранее чем через 6 мес адекватной АЗТ, когда достигается ее первый значимый клинический эффект применительно к морфометрическим параметрам полового члена, и обязательно проводить на фоне продолжающейся АЗТ. Продолжительность комбинированной АЗТ и тракционной терапии в течение не менее 12 мес, по нашему мнению, оптимальна с точки зрения эффективности консервативной коррекции микропении для большинства гипогонадных мужчин с микропенией. Пролонгированные инъекционные формы тестостерона ундеканоата являются патогенетически обоснованными, эффективными и безопасными препаратами выбора коррекции гипогонадизма у взрослых мужчин с микропенией.



