Введение. Мужское бесплодие представляет собой одну из важнейших проблем современной андрологии. Приблизительно у 50% бездетных пар бесплодие обусловлено различными патологическими изменениями в мужской половой сфере [1, 2]. Фактор, усугубляющий эту проблему, заключается в следующем: в 25–75% случаев не удается выявить причину мужского бесплодия, т.е. констатируется так называемое идиопатическое бесплодие [3–7].
Относительно недавно выявленной предполагаемой причиной снижения фертильности у таких мужчин является фрагментация ДНК сперматозоидов – одно- или двухцепочечный разрыв молекул ДНК [8]. На существенное снижение фертильного потенциала мужчин при высоких показателях уровня фрагментации ДНК сперматозоидов указывают работы последних лет. Так, было показано, что при высокой степени фрагментации ДНК сперматозоидов вероятность беременности естественным способом снижается в 6,5–10,0, с помощью внутриматочной инсеминации – в 7,0–8,7 раза, экстракорпорального оплодотворения (ЭКО) – в 2 раза и интрацитоплазматической инъекции сперматозоида – в 1,5 раза относительно случаев с низкой степенью фрагментации ДНК [9, 10].
В настоящее время фрагментация ДНК сперматозоидов остается не до конца изученным вопросом и не установлены все причины, приводящие к фрагментации ДНК. Одной из теорий, объясняющих механизм возникновения фрагментации ДНК сперматозоидов, считают теорию оксидативного стресса. Согласно этой теории, активные формы кислорода (АФК) или свободные радикалы образуются в результате окислительного метаболизма для обеспечения процессов жизнедеятельности сперматозоидов (передвижение по мужскому и женскому половым путям, пенетрация ооцитов и т.д.). В норме генерация АФК в сперме контролируется семенными антиоксидантами. Патогенные эффекты АФК реализуются при их избыточном формировании, что, собственно, и представляет собой оксидативный стресс [11, 12].
Исходя из указанной корреляции снижения мужской фертильности и повышенных уровней фрагментации ДНК сперматозоидов и АФК в сперме, можно предположить, что коррекция последних станет эффективным методом лечения мужского бесплодия. Именно поэтому актуальным представляется изучить возможности гипербарической оксигенации (ГБО) по снижению уровня фрагментации ДНК сперматозоидов и АФК в сперме.
Материалы и методы. В исследование включены 90 мужчин с идиопатическим бесплодием. Пациентам основной группы (60 человек) перед процедурой ЭКО проведено лечение с помощью ГБО. В контрольной группе (30 человек) ЭКО выполнено без предшествовавшего курса ГБО. Возраст пациентов составил от 25 до 37 лет (медиана – 30,5 лет).
Гипербарическая оксигенация выполнена по стандартной методике на барокамере отечественного производства БЛКС-303 с использованием медицинского кислорода. Всего проведено 10 сеансов – по одному в день подряд в будние дни с перерывом в выходные дни. Продолжительность одного сеанса составляла 60 мин, из которых на компрессию отведено 5–10 мин, на изопрессию – 40, на декомпрессию – 10 мин. Режимы баротерапии установлены с учетом индивидуальной переносимости пациентом повышенного давления внутри камеры. Давление кислорода в режиме изопрессии в среднем составило 1,2–2 АТА.
Экстракорпоральное оплодотворение выполнено по стандартной методике: в основной группе – через 3 мес после окончания курса ГБО, в контрольной – через 3 мес после первичного обследования без проведения курса ГБО.
Исследование спермы в обеих группах проведено при первичном обследовании и через 3 мес после него. Оно включило оценку основных параметров спермограммы; определение уровня фрагментации ДНК сперматозоидов; измерение уровня АФК в сперме.
Спермограмма исследована в соответствии с требованиями руководства ВОЗ 5-го издания от 2010 г. [13]. Фрагментация ДНК сперматозоидов определена с помощью метода TUNEL, и в качестве верхней границы нормальных показателей уровня (степени) фрагментации ДНК сперматозоидов приняты 15%. Измерение уровня генерации АФК в эякуляте проведено методом хемилюминесценции. Уровень АФК в сперме выражен в мВ/с, а верхней границей нормы продукции АФК считали 0,64 мВ/с.
Статистическая обработка результатов осуществлена с помощью программы Statistica v. 17.0. При нормальном распределении показателей в выборке пациентов данные представляли в виде среднего со средним квадратическим отклонением (M±SD), при ненормальном – как медиану (Me) с интерквартильным размахом [Q25%; Q75%]. Сравнение основной и контрольной групп пациентов по нормально распределенным признакам проведено с помощью t-критерия Стьюдента, ненормально распределенным – U-критерия Манна–Уитни. Значимость динамики различных показателей спермы оценена с использованием метода Вилкоксона.
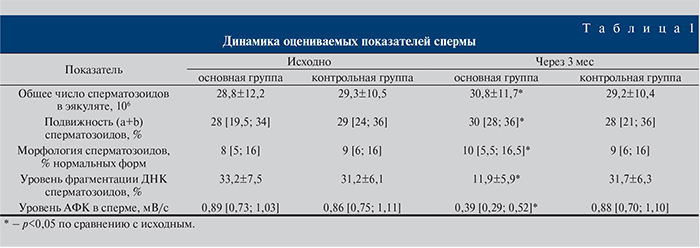
Результаты и обсуждение. При первичном обследовании общее число сперматозоидов в эякуляте в основной группе пациентов в среднем составило 28,8±12,2∙106, в контрольной – 29,3±10,5∙106; медиана показателей подвижности (a+b) сперматозоидов – 28 [19,5; 34] и 29 [24; 36]% соответственно; медиана числа сперматозоидов с нормальной формой – 8 [5; 16] и 9 [6; 16]% соответственно; среднее значение уровня фрагментации ДНК сперматозоидов – 33,2±7,5 и 31,2±6,1% соответственно; медиана уровня АФК в сперме – 0,89 [0,73; 1,03] и 0,86 [0,75; 1,11] мВ/с соответственно. При сравнении основной и контрольной групп пациентов по всем указанным показателям статистически значимых различий не обнаружено (p>0,05).

Как видно из табл. 1, ГБО способствовала достоверному улучшению всех показателей спермы через 3 мес. В контрольной группе таких положительных изменений не выявлено. Более того, по ряду показателей спермы в контрольной группе даже отмечена незначительная отрицательная динамика. Подтверждением положительного влияния ГБО стало увеличение случаев наступления беременности у половых партнерш мужчин, к которым применяли данный вид терапии. Если в основной группе пациентов результатом процедуры ЭКО после лечения с помощью ГБО стало наступление беременности у половых партнерш 63,3% (38/60) мужчин, то в контрольной группе – у 36,7% (11/30).
Полученные результаты позволяют считать, что основным фактором существенного улучшения фертильных возможностей мужчин стало снижение уровней фрагментации ДНК сперматозоидов и АФК в сперме до пороговых значений, а не небольшие положительные изменения параметров спермограммы. Доказательством тому служат следующие положения. Средние значения таких параметров спермограммы, как общее количество и подвижность сперматозоидов, несмотря на их положительную динамику, оставались ниже нормального уровня, т.е. все еще соответствовали критериям олиго- и астенозооспермии. Что касается показателя нормальных форм сперматозоидов, то его медиана и до лечения находилась в рамках нормативных значений. Таким образом, после курса ГБО спермограмма по своим основным параметрам в целом осталась на прежнем уровне с точки зрения фертильного потенциала. В отличие от этого динамика показателей уровней фрагментации ДНК сперматозоидов и АФК в сперме имела совершенно другой размах. Во-первых, как было указано выше, их средние значения достигли нормального уровня. Во-вторых, значительно уменьшилась доля пациентов с тяжелой степенью (более 30%) фрагментации ДНК. Если до лечения такие мужчины составляли 65% (39/60), то после курса ГБО – 3,3% (2/60) (табл. 2). В-третьих, среди пациентов основной группы до применения сеансов ГБО уровень АФК в сперме соответствовал норме только у 15% (9/60) человек, а после – у 95% (57/60).
В подтверждение того, что фрагментацию ДНК сперматозоидов можно рассматривать как самостоятельную меру оценки функции сперматозоидов и этот критерий имеет более высокую предсказательную ценность относительно фертильности мужчины, чем традиционные параметры спермы, можно привести следующие данные. Так, в ряде исследований показано, что 25–40% мужчин с нормальными показателями спермограммы имеют бесплодие вследствие повышенного индекса фрагментации ДНК, который составляет более 20–30% [14–17].
Заключение. Таким образом, метод ГБО показал высокий потенциал в лечении мужчин с идиопатическим бесплодием, сочетающимся с высокими значениями уровней фрагментации ДНК сперматозоидов и АФК в сперме. Полученный результат, простота выполнения, относительная дешевизна и воспроизводимость методики могут рассматриваться как главные ее преимущества. Однако, поскольку в литературе не представлено других работ, посвященных оценке эффективности ГБО по преодолению неблагоприятных последствий оксидативного стресса для показателей спермы, представляется целесообразным продолжить исследование возможностей данного метода. Отмеченные положительные стороны ГБО позволяют выразить надежду, что после продолжения соответствующих исследований в этой области данный метод займет одно их ведущих мест в арсенале методов лечения мужского бесплодия.



