Введение. Инициированный Национальным институтом здоровья США исследовательский проект «Human microbiome project» (2008–2012) во многом расширил существующие представления о микробном спектре различных биотопов человеческого организма, в том числе органов мочевыделительной и половой систем.
Как известно, урогенитальный тракт является сложной экосистемой, подверженной постоянным колебаниям (даже суточным) в ответ на различные экзогенные и эндогенные раздражители [1]. При этом микробный спектр влагалища имеет особое значение в предотвращении его колонизации патогенными микроорганизмами, в том числе передающимися половым путем и вызывающими инфекции мочевыводящих путей [2, 3].
В периоды мено- и постменопаузы в условиях эстрогендефицита pH влагалища становится нейтральным, количество лакто- и бифидобактерий снижается, облигатно-анаэробных бактерий, напротив, повышается [4].
Фундаментальные исследования по микробиому влагалища женщин показали существенные различия, связанные с возрастом и этнической принадлежностью [5, 6]. Верификация 16S рРНК бактерий выявила 265 видов микроорганизмов во влагалище [5, 7]. Среди них Lactobacillus spp. играют важнейшую роль в функционировании данного биотопа [8, 9]. Установлено также, что количество лактобацилл во влагалище оказывает влияние на формирование микробиоценоза в целом, характерного для каждой возрастной группы, что необходимо учитывать при интерпретации результатов исследования (бактериологического и/или ПЦР) и решении вопроса о целесообразности коррекции [10]. Однако микробиота влагалища в целом в постменопаузе остается недоизученной.
Вместе с тем изучение микробиоты мочи здоровых женщин в постменопаузе также является краеугольным камнем в понимании этиологической структуры инфекций мочевыводящих путей. Это приобретает особое значение в свете новых данных о микрофлоре мочи здоровых женщин детородного возраста [11] и работ по изучению микробиома мочи с обнаружением в данном биотопе 45 родов различных микроорганизмов с доминированием анаэробных [12].
Цель: изучить микробиоту влагалища и мочи условно здоровых женщин, находящихся в постменопаузе.
Материалы и методы. Обследованы 20 условно здоровых женщин, находившихся в постменопаузе (52–65 лет). Средний возраст обследуемых составил 59,0±2,1 года. Длительность климактерия более 8 лет.

Критерии включения в исследование: отсутствие генитальной патологии; отсутствие менструаций в течение 5 и более лет; пролапса гениталий и урологических заболеваний, дизурии, инфекций, передающихся половым путем, отсутствие гормональной, антибактериальной терапии, использования антисептических средств в течение 1 мес до начала исследования; наличие матки; роды в анамнезе (не менее 2); отсутствие самопроизвольного прерывания беременности на ранних и поздних сроках; согласие пациентки на участие в исследовании.
Критерии исключения: наличие тяжелой экстрагенитальной патологии, отказ женщины от участия в исследовании.
Всем женщинам проведены ПЦР и бактериологическое исследование средней порции утренней мочи, а также бактериоскопическое и бактериологическое исследование вагинальной микрофлоры. Материал забирали в соответствии с МУ 4.2.2039-05 (2006).
После соответствующей гигиенической процедуры образцы мочи собирал специально обученный медицинский персонал при самостоятельном мочеиспускании обследуемых. Образцом для бактериологического исследования и ПЦР была средняя порция утренней мочи, отобранная в стерильный одноразовый контейнер (Sterile Uricol, «HiMedia»). Пробы кодировали идентификационным номером и разделяли на 2 аликвоты для бактериологического исследования и ПЦР. Отделяемое заднего свода влагалища для бактериологического исследования забирали стерильным тампоном Сopan innovation (Италия). В работе были использованы питательные среды фирмы «HiMedia» (Индия). С целью выявления факультативно-анаэробных бактерий (ФАБ) применяли MacConkey Agar, HiCrome Candida Differential Agar, HiCrome Enterococci Agar, HiCrome Aureus Agar Base, Mannitol Salt Agar, Streptococcus Selective Agar, Blood Agar Base с добавлением бараньих эритроцитов. Для выделения неклостридиальных анаэробных бактерий (НАБ) использовали среды Блаурокка, Shedler Agar and Broth, Bacteroides Bile Esculin Agar, Bifidobacterium Agar and Broth, MRS Agar, Clostridial Agar. Бактериологическое исследование мочи и отделяемого из заднего свода влагалища осуществляли по методике В. В. Меньшикова [13] с использованием аэробной и анаэробной техники культивирования. Посевы инкубировали при температуре 37°C. Для создания анаэробиоза применяли AnaeroHiGas Pack с индикатором анаэробиоза (HiAnaero Indicator Tablet).
Идентификацию выделенных микроорганизмов осуществляли по морфологическим, тинкториальным, культуральным и биохимическим признакам с помощью энтеро-, стафило-, анаэротестов («Lachema», Чехия). Для окраски препаратов по Граму использовали стандартный набор Gram Stains-Kit («HiMedia», Индия).
ПЦР мочи проводили с использованием наборов реагентов Фемофлор-16 производства ООО «НПО ДНК-Технология» (Москва). Учет и интерпретацию результатов реакции осуществляли автоматически с помощью программного обеспечения, поставляемого с амплификатором, детектирующим ДТ-96, производства ООО «НПО ДНК-Технология».
Для кластеризации полученных результатов построены дендрограммы. Различия определяли на основе оценок концентраций бактерий и частоты обнаружения. Связанные измерения по частоте обнаружения отдельных микроорганизмов сравнивали с помощью теста Мак-Немара, концентрации микроорганизмов, выделенных из различных биотопов, – с помощью теста Вилкоксона. Оценку значимости различий между микробными паттернами проводили методом PERMANOVA, основанным на тестах перестановок для матрицы индексов Брея–Кертиса (Серенсена) [14]. Для построения дендрограммы использовали метод Варда (Евклидово расстояние) [15, 16]. Расчеты выполняли в среде статистической обработки и визуализации данных R (R Foundation for Statistical Computing, Вена, Австрия, ver 3.2).
Результаты. При бактериологическом исследовании во всех случаях в моче обнаружены НАБ (11 родов; табл. 1) с доминированием Peptostreptococcus spp., Megasphaera spp., Eubacterium spp., Propionibacterium spp., Peptococcus spp. Lactobacillus spp. выделяли из мочи редко (10%). В группе ФАБ в моче преобладали коагулазоотрицательные стафилококки (КОС) и Corynebacterium spp.
С помощью ПЦР в средней порции утренней мочи верифицировано 17 родов НАБ с доминированием Prevotella spp., Eubacterium spp., Porphiromonas spp.
В 50% случаев в моче обнаружены Megasphaera spp., Veillonella spp., Peptostreptococcus spp., Dialister spp. (см. табл. 1).
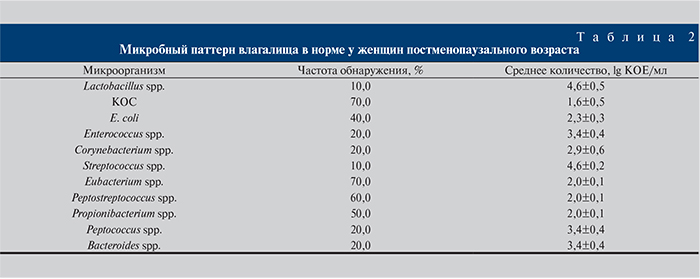
При микроскопическом исследовании содержимого заднего свода влагалища лейкоцитарная реакция (>5 лейкоцитов в поле зрения) отсутствовала. В ходе бактериологического исследования отделяемого влагалища основные симбионты генитального тракта — лактобациллы — выделены лишь в 10% случаев (табл. 2). Неклостридиальные анаэробные бактерии обнаружены у всех обследуемых и представлены 5 родами с преобладанием Eubacterium spp., Peptostreptococcus spp. и Propionibacterium spp.
Среди факультативно-анаэробных бактерий (ФАБ) во влагалище преобладали КОС. Из представителей семейства Enterobacteriaceae регистрировали только E. coli. С одинаковой частотой во влагалище женщин данной возрастной группы присутствовали Corynebacterium spp. и Enterococcus spp. (Enterococcus faecalis [15%] и E. faecium [5%]).
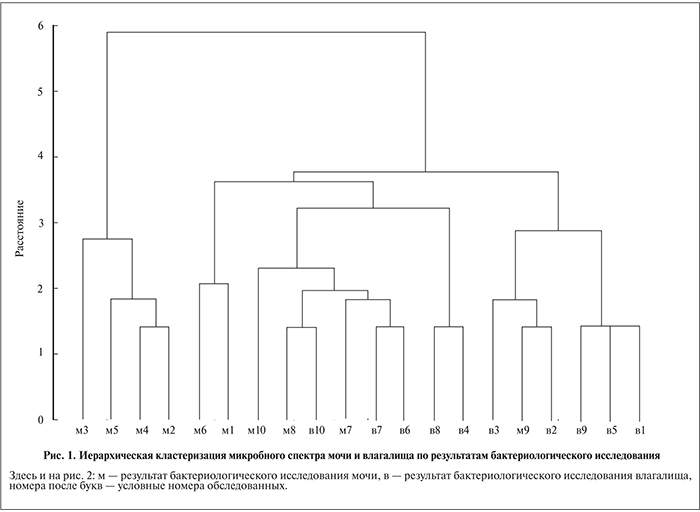
При проведении иерархической кластеризации результатов бактериологического исследования мочи и отделяемого влагалища по частоте выявления отдельных родов микроорганизмов определены слабые отличия (рис. 1).
Только у 4 обследованных обнаружен кластер микроорганизмов (м3–м2), характерный для мочи. В остальных же случаях отсутствовала кластерная специфичность, характерная для изучаемых биотопов. Сравнение частоты присутствия отдельных родов микроорганизмов в моче и влагалище с помощью теста Мак-Немара свидетельствовало также об отсутствии значимых различий, что подтверждается результатами многофакторного теста значимости (PERMANOVA: R2=0,10; p=0,089; полный набор перестановок).
Исключение составили лишь штаммы Megasphaera spp. (р=0,031), которые регистрировали исключительно в моче (во влагалище анализируемой выборки данные микроорганизмы отсутствовали).
Сравнение концентраций микроорганизмов в моче и влагалище показало, что группировка в кластеры не привязана ни к изучаемому биотопу, ни к конкретному пациенту (рис. 2).
На дендрограмме определяется небольшой кластер, состоящий из микробных паттернов влагалища четырех женщин, выявленных при бактериологическом исследовании (в3-в1), а также большой кластер (м6–в2), в котором данные по концентрации микроорганизмов мочи и влагалища не имели «привязки» к изучаемым биотопам.
При рассмотрении большого кластера (м6-в2) установлено, что в его подкластерах присутствует микрофлора обоих биотопов. Кроме того, результаты бактериологического исследования биотопов «моча–влагалище» одних и тех же женщин всегда попадали в разные кластеры. Кластерный анализ по концентрации микроорганизмов, выделенных из мочи и влагалища здоровых женщин изучаемой возрастной группы, количественных закономерностей не выявил. Исключение составил род Megasphaera spp. (p=0,028). Таким образом, различия в частоте обнаружения и концентрации бактерий в моче и влагалище в подавляющем большинстве случаев отсутствовали.
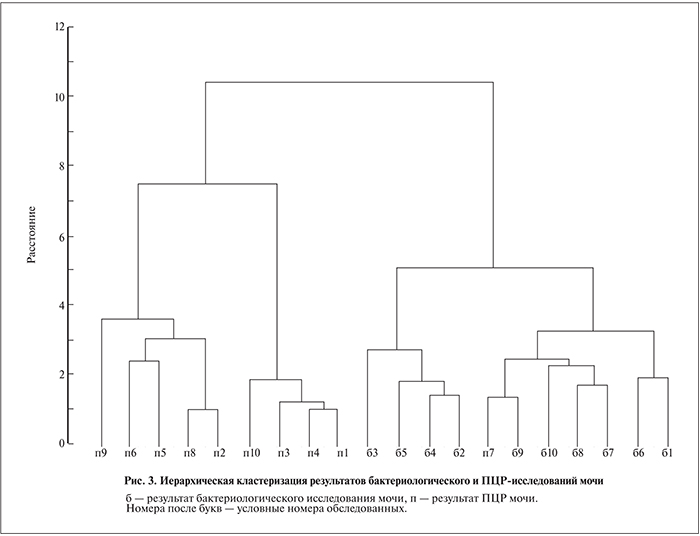
Бактериальные спектры в моче, определенные у одного человека с применением разных методик исследования (бактериология и ПЦР), отличались между собой больше, чем спектры, определенные у разных женщин при применении одной и той же методики (рис. 3).
Кластер с результатами ПЦР был четко отделен от такового с результатами бактериологии. Исключением стал случай под номером 7, в котором спектр микроорганизмов, определяемый двумя методами, различался незначительно. В целом доля микроорганизмов, идентичных в обоих исследованиях у одних и тех же женщин, максимально достигала 56% и в среднем составила 30%. Сравнение частоты встречаемости родов микроорганизмов в моче с помощью теста Мак-Немара позволило выявить достоверные (р<0,05) различия результатов, полученных с помощью разных методов. Бактериологическое исследование показало повышение частоты обнаружения КОС (р=0,008) и снижение изучаемого показателя для Gardnerella vaginalis (р=0,004), Enterococcus spp. (р=0,009), Prevotella spp. (р=0,008) и Porphiromonas spp. (р=0,008) по сравнению с ПЦР. Значимость различий между ПЦР и бактериологией была установлена и по результатам многофакторного теста значимости (PERMANOVA: R2=0,37; p=0,0019; полный набор перестановок). Таким образом, 37% вариаций в микробных паттернах, обнаруженных в моче обследуемых, приходятся на один тип исследования (ПЦР или бактериология).

Обсуждение. Полученные за последние 5 лет и вновь получаемые данные детальной расшифровки микробиоты и микробиома влагалища в основном касаются женщин репродуктивного возраста, так как именно для этих контингентов актуальны вопросы интерпретации «нормы» и бактериального вагиноза, а также цепь патоморфологических событий, связанных с последним [17, 18]. Микрофлору урогенитального тракта женщин постменопаузального возраста чаще рассматривают в контексте каких-либо гинекологических или урологических поражений. Результаты нашего пилотного исследования показали, что у женщин в постменопаузе Lactobacillus spp. регистрируют лишь в 10% во влагалище обследуемых, что соотносится с результатами L. Petricevic и соавт. [19]. По данным этих авторов, в постменопаузе во влагалище доминируют виды L. casei/paracasei и L. jensentii. Однако те же авторы, но уже в 2013 г. [20] пишут о превалировании во влагалищном биотопе у данной возрастной группы Lactobacillus delbrueckii group, что не противоречит данным, представленным ранее, а лишь свидетельствует о том, что влагалищный биотоп является динамичной системой.
Верификация в моче различных таксонов микроорганизмов в норме и определение их количественных характеристик необходимы для интерпретации результатов бактериологического исследования при инфекции мочевыводящих путей. Актуальность вопроса определяется тем, что более 1 млрд женщин в мире ежегодно страдают различными вариантами урогенитальных инфекций [21, 22]. В нашем исследовании по результатам бактериологического исследования и ПЦР в моче и влагалище доминируют Eubacterium spp., Peptostreptococcus spp. ПЦР показала высокую частоту обнаружения в моче Gardnerella vaginalis, Prevotella spp., Porphiromonas spp. (по 90%). Необходимо отметить, что паттерн верифицированных микроорганизмов в моче у женщин в постменопаузе гораздо шире, чем во влагалище. Однако результаты проведенного кластерного анализа по частоте обнаружения и концентрации выделенных из изучаемых биотопов микроорганизмов достоверных различий не выявили.
В группе ФАБ в моче, так же как и во влагалище, доминируют КОС. В моче чаще выделяли Enterococcus spp. и Corynebacterium spp. За исключением представителей семейства Enterobacteriaceae (104,5 КОЕ/мл), все микроорганизмы выделены из мочи в низких (<102 p="">
В ходе пилотного исследования выявлено преобладание во влагалище Eubacterium spp. (70%), Peptostreptococcus spp. (60%) и Propionibacterium spp. (50%). Высокая частота обнаружения НАБ объясняется тем, что с наступлением менопаузы уровень эстрогена уменьшается и микробные популяции, продуцирующие молочную кислоту, переходят к паттерну видов, который включает анаэробные и кишечные бактерии [23]. Удивительно то, что верифицированный в нашем исследовании паттерн влагалищной микрофлоры у российских женщин постменопаузального возраста подобен вагинальному сообществу, описанному в работе [23] для здоровых чернокожих женщин репродуктивного возраста Северной Америки, характеризующийся низкой долей Lactobacillus spp. и высокой частотой обнаружения Eubacterium spp., Peptostreptococcus spp., Funegoldia и других НАБ.
При интерпретации результатов бактериологического исследования и ПЦР мочи неизбежно возникает вопрос: какое исследование информативнее?
С одной стороны, с помощью ПЦР верифицировано 23 рода микроорганизмов, при бактериологическом исследовании – только 16, что в целом сопоставимо, но вызывает ряд вопросов. В частности, при бактериологическом исследовании в группе ФАБ чаще выявлены Enterococcus spp. и КОС, что может объясняться отсутствием при проведении ПЦР праймеров для энтерококков, а группа КОС столь обширна по своей таксономии, что даже гипотетически не может включить большинство ДНК этой группы микроорганизмов. Бесспорно, ПЦР более чувствительна для идентификации НАБ, особенно труднокультивируемых форм. С другой стороны, проведенный кластерный анализ по частоте встречаемости микроорганизмов при проведении двух методов исследования позволил выявить достоверные различия (р<0,01) лишь для 5 групп микроорганизмов (КОС, G. vaginalis, Enterococcus spp., Prevotella spp., Porphiromonas spp.).
В контексте сравнения двух методов – бактериологического и ПЦР – весьма интригующе выглядит, на наш взгляд, работа C. Mitchell и соавт. [24]. В Приложении к статье авторы приводят данные несоответствий результатов бактериологического исследования и ПЦР при исследовании отделяемого заднего свода влагалища. В комментариях к работе подробно описаны «подводные камни» при идентификации бактерий культуральным методом и ПЦР.
Наше пилотное исследование с небольшим объемом выборки, несмотря на доказанную достоверность результатов, бесспорно, ограничивает нас в глобальности выводов, которые можно экстраполировать на популяцию женщин в постменопаузе в целом. Оно носит поисковый характер, констатирующий конкретные параметры микробиоты мочи и влагалища у женщин, находящихся в постменопаузе. На наш взгляд, только всеобъемлющие исследования по изучению нормальной обсемененности различных биотопов человека могут стать точкой отсчета для дальнейших работ и дискуссий о проблемах нормоценоза, бактериального вагиноза и инфекций мочевыводящих путей.
Выводы
1. У здоровых женщин постменопаузального возраста в 90% случаев в моче и влагалище отсутствуют лактобактерии, но при этом доминируют коагулазоотрицательные стафилококки и неклостридиально-анаэробные бактерии.
2. Бактериальные паттерны мочи и влагалища у здоровых женщин, находящихся в постменопаузе, подобны. Различия состоят лишь в обнаружении в моче Megashaera, Veillonella, Prevotella, Mobiluncus, Fusobacterium и отсутствии данных родов бактерий во влагалище.
3. Концентрации одних и тех же микроорганизмов в моче и влагалище у каждого индивидуума достоверно не различаются.
4. Сравнение частоты обнаружения различных микроорганизмов в моче бактериологическим методом и ПЦР выявляет идентичность бактериального паттерна у 56% женщин и в 30% случаев для когорты в целом.
5. Подобие бактериальных паттернов мочи и влагалища у женщин в постменопаузе свидетельствует об их функциональной взаимосвязи и подтверждает представление об общности механизмов инфекционно-воспалительных поражений урогенитального тракта.



