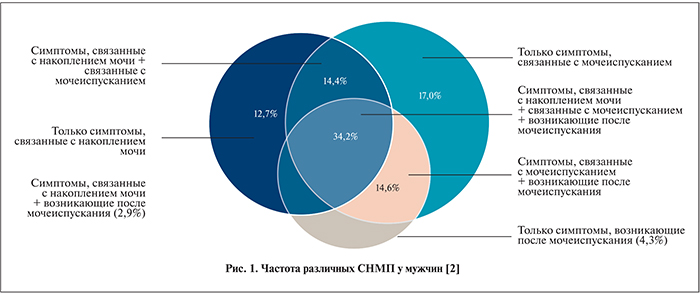
Для большинства пациентов расстройства мочеиспускания обусловлены как механическими, так и функциональными факторами. Хотя инфравезикальная обструкция (ИВО) вследствие доброкачественной гиперплазии предстательной железы (ДГПЖ) – наиболее частая причина расстройств мочеиспускания у пожилых мужчин, симптомы нижних мочевыводящих путей (СНМП) возможны и при других заболеваниях. Причиной развития симптомов наполнения и/или опорожнения могут стать нейрогенные нарушения, ятрогенные факторы и вмешательства на предстательной железе. Своевременное выявление уродинамических нарушений, в первую очередь ИВО и гиперактивности детрузора (ГД), у больных ДГПЖ имеет важное практическое значение, так как без учета этого фактора существенно ухудшаются функциональные результаты хирургического лечения. По данным [1], у 49% мужчин с СНМП выявляются симптомы как опорожнения, так и накопления. До 80% пациентов с выраженной формой ИВО имеют ГД, которая отмечается в 2 раза чаще, чем у пациентов без ИВО. У большинства мужчин с СНМП наблюдается комбинация симптомов различных типов. Результаты опроса EpiLUTS в США, Великобритании и Швеции [2] показали, что СНМП, связанные с накоплением мочи, опорожнением мочевого пузыря и возникающие после мочеиспускания у пациентов, часто наблюдаются одновременно (рис. 1). Около 49% мужчин с СНМП сообщили о наличии комбинации симптомов, связанных с накоплением мочи и опорожнением мочевого пузыря.
Согласно классической физиологической концепции, функция мочевого пузыря обеспечивается антагонистическим взаимодействием симпатического и парасимпатического отделов нервной системы. Рецепторы в области окончаний симпатических нервов мочевого пузыря и мочеиспускательного канала в зависимости от физиологических эффектов, возникающих при их стимуляции, разделяются на α- и β-адренорецепторы. Парасимпатическая нервная система представлена м-холинорецепторами. Гладкая мускулатура мочевого пузыря человека содержит смешанные популяции м2- и м3-подтипов холинорецепторов.
В адренергических синапсах передача возбуждения осуществляется посредством медиатора норадреналина.
В пределах периферической иннервации норадреналин принимает участие в передаче импульсов с адренергических (симпатических) нервов на эффекторные клетки. В ответ на нервные импульсы происходит высвобождение норадреналина в синаптическую щель с последующим взаимодействием его с адренорецепторами (АР) постсинаптической мембраны. Адренергические рецепторы находятся в ЦНС и на мембранах эффекторных клеток, иннервируемых постганглионарными симпатическими нервами. Антагонисты α1-АР (α-адреноблокаторы) – одни из самых эффективных препаратов для лечения пациентов с СНМП, вызванными ДГПЖ (СНМП/ДГПЖ). На основании анализа результатов лечения они были признаны Американской урологической ассоциацией препаратами выбора для терапии ДГПЖ [3].
Теория о существовании в симпатической автономной нервной системе двух классов АР, α и β, впервые была выдвинута в 1948 г. [4, 5]. В конце 1960-х гг. β-АР дополнительно разделили на два подтипа [6]. Уже в 1970-х гг. было высказано предположение, будто основным типом β-АР мочевого пузыря человека является третий тип β-АР (не-β1 или -β2) [7]. С конца XIX в. известно, что мочевой пузырь иннервируется как парасимпатической, так и симпатической автономной нервной системой [8]. В конце 1980-х гг. β3-АР были открыты и впервые обнаружены в жировой ткани, где, как было показано на моделях у животных, они участвовали в липолизе и терморегуляции [9]. Функциональная роль β3-АР в мочевом пузыре человека была подтверждена спустя 20 лет [10, 11]. Все три типа β-АР экспрессируются в мочевом пузыре человека, но 97% всех мРНК β-АР в мочевом пузыре относятся к подтипу β3-АР [12].
β-Адренорецепторы являются сопряженными с G-белком рецепторами норадреналина и адреналина – основных нейромедиаторов симпатической автономной нервной системы. В мочевом пузыре фаза наполнения цикла мочеиспускания регулируется прежде всего симпатической нервной системой [13]. Опорожнение мочевого пузыря, напротив, стимулируется высвобождением ацетилхолина в парасимпатических нервных окончаниях [14].
Наиболее часто применяемыми в урологической практике α-адреноблокаторами являются (оригинальные препараты) тамсулозин (Омник, Омник Окас), теразозин (Сетегис), доксазозин (Кардура), альфузозин (Дальфаз) и силодозин (Урорек) [15–18]. Многие непрямые сравнения между плацебо-контролируемыми исследованиями, так же как и не столь многочисленные прямые сравнительные исследования продемонстрировали одинаковую эффективность двух высокоселективных α1-адреноблокаторов (тамсулозин и силодозин) при использовании их адекватных дозировок [19]. С другой стороны, α1-адреноблокаторы отличаются переносимостью: селективный α1-адреноблокатор тамсулозин пациенты переносят лучше, чем другие α1-адреноблокаторы без подтиповой селективности, например доксазозин или теразозин [20], что особенно важно в отношении нежелательных явлений со стороны сердечно-сосудистой системы [21]. Селективная блокада α1A-АР может обеспечить эффективное лечение СНМП/ДГПЖ [22]. При наличии селективности в отношении α1A-АР препарат будет вызывать меньше побочных эффектов со стороны сердечно-сосудистой системы по сравнению с неселективным препаратом. Применение α1-адреноблокаторов в предоперационном периоде снижает риск острой задержки мочи. Так, ишурия была зарегистрирована у 2,6% пациентов, получавших α1-адреноблокатор перед и сразу после оперативного вмешательства, и у 19,2% пациентов, не получавших α1-адреноблокатор [23].
Поскольку ДГПЖ является возрастзависимым заболеванием, а у пожилых пациентов нередко выявляется артериальная гипертензия (АГ), возникает вопрос: возможно и целесообразно ли лечение ДГПЖ и АГ одним или разными препаратами? Пожилые пациенты гораздо чувствительнее к проявлениям блокады α-АР, и у них значительно выраженнее ортостатические жалобы по сравнению с более молодыми гипертониками. По данным исследования ALLHAT, примерно через 3,3 года непрерывное лечение доксазозином прекращается в связи с превышением по сравнению с диуретиком следующих показателей [24, 25]: на 25% – случаев «комбинированного» кардиоваскулярного заболевания, коронарной смерти, нефатального инфаркта миокарда, госпитализации по поводу стенокардии, в 2 раза – случаев сердечной недостаточности; на 20% – относительного риска инсульта; на 15% – случаев стенокардии.
Результаты ALLHAT убедительно доказывают, что монотерапия α-адреноблокаторами не оптимальна для пациентов с АГ и что лечение указанных двух состояний должно проводиться отдельно: сначала подбирается эффективный антигипертензивный препарат, а затем – высокоселективный α1-адреноблокатор с минимальным воздействием на сердечно-сосудистую систему.
 Гиперактивный мочевой пузырь (ГМП) присутствует у 52–80% мужчин с ИВО вследствие ДГПЖ, а у 38% мужчин с ИВО вследствие ДГПЖ симптомы ГМП сохраняются после оперативного устранения обструкции [26, 27]. По результатам нашей работы [28], ГМП выявляется у 46,9% пациентов после трансуретральных операций по поводу ИВО, а у 12,5% пациентов после операции продолжает иметь место динамический компонент ИВО. Cвоевременное определение характера дисфункций нижних мочевыводящих путей у больных ИВО имеет важное практическое значение, так как без учета этого фактора существенно ухудшаются функциональные результаты хирургического лечения.
Гиперактивный мочевой пузырь (ГМП) присутствует у 52–80% мужчин с ИВО вследствие ДГПЖ, а у 38% мужчин с ИВО вследствие ДГПЖ симптомы ГМП сохраняются после оперативного устранения обструкции [26, 27]. По результатам нашей работы [28], ГМП выявляется у 46,9% пациентов после трансуретральных операций по поводу ИВО, а у 12,5% пациентов после операции продолжает иметь место динамический компонент ИВО. Cвоевременное определение характера дисфункций нижних мочевыводящих путей у больных ИВО имеет важное практическое значение, так как без учета этого фактора существенно ухудшаются функциональные результаты хирургического лечения.
Зная побочные эффекты м-холиноблокаторов, целесообразно ли и безопасно ли применять м-холиноблокаторы больным ГМП при наличии ИВО вследствие ДГПЖ?
У больных ДГПЖ с симптомами ГМП после проведения оперативного лечения симптомы наполнения сохраняются достоверно реже при предоперационной терапии м-холиноблокатором, чем при лечении α1-адреноблокатором — 12,5% против 27,5 % [29].
Хорошая переносимость наиболее селективного м-холиноблокатора пациентами старшей возрастной группы – значимый момент в выборе именно данного препарата в лечении ургентных расстройств мочеиспускания, так как больные данной возрастной группы и без того отягощены сопутствующими заболеваниями, что осложняет прием препаратов с большим количеством побочных эффектов. Солифенацин избирательно блокирует М3-холинорецепторы. Он проявляет небольшую аффинность или вовсе не блокирует другие типы рецепторов. Основным недостатком антимускариновых препаратов является то, что они действуют на мускариновые рецепторы в других тканях, что обусловливает появление побочных эффектов. При взаимодействии данных препаратов с рецепторами слюнных желез возникает сухость во рту. В исследованиях на животных была проведена оценка силы взаимодействия различных антимускариновых препаратов с рецепторами мочевого пузыря и слюнной железы. Солифенацин продемонстрировал более высокую аффинность к рецепторам мочевого пузыря, чем к слюнным железам, по сравнению с другими антимускариновыми агентами, применяемыми для лечения ГМП (табл. 1). Так же как и α-адреноблокаторы, м-холиноблокаторы различаются по степени селективности в отношении воздействия именно на мочевой пузырь. Солифенацин более селективен, чем толтеродин и оксибутинин. Эта относительная селективность препарата по отношению к мочевому пузырю отражается в относительно низкой частоте возникновения сухости во рту при его применении, что в последующем было доказано в исследованиях [30], а также возможности длительной терапии без риска развития большого числа нежелательных реакций.
Кому показана комбинация α1-адреноблокатор+м-холинолитик?
Мужчинам с сочетанием ИВО и персистирующими симптомами ГМП, а также с низким риском возникновения острой задержки мочи [31]:
- клинически выраженная ИВО (5 мл/с< Qmax <15 li="">
- частота мочеиспусканий ≥8 за 24 ч;
- ургентные позывы ≥1 за 24 ч с ургентным недержанием мочи или без;
- ноктурия;
- суммарный балл IPSS ≥12;
- QL-качество жизни ≥3;
- объем остаточной мочи <200 li="">
- отсутствие острой задержки мочи в анамнезе.
По данным [32], мускариновые рецепторы играют не меньшую, чем α1-АР, роль в патогенезе СНМП/ДГПЖ. В той же работе показано, что мускариновые рецепторы концентрируются в передней капсуле и простатической уретре. Результатом исследования стала разработка новой схемы терапии СНМП/ДГПЖ комбинацией антагонистов α1-АР и антимуcкариновых препаратов. В руководстве Европейской ассоциации урологов содержатся рекомендации, согласно которым вышеуказанная комбинированная терапия может быть использована в лечении пациентов с умеренными или выраженными СНМП, если при монотерапии любым из указанных препаратов выраженность терапевтического эффекта была недостаточной [33].
Комбинированная терапия α1-адреноблокатором и м-холинобокатором показывает высокую терапевтическую эффективность у больных с ДГПЖ в сочетании с ГМП [34]. На фоне подобного лечения не выявлено существенного увеличения объема остаточной мочи, равно как и развития эпизодов острой задержки мочи [35–40].
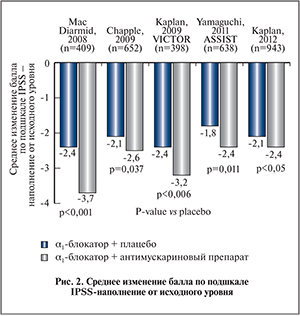
В нескольких исследованиях было показано, что добавление антимускаринового препарата к α1-адреноблокатору уменьшает выраженность симптомов, связанных с накоплением мочи, которые сохранялись после монотерапии α1-адреноблокатором. На рис. 2 представлены результаты, полученные в 5 12-недельных двойных слепых рандомизированных контролируемых исследованиях (РКИ) с участием мужчин в возрасте 40–50 лет и старше, у которых симптомы, связанные с накоплением мочи, сохранялись после 4 нед и более терапии α1-адреноблокатором [40–44]. Для оценки динамики СНМП, связанных с накоплением мочи, использовали соответствующую подшкалу IPSS (Международная шкала оценки симптомов со стороны предстательной железы). В 4 из 5 исследований симптомы, связанные с накоплением мочи, которые сохранялись после первичной терапии α1-адреноблокатором, статистически значимо улучшились после добавления антимускаринового препарата (рис. 2).

В другом исследовании было показано, что терапия первой линии с применением комбинации α1-адреноблокатора с антимускариновым препаратом может обеспечить быстрое облегчение симптомов у мужчин с причиняющими беспокойство симптомами наполнения и опорожнения [45]. В 12-недельном двойном слепом плацебо-контролируемом РКИ в участием 176 пациентов в возрасте 50 лет и старше с СНМП, связанными с мочеиспусканием, и умеренными или выраженными СНМП, связанными с накоплением мочи, были рандомизированы для терапии первой линии с применением α1-адреноблокатора и плацебо или α1-адреноблокатора в комбинации с антимускариновым препаратом. Как симптомы наполнения, так и качество жизни статистически значимо улучшились у мужчин, получавших комбинацию антимускаринового препарата с α1-адреноблокатором, по сравнению с мужчинами, получавшими плацебо и α1-адреноблокатор. В отношении улучшения симптомов опорожнения статистически значимых различий между группами выявлено не было [45].
Руководствуясь положительными результатами применения комбинированной терапии α1-адреноблокатором и м-холиноблокатором, был разработан новый препарат, Везомни (Vesomni), для лечения комплекса симптомов наполнения (ургентные позывы и учащенное мочеиспускание) и опорожнения у мужчин с ДГПЖ. Везомни 6 мг/0,4 мг является комбинацией антимускаринового препарата солифенацина и α1-адреноблокатора тамсулозина в лекарственной форме ОКАС. Каждая двухслойная таблетка содержит один слой солифенацина сукцината (6 мг), что соответствует 4,5 мг солифенацина, и один слой тамсулозина гидрохлорида (0,4 мг), что соответствует 0,37 мг тамсулозина.
Солифенацин подавляет гиперактивность детрузора и уменьшает симптомы, связанные с накоплением мочи. Тамсулозин ОКАС расслабляет гладкую мускулатуру предстательной железы, капсулы, простатической части мочеиспускательного канала и шейки мочевого пузыря, уменьшает в основном выраженность симптомов опорожнения и в меньшей степени – симптомов наполнения.
Использование комбинации солифенацина с тамсулозином в качестве двух отдельных препаратов также изучали в исследованиях фазы IV, в ходе которых оценивали динамику умеренных или выраженных симптомов наполнения (ургентные позывы, учащенное мочеиспускание) и опорожнения при СНМП/ДГПЖ у мужчин. К ним относятся американское исследование VICTOR и японское исследование ASSIST [40, 43]. Исследование VICTOR представляло собой многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование с участием 398 мужчин с СНМП, включая симптомы, связанные с накоплением мочи, которые сохранялись после 4 нед и более монотерапии тамсулозином 0,4 мг [40]. Сравнивали эффективность 12-недельной монотерапии тамсулозином 0,4 мг и комбинации солифенацина 5 мг и тамсулозина 0,4 мг (в качестве однокомпонентных препаратов). В исследовании ASSIST аналогичного дизайна, в котором приняли участие 638 пациентов с СНМП, включая симптомы, связанные с накоплением мочи, которые сохранялись после 6 нед и более монотерапии тамсулозином 0,2 мг [43]. В данной работе сравнивали эффективность 12-недельной монотерапии тамсулозином 0,2 мг и комбинации солифенацина (2,5 и 5 мг) и тамсулозина 0,2 мг в качестве однокомпонентных препаратов. Результаты обоих исследований показали, что при использовании солифенацина с тамсулозином наблюдалось статистически значимо более выраженное улучшение симптомов, связанных с накоплением мочи, по сравнению с монотерапией тамсулозином. Несмотря на то что в этих исследованиях не применяли препарат Везомни в таблетках и их дизайн отличался от такового исследований с применением указанного препарата, их результаты вносят вклад в доказательную базу эффективности комбинации солифенацина с тамсулозином в отношении улучшения умеренных и выраженных симптомов наполнения (ургентные позывы, учащенное мочеиспускание) и опорожнения на фоне ДГПЖ.
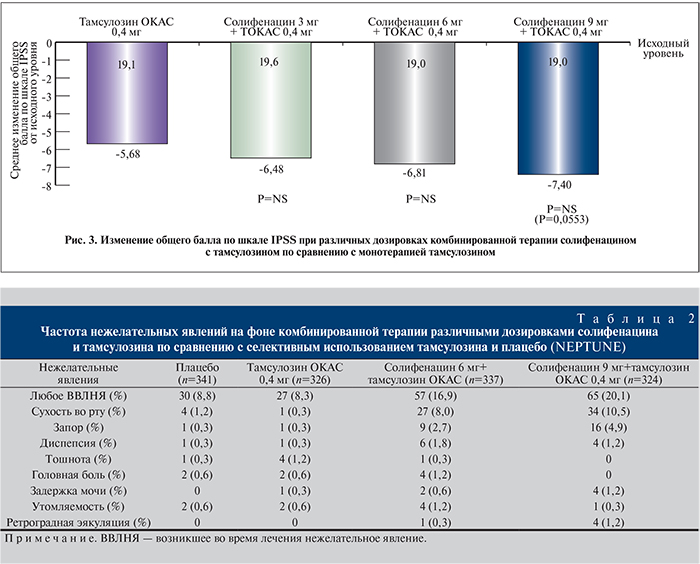
В исследовании фазы II с целью определения оптимальной дозы (SATURN) были оценены эффективность и безопасность применения комбинации солифенацина с тамсулозином ОКАС [46]. Данная комбинация обеспечивала большую эффективность по сравнению с монотерапией тамсулозином ОКАС и характеризовалась хорошей переносимостью в подгруппе мужчин с СНМП, связанными с накоплением мочи и опорожнением мочевого пузыря. В исследовании NEPTUNE определено наличие дополнительной пользы при применении комбинированного препарата солифенацина и тамсулозина ОКАС по сравнению с монотерапией тамсулозином ОКАС и плацебо при лечении на протяжении 12 нед мужчин с умеренными и тяжелыми симптомами, связанными с накоплением мочи и опорожнением [47]. Кроме того, эффективность и безопасность применения Везомни были оценены в подтверждающем исследовании фазы III (NEPTUNE) и в долгосрочном продолженном исследовании фазы III (NEPTUNE II) [48]. Исследование NEPTUNE II представляло собой открытое 40-недельное продолжение исследования NEPTUNE, разработанное для оценки долгосрочной безопасности и эффективности комбинации солифенацина 6 или 9 мг и тамсулозина ОКАС 0,4 мг у мужчин с СНМП/ДГПЖ, связанными с накоплением и опорожнением. В исследовании фазы III NEPTUNE было обнаружено, что комбинация солифенацина и тамсулозина ОКАС приносит дополнительную пользу по сравнению с монотерапией тамсулозином ОКАС и применением плацебо при лечении на протяжении 12 нед мужчин с умеренными и выраженными симптомами, связанными с накоплением мочи и опорожнением на фоне ДГПЖ. По данным исследования NEPTUNE, препарат Везомни значительно уменьшает ургентные позывы и частоту мочеиспусканий – на 84% по сравнению с плацебо, в то время как тамсулозин ОКАС менее эффективен в отношении данных симптомов (на 52% по сравнению с плацебо). На фоне приема Везомни и тамсулозина ОКАС значительно улучшается оценка по шкале IPSS по сравнению с плацебо – на 30 и 15% соответственно. По данным [48], улучшение общего числа баллов по шкалам IPSS и TUFS (Общая шкала оценки ургентных позывов и частоты мочеиспусканий) наблюдалось на протяжении 4 нед применения комбинации и сохранялось до 52 нед. Аналогичное улучшение наблюдалось и в отношении числа баллов по подшкалам, связанным с накоплением мочи и опорожнением, и для переменных из дневника мочеиспусканий. Качество жизни и беспокойство, причиняемое симптомами, характеризовались положительной динамикой при применении комбинации после 4 нед, причем достигнутый результат сохранялся до 52 нед. Большинство пациентов были удовлетворены как эффективностью, так и безопасностью лечения. При комбинированной терапии наблюдалось количественное улучшение общего числа баллов по шкале IPSS по сравнению с монотерапией тамсулозином ОКАС 0,4 мг, однако различия не были статистически значимыми (рис. 3). Таким образом, у мужчин с умеренными или выраженными симптомами наполнения (ургентные позывы и учащенное мочеиспускание) и опорожнения на фоне ДГПЖ применение Везомни устраняет симптомы, связанные с накоплением мочи, более значимо, чем монотерапия тамсулозином ОКАС, с достижением сопоставимой эффективности в отношении уменьшения симптомов опорожнения [47].
Комбинация солифенацина и тамсулозина показала себя положительно и в вопросах безопасности и переносимости (табл. 2).
По данным проведенных исследований:
- комбинированная терапия фиксированной дозой тамсулозина 0,4 мг+солифенацин 6 мг показала значимо лучший результат лечения по сравнению с плацебо, была более эффективной по сравнению с селективным использованием тамсулозина 0,4 мг в отношении симптомов наполнения и качества жизни у мужчин с СНМП (симптомы наполнения+симптомы опорожнения);
- комбинированная терапия с использованием высокой дозировки солифенацина (тамсулозин 0,4 мг+солифенацин 9 мг) не выявила дополнительных преимуществ по сравнению с более низкой дозировкой солифенацина;
- обе дозировки солифенацина (6 и 9 мг) при комбинированной терапии СНМП были хорошо переносимыми.
Таким образом, новый препарат Везомни является эффективным и безопасным средством для лечения комбинированных СНМП (затрагивающих фазы как наполнения мочевого пузыря, так и его опорожнения) у мужчин.



