Введение. В патогенезе большинства заболеваний важную роль играют иммунные механизмы [1, 2], не исключением являются урологические заболевания [3, 4], в том числе и острый пиелонефрит. У пациентов с острым серозным пиелонефритом (ОСП) выявляется увеличение в крови содержания лейкоцитов, гранулоцитов, IgG, общей активности комплемента, снижение уровня недифференцированных лимфоцитов, общих Т-лимфоцитов, Т-хелперов, В-клеток, IgА и М, циркулирующих иммунных комплексов (ЦИК), фагоцитарной активности нейтрофилов, повышение уровня противо- и провоспалительных цитокинов (ИЛ-1β, ИЛ-17, ИЛ-23, ИЛ-4, фактор некроза опухоли (ФНО), ИФγ, МСР-1).
У больных острым гнойным пиелонефритом (ОГП) отмечаются лимфопения, супрессия Т-зависимого звена иммунитета, дисбаланс гуморальной системы по В-клеткам и иммуноглобулинам, что свидетельствует о нарушении инфекционной устойчивости у пациентов с ОГП [5–7].
Необходимо отметить, что зачастую результаты исследования показателей иммунного статуса носят несистемный и противоречивый характер, что во многом объясняется отсутствием общепринятой классификации пиелонефрита и как следствие – включением пациентов с различными клиническими формами и течением заболевания в одну группу [8–10].
Согласно одной из наиболее используемых классификаций, острый пиелонефрит разделяют на серозный, гнойный и некротический папиллит и от формы клинического течения зависит характер лечения. При первичном серозном пиелонефрите показано консервативное лечение, при вторичном серозном и гнойном пиелонефрите помимо антибактериальной, противовоспалительной и дезинтоксикационной терапии необходимо хирургическое лечение [11–13]. Таким образом, исход острого пиелонефрита зависит от состояния иммунного статуса, клинического течения и эффективности стандартного лечения. В связи с этим изучение изменений иммунного статуса у больных острым пиелонефритом до и после стандартного лечения в строго подобранных группах крайне актуально.
Цель исследования: изучить состояние иммунного статуса до и после проведенного стандартного лечения при остром серозном и гнойном пиелонефрите.
Материалы и методы. Под наблюдением находились пациенты с диагнозом «острый пиелонефрит», проходившие стационарное лечение в 2014–2015 гг. в урологическом отделении ГБ СМП г. Курска и урологическом центре Научного клинического центра ОАО РЖД (Москва). Всем больным проводили стандартное комплексное клинико-инструментальное обследование.
В исследование были включены 62 пациента (56 женщин и 6 мужчин в возрасте 41,5±3,9 года) с ОСП и ОГП, подтвержденными клиническими и инструментальными методами обследования, рандомизированных по возрасту, полу, минимальному количеству сопутствующих заболеваний в стадии ремиссии. Критерии включения: острый серозный или гнойный пиелонефрит, вовлечение в процесс только одной почки, переносимость использованных в исследовании фармакологических препаратов и нефармакологических методов воздействия, уровень простатспецифического антигена (ПСА) у лиц мужского пола ниже 4 нг/мл, письменное согласие на участие в проводимых исследованиях. Критерии исключения: двусторонний пиелонефрит, наличие специфических инфекций, передаваемых половым путем, наличие инфравезикальной обструкции, соматическая патология в стадии неполной ремиссии и стадии обострения, аллергические реакции на используемые препараты, уровень ПСА выше 4 нг/мл и отказ от проводимых исследований.
В 1-ю группу вошли 32 пациента с ОСП, причем у 17 больных он носил первичный характер (без нарушения пассажа мочи), а у 15 человек пиелонефрит был вторичным, и больные поступили с клиникой почечной колики. В первую очередь больным обструктивным пиелонефритом проведены мероприятия по восстановлению пассажа мочи (катетеризация мочеточника (9 человек), чрескожная пункционная нефростомия (6)). Затем назначали консервативную медикаментозную терапию: комбинацию антибиотиков разных групп (β-лактамные антибиотики, аминогликозиды, макролиды, линкозамиды, фторхинолоны); инфузионно-дезинтоксикационную терапию; препараты, усиливающие почечный кровоток и улучшающие функциональное состояние органа (трентал, курантил, обзидан); улучшающие венозный отток из почек (венорутон, троксевазин); нестероидные противовоспалительные средства (аспирин, вольтарен, гепарин); адаптогены, витамины. После купирования острого воспалительного процесса устраняли причины обструктивного характера, чаще всего это были камни мочеточника (выполняли дистанционную литотрипсию [ДЛТ] или контактную уретеролитотрипсию [КУЛТ]).
Во 2-й группе было 30 пациентов с ОГП, которым выполняли люмботомию, декапсуляцию почки, иссечение гнойных элементов, нефростомию и удаление конкрементов, выявленных в зоне оперативного вмешательства (лоханка, верхняя треть мочеточника). В 5 случаях гнойный пиелонефрит был первичным и необходимости в нефростомии не было. В послеоперационном периоде больным назначали комплексную медикаментозную терапии, как и пациентам 1-й группы, и через 7–10 дней антибактериальной терапии удаляли конкременты из тазового отдела мочеточника. Забор крови производили до начала комплексного лечения сразу после оперативного вмешательства и перед выпиской на 10-е сутки после начала лечения.
Группа контроля включила 15 здоровых доноров-добровольцев того же возраста.
Уровень цитокинов (ФНО, ИЛ-1α, ИЛ-8, ИЛ-2, ИЛ-10, ИФα, рецепторного антагониста интерлейкина-1 [РАИЛ-1]), иммуноглобулинов классов M, G, A определяли в биологическом материале методом твердофазного иммуноферментного анализа (ИФА) с детекцией продуктов реакции в диапазоне длин волн 405–630 нм с использованием коммерческих наборов. Компоненты системы комплемента (С3, С3а, С4, С5 и С5а) и фактор Н определяли диагностическим набором с использованием двух принципов: гемолитического метода учета активации системы комплемента и ИФА-метода определения терминального комплекса, выявляемого специфическими антителами. Активность С1-ингибитора определяли хромогенным методом по способности ингибировать С1-эстеразу. Для оценки уровня ЦИК применяли метод селективной преципитации с полиэтиленгликолем.
Функциональную активность нейтрофилов,после их выделения из крови на градиенте плотности фиколл-урографина (d=1,077) оценивали по фагоцитарному показателю (ФП), фагоцитарному числу (ФЧ) и индексу активности фагоцитоза (ИАФ) [14]. Кислородзависимую активность определяли по спонтанному и стимулированному зимозаном тесту восстановления нитросинего тетразолия (НСТ-сп. и НСТ-ст.), индексу стимуляции (ИСН) и функциональному резерву (ФРН) нейтрофилов [15].
Статистическую обработку результатов исследования проводили по общепринятым критериям вариационно-статистического анализа с вычислением средних величин (M), ошибки средней арифметической (m) с помощью пакета компьютерных программ Microsoft Excel (2010). Существенность различий оценивали по U-критерию. Статистически значимыми считали различия при p<0,05 [16].
Частотный анализ, который оперирует риском формирования патологии по конкретным показателям заданной 2–3-й степеней в популяции больных, проводили с предварительным определением степени изменения показателей по формуле [17]:
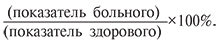
Если выявлялись изменения параметров до 33%, то это расценивалось как 1-я степень иммунных расстройств, от 34 до 66% – 2-я степень, выше 66% – 3-я степень, которая при получении знака (-) характеризовалась как иммунная недостаточность (СИН), а со знаком (+) – гиперфункция иммунной системы (ГИС).
Результаты и обсуждение. До лечения как при ОСП, так и при ОГП отмечались однотипные изменения в стандартных лабораторных показателях: в крови — лейкоцитоз с повышением уровня палочкоядерных и сегментоядерных нейтрофилов, эозинопения, повышение СОЭ, индексов лейкоцитарнотоксического и сдвига лейкоцитов, повышение уровня билирубина, креатинина, С-реактивного белка, в моче – лейкоцитурия, эритроцитурия, микроальбуминурия, повышение содержания эпителиальных клеток. Кроме этого в сыворотке крови и моче пациентов с ОСП выявлено снижение концентрации цистатина, у больных ОГП в сыворотке – повышение содержания мочевины и мочевой кислоты, а в моче – белка. Проведенное стандартное лечение способствовало нормализации или значительной коррекции всех измененных показателей, что не объясняет длительности периода реабилитации пациентов с данными формами острого пиелонефрита и отсутствием статистически значимых показателей для их дифференцировки. В связи с этим проведено определение параметров иммунного статуса для поиска показателей, реально отражающих динамику процесса при данной патологии.
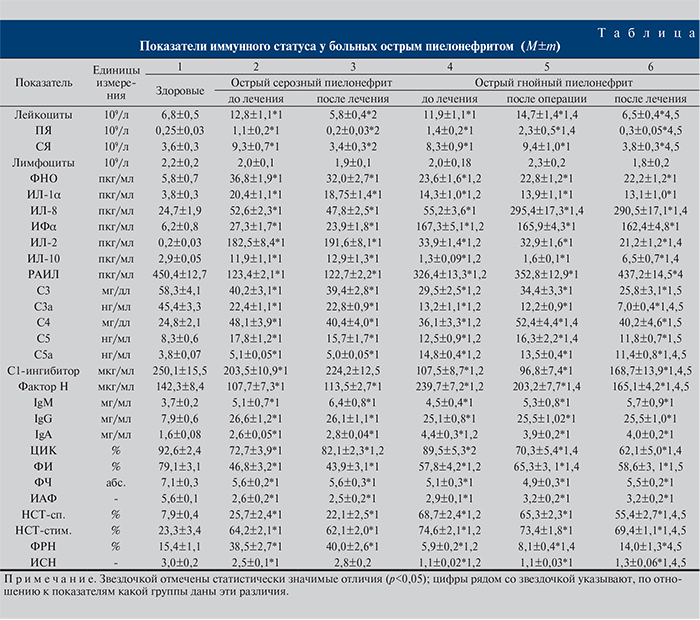
У пациентов с ОСП до начала лечения в плазме периферической крови отмечено повышение концентрации провоспалительных цитокинов (ФНО, ИЛ-1α, ИЛ-8), ИФα, ИЛ-2 и разнонаправленное изменение противовоспалительных (повышение ИЛ-10 и снижение РАИЛ) цитокинов. После проведенного лечения достоверных изменений в содержании цитокинов не обнаружено (см. таблицу).
У больных ОГП выявлено повышение уровня провоспалительных цитокинов, ИЛ-2, ИФα и снижение противовоспалительных цитокинов. После оперативного вмешательства по сравнению с началом лечения отмечено только дальнейшее увеличение содержания ИЛ-8. После комплексного лечения выявлена нормализация концентрации РАИЛ, снижение, но не до показателей здоровых доноров, содержания ИЛ-2, повышение по сравнению с началом лечения и контролем концентрации ИЛ-8 и ИЛ-10. Уровень в плазме крови ФНО, ИЛ-1α и ИФα не изменился по сравнению с результатами, полученными при поступлении пациентов в клинику (см. таблицу).
У пациентов с ОСП перед началом лечения в плазме крови выявлено повышение содержания компонентов комплемента (С4, С5, С5а), снижение С3 и С3а, ингибиторов системы комплемента (С1-ингибитор и фактор Н), повышение всех исследованных классов иммуноглобулинов (M, G и A) со снижением уровня ЦИК. После проведенного лечения концентрация С1-ингибитора системы комплемента нормализовалась, повысилось, но не до уровня здоровых доноров, содержание ЦИК (см. таблицу).
У больных ОГП на начало лечения выявлены аналогичные с ОСП по направленности изменения показателей системы комплемента и иммуноглобулинов, за исключением нормального уровня ЦИК и повышенного фактора Н. После операции по сравнению с началом лечения установлено повышение уровня С4- и С5-компонентов комплемента, снижение содержания фактора Н и ЦИК. Проведенное комплексное лечение способствовало снижению концентрации С3а- и С5а-компонентов комплемента, ЦИК, повышению содержания ингибиторов системы комплемента. Следует отметить, что ни один показатель не достиг контрольных значений (см. таблицу).
При поступлении в клинику у пациентов с ОСП выявлено снижение активности и интенсивности фагоцитоза нейтрофилов периферической крови (снижение ФИ, ФЧ и ИАФ). Одновременно с этим оказалась повышенной активность кислородзависимых систем полиморфноядерных лейкоцитов, так как тесты НСТ-сп., НСТ-ст. и ФРН оказались выше значений здоровых доноров при одновременном снижении ИСН. После проведенного стандартного лечения нормализовался только один показатель – ИСН (см. таблицу).
У больных ОГП также оказались сниженными показатели активности и интенсивности фагоцитоза. Активность кислородзависимых систем нейтрофилов тоже значительно отличалась от контроля: НСТ-сп. и НСТ-ст. оказались выше, а ФРН и ИСН – ниже. После проведенного оперативного вмешательства по сравнению с началом лечения повысились ФИ и ФРН, но не до значений здоровых доноров. По окончании комплексного лечения нормализовался ФРН и корригировались в сторону, но не до уровня контроля НСТ-тесты и ИСН (см. таблицу).
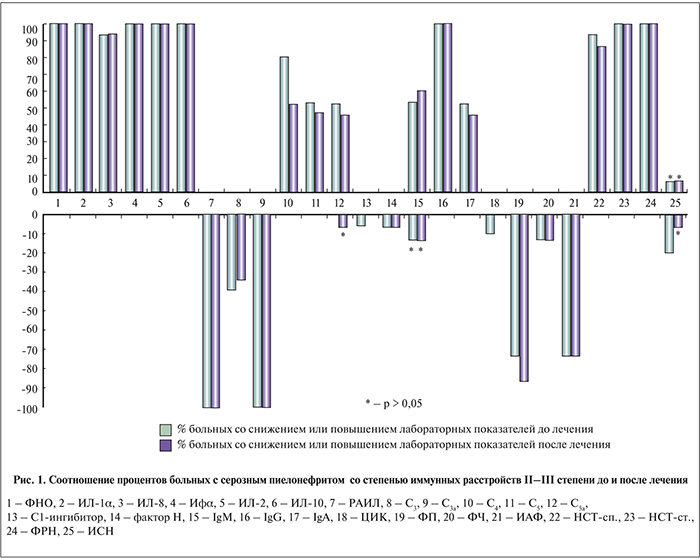
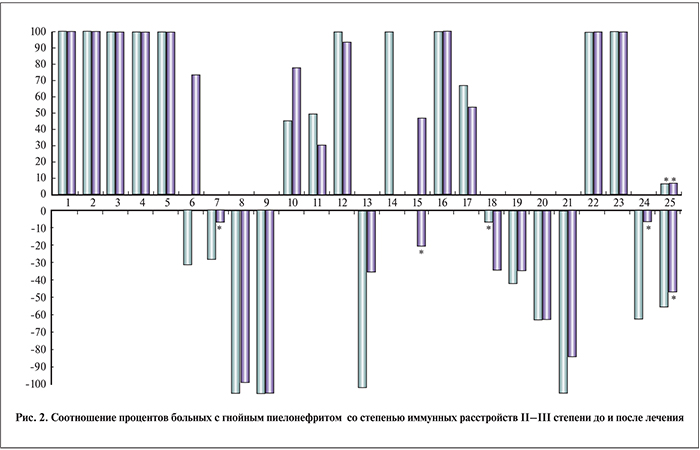
С учетом того, что анализ динамики средних значений параметров любых лабораторных показателей, в том числе иммунного статуса, не высокоинформативен, поскольку не учитывает значений показателей у каждого пациента [5], мы дополнительно использовали частотный анализ, результаты которого представлены на рис. 1 и 2.
С учетом индивидуальных показателей по каждому пациенту можно констатировать, что и при серозной, и при гнойной формах острого пиелонефрита наблюдаются той или иной степени выраженности однотипные изменения показателей врожденного и адаптивного иммунитета: повышение уровня цитокинов со снижением противовоспалительных при ОГП и их дисбалансом при ОСП, дисбаланс по различным показателям системы комплемента, более выраженный при ОСП, повышенная продукция иммуноглобулинов с одновременным снижением уровня ЦИК, снижение активности и интенсивности фагоцитоза, функционального резерва и индекса стимуляции нейтрофилов периферической крови при значительном увеличении метаболической активности полиморфно-ядерных лейкоцитов. В целом полученные данные можно расценивать как свидетельство дисбаланса иммунологической реактивности на фоне воспаления.
Безусловно, представляет большой интерес возможность использования для дифференциальной диагностики иммунных показателей на начальной стадии заболевания. При анализе исследованных 25 показателей иммунного статуса у пациентов с ОСП и ОГП до начала лечения установлено статистически достоверная разность 20 из них (80%) в абсолютном отношении и, что наиболее значимо, 4 показателя оказались разными и по направленности изменений (ИЛ-10, фактор Н, ЦИК и ФРН) (16%). Некоторые показатели, имеющие наибольшую диагностическую ценность, могут быть использованы для дифференциальной диагностики (рис. 3).
Данные литературы последних лет свидетельствуют об увеличении частоты пиелонефрита и нередко атипичного его течения, особенно при ненарушенном оттоке мочи. Это обусловлено как улучшением диагностики, так и возросшей вирулетностью микроорганизмов, изменением течения инфекционного процесса в почке вследствие измененных иммунных реакций [11].
Острый инфекционно-воспалительный процесс может заканчиваться выздоровлением, но в 40% случаев следствием перенесенного острого гнойного пиелонефрита может стать хронический пиелонефрит [13].
Исход любой воспалительной реакции во многом зависит от состояния иммунной системы [18, 19]. Течение хронического пиелонефрита нередко осложняется формированием вторичного иммунодефицитного состояния, которое не только обеспечивает благоприятный фон для дальнейшего развития болезни, но и потенцирует действие других патогенетических факторов. По мере прогрессирования бактериально-воспалительного процесса в почке иммунологическая недостаточность усугубляется. Это связано, с одной стороны, с персистенцией микроорганизмов и пролонгированным антигенным воздействием, приводящим к истощению резервных возможностей иммунной системы, с другой – с иммунодепрессивным действием длительной антибактериальной терапии, а при оперативных вмешательствах – операционным стрессом, операционной травмой, наркозом, кровопотерей [20–22].
При первичных формах острого пиелонефрита современные ультразвуковые и рентгеновские методы (КТ, МРТ) информативны лишь при наличии выраженной деструкции паренхимы почек (абсцессы, карбункулы). Апостематозные разновидности диагностировать с их помощью трудно, а диагностическая ценность стандартных лабораторных методов, позволяющих оценивать особенности общих реакций организма, невелика, что отмечено и в нашей работе. Имеющиеся публикации относительно иммунных нарушений при остром пиелонефрите касаются или отдельных ее сторон, или противоречивы, или при этом используются различные классификации данной патологии. В определенной мере это связано с проведением исследований на первично выявленных больных в активной фазе болезни, когда в принципе затруднена диагностика дефектов иммунного статуса вследствие адаптивной его реакции на воспаление [23, 24].
У пациентов с острым пиелонефритом до начала комплексного лечения вне зависимости от клинической формы заболевания выявлены однотипные изменения различных систем иммунного гомеостаза: активация синтеза цитокинов со сниженной продукцией противовоспалительных цитокинов, дисбаланс системы комплемента, повышенная продукция иммуноглобулинов с одновременным снижением уровня ЦИК, супрессия фагоцитарной активности с одновременным повышением метаболической активности нейтрофилов периферической крови, что в целом свидетельствует о нарушении иммунной реактивности у таких больных и дезадаптации механизмов поддержания иммунного гомеостаза.
С другой стороны, направленность и выраженность изменений большинства исследованных показателей иммунного статуса оказались статистически значимо разными, что можно использовать для дифференциальной диагностики серозной и гнойной форм острого пиелонефрита. Недостаточная коррекция иммунных нарушений после комплексного лечения, как ОСП, так и ОГП, свидетельствует о необходимости применения при обеих формах острого пиелонефрита с самого начала лечения иммунокорригирующих средств и методов.
Полученные результаты иммунологического обследования пациентов с серозной и гнойной формами острого пиелонефрита, с одной стороны, можно трактовать как защитные, адаптационные реакции в ответ на воспалительный процесс, с другой – как факторы, усугубляющие это воспаление, теоретически предполагающие развитие иммунопатологических реакций с формированием затяжного течения заболевания.
Заключение. Пациенты с ОСП и ОГП характеризуются отсутствием принципиальных различий результатов стандартных клинических анализов крови и мочи до и после комплексного лечения. При этом имеется ряд отличий в направленности и выраженности изменений иммунных показателей, что можно использовать для дифференциальной диагностики различных форм острого пиелонефрита, патогенетического обоснования длительности периода реабилитации данной категории пациентов, а также обоснования необходимости использования в комплексном лечении иммуномодулирующих препаратов как при серозной, так и при гнойной форме острого пиелонефрита.



