Введение. В связи с тем что инфекции мочевыводящих путей (ИМВП) являются одной из наиболее частых инфекций не только в амбулаторной практике, но и у стационарных больных, применение антибактериальных препаратов при этом типе инфекции во всем мире принимает угрожающие масштабы.
С учетом возросшей антибактериальной резистентности во всем мире, особенно в отношении уропатогенов, тщательному изучению подлежит проблема рационального использования антибиотиков и любых значимых альтернативных методов лечения, позволяющих снижать частоту использования антибактериальных препаратов.
При ИМВП можно рассматривать четыре возможных клинических варианта назначения лечения:
- Отсутствие лечения бессимптомной бактериурии (ББУ).
- Неантибактериальная профилактика рецидивов ИМВП.
- Использование «старых» антибактериальных препаратов, сохранивших свою активность, при лечении неосложненных ИМВП.
- Альтернативные методы лечения неосложненных ИМВП.
Бессимптомная бактериурия
В исследованиях по количественной оценке посевов мочи, полученных от массы пациентов, установлено пороговое значение значимой (истинной) бактериурии, которое составило ≥105 КОЕ/мл [1].
В связи с тем что ББУ часто обнаруживают в популяции, предрасположенной к развитию пиелонефрита (лица, страдающие сахарным диабетом; беременные; лица с обструктивной нефропатией; лица, перенесшие вмешательства на мочевыводящих путях), было высказано предположение о наличии четкой взаимосвязи между бактериурией и пиелонефритом.
За последние годы в понимании ББУ произошел полный сдвиг парадигмы [2]. Тем не менее в качественно проведенных рандомизированных клинических исследованиях с участием взрослых женщин, школьниц, лиц, длительно пребывающих в стационарах, пациентов с повреждением спинного мозга, и женщин, страдающих сахарным диабетом, были получены подтверждения того, что лечение бактериурии у пациентов без клинических симптомов инфекции мочевыводящих путей не дает никаких преимуществ для пациента [3, 4]. В связи с этим от термина «бессимптомная инфекция мочевыводящих путей» отказались и приняли термин ББУ. Диагноз ББУ устанавливают независимо от наличия пиурии, которую часто обнаруживают у пациентов с ББУ [3]. В настоящее время ББУ рассматривают как стабильную бактериальную колонизацию мочевыводящих путей, аналогичную комменсализму на других слизистых оболочках [5].
У пациентов без клинических симптомов инфекции мочевыводящих путей с колонизацией нижних мочевыводящих путей бактериальными штаммами уропатогенов можно предотвращать суперинфекцию другими штаммами даже без проведения лечения [6]. Этот феномен так называемой бактериальной интерференции обусловлен тем, что в организме происходит взаимодействие бактериальных сред обитания микробов, заключающееся в конкурентной борьбе за питательные вещества и образование токсичных молекул. Таким образом, устанавливается микробный баланс на колонизированных поверхностях, таких как кожа и слизистые оболочки различных «физиологических отверстий». Этот так называемый человеческий микробиом считают мощным механизмом защиты от суперинфицирующих патогенных бактерий [6].

Cai и соавт. [7] опубликовали результаты проспективного рандомизированного клинического исследования роли ББУ у молодых женщин с рецидивирующими ИМВП. В нем приняли участие сексуально активные женщины в возрасте от 18 до 40 лет с рецидивирующими ИМВП и ББУ после антибактериальной терапии, но без известных (осложняющих) факторов риска развития рецидива ИМВП [12]. Авторы изучали, эффективно ли периодическое антибактериальное лечение обнаруженной ББУ у таких пациенток, или неэффективно, или даже негативно сказывается на частоте рецидивов ИМВП. Были получены убедительные данные, согласно которым антибактериальное лечение ББУ у молодых женщин с рецидивом ИМВП не только не целесообразно, но и оказывает вредное воздействие. В группе без лечения у 76% участниц симптомы отсутствовали в течение года, в то время как в группе лечения таких женщин было только 17%. Хотелось бы надеяться, что результаты этого исследования быстро станут известны всем врачам, которые сталкиваются с подобными пациентками, и тактика их ведения изменится: уменьшится количество исследований, посвященных скринингу ББУ и назначению антибактериальной терапии; снизятся не только затраты на лечение, но и давление в отношении выбора антибактериальных препаратов в обществе (и следовательно, формирование антибиотикорезистентности).
Тем не менее назначение антибактериального лечения при ББУ остается обязательным перед травмирующими урологическими вмешательствами и при беременности, хотя и с меньшим уровнем доказательности [8].
Профилактика рецидивов ИМВП без применения антибактериальных препаратов
 В свете появившихся проблем антибиотикорезистентности в стандартах Европейской ассоциации урологов (ЕАУ) по профилактике рецидивов ИМВП [8] антибиотикопрофилактика рекомендована только при неэффективности рекомендаций по изменению образа жизни и неантибактериальных методов лечения. В этом контексте обсуждается использование различных методов лечения, таких как местная гормональная заместительная терапия, особенно женщин в постменопаузе; применение клюквы, пробиотиков и иммунопрофилактики. Большинство методов лечения нельзя рекомендовать из-за низкого уровня доказательности (только C), поскольку либо результаты исследований были противоречивыми, либо не были проведены хорошо разработанные плацебо-контролируемые исследования, либо в исследования включали недостаточное число пациентов (исследования II фазы). Между тем было рекомендовано проведение пероральной профилактики препаратом OM-89 (Уро-Ваксом), который представляет собой лизат 18 различных штаммов E. coli, активирующий специфический и неспецифический иммунный ответ (уровень доказательности В). Мета-анализ результатов хорошо проведенных плацебо-контролируемых клинических испытаний показал, что применение Уро-Ваксома сопровождалось снижением частоты развития рецидивов ИМВП, уменьшением потребности в назначении антибактериальной терапии, уменьшением количества эпизодов дизурии, лейкоцитурии и бактериурии [9].
В свете появившихся проблем антибиотикорезистентности в стандартах Европейской ассоциации урологов (ЕАУ) по профилактике рецидивов ИМВП [8] антибиотикопрофилактика рекомендована только при неэффективности рекомендаций по изменению образа жизни и неантибактериальных методов лечения. В этом контексте обсуждается использование различных методов лечения, таких как местная гормональная заместительная терапия, особенно женщин в постменопаузе; применение клюквы, пробиотиков и иммунопрофилактики. Большинство методов лечения нельзя рекомендовать из-за низкого уровня доказательности (только C), поскольку либо результаты исследований были противоречивыми, либо не были проведены хорошо разработанные плацебо-контролируемые исследования, либо в исследования включали недостаточное число пациентов (исследования II фазы). Между тем было рекомендовано проведение пероральной профилактики препаратом OM-89 (Уро-Ваксом), который представляет собой лизат 18 различных штаммов E. coli, активирующий специфический и неспецифический иммунный ответ (уровень доказательности В). Мета-анализ результатов хорошо проведенных плацебо-контролируемых клинических испытаний показал, что применение Уро-Ваксома сопровождалось снижением частоты развития рецидивов ИМВП, уменьшением потребности в назначении антибактериальной терапии, уменьшением количества эпизодов дизурии, лейкоцитурии и бактериурии [9].
В соответствии со стандартами по оказанию медицинской помощи ЕАУ антибактериальную профилактику рецидивов ИМВП следует рассматривать только в случае неэффективности предпринятых попыток изменения образа жизни [8]. Соблюдение этого подхода позволит сохранить массу антибиотиков для лечения ИМВП.
Антибактериальное лечение ИМВП
Очевидно, что в лечении тяжелых форм ИМВП, таких как пиелонефрит и осложненные ИМВП, альтернативы антибактериальным препаратам не существует. Тем не менее в отношении лечения неосложненных ИМВП, таких как неосложненный цистит у женщин, имеется большое количество рекомендаций по использованию неантибактериальных препаратов, но большинство из них традиционны и научно не обоснованы. Несмотря на высокую частоту спонтанного клинического выздоровления при неосложненных ИМВП, в большинстве современных стандартов по оказанию медицинской помощи рекомендовано назначение антибактериальной терапии, поскольку клинический успех лечения более выражен у женщин, получавших антибиотики, по сравнению с плацебо [10].
В то же время рост антибиотикорезистентности во всем мире стал общей терапевтической проблемой. Во многих странах резистентность E. coli к триметоприму и котримоксазолу – препаратам, рекомендованным прежними стандартами [11], намного выше 20%, т.е. порогового значения, принятого для эмпирической терапии [12–14]. Во всем мире также возрастает резистентность E. coli к фторхинолонам, хотя во многих странах этот показатель не превышает 20%. В связи с этим применение фторхинолонов также больше не рекомендовано в качестве антибактериальной терапии первой линии для лечения неосложненных ИМВП (цистита) из-за непреднамеренных побочных эффектов [8, 15, 16]. «Старые» пероральные антибиотики, такие как фосфомицина трометамол, пивмециллинам и нитрофурантоин, которые по-прежнему сохраняют антибактериальную активность в отношении E. coli и других уропатогенов, все чаще рекомендуют в качестве антибиотиков первой линии по этим показаниям [8, 15, 16]. Тем не менее в дальнейшем следует проводить поиск других альтернативных препаратов.
Альтернативные методы лечения ИМВП
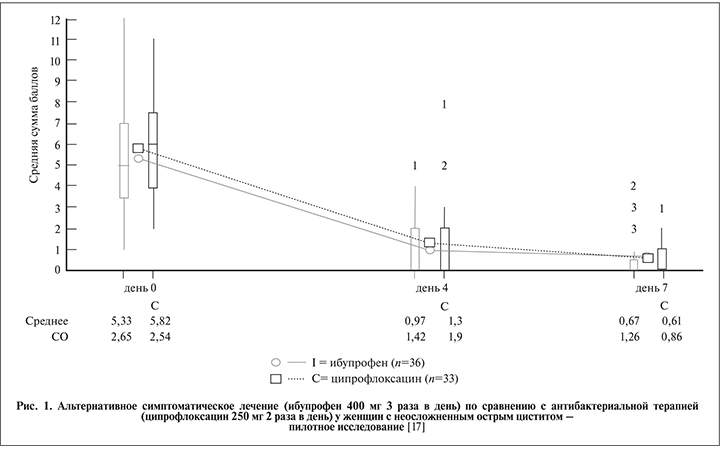
Существует множество интересных пилотных исследований альтернативных методов лечения женщин с острым неосложненным циститом. Принцип лечения в этом случае заключается не в использовании антибактериального препарата для элиминации бактерий, а в подавлении воспалительной (гипер)реакции организма пациента, которая в конечном итоге вызывает развитие заболевания. Присутствующие в организме бактерии могут спонтанно элиминироваться или адаптироваться к организму пациента, что приводит к развитию ББУ, безвредной для пациента и не требующей дальнейшего лечения. Это может также оказывать протективное действие в отношении дальнейших рецидивов заболевания в связи с развитием феномена бактериальной интерференции. В своем недавнем исследовании Bleidorn и соавт. [17] сравнивали эффективность ибупрофена и ципрофлоксацина. Восьмидесяти здоровым женщинам в возрасте от 18 до 85 лет с основными симптомами ИМВП, такими как дизурия или учащенное мочеиспускание без каких-либо осложняющих факторов, рандомизированно назначали таблетки ибупрофена 400 мг 3 раза в сутки или ципрофлоксацина 250 мг 2 раза в сутки (+1 плацебо) в течение 3 дней. Интенсивность основных симптомов – дизурия, учащенное мочеиспускание, боли внизу живота – регистрировали при включении в исследование, через 4, 7 и 28 дней, оценивая каждый симптом по шкале от 0 (отсутствие) до 4 баллов (сильно выраженный). Первичной конечной точкой была оценка разрешения симптомов на 4-й день. Вторичными – определение выраженности симптомов на 4-й и 7-й день (на основании суммы оценки всех симптомов), оценка разрешения симптомов на 7-й день и частота развития рецидива.
На рис. 1 видно, что симптомы разрешались одинаково быстро при использовании обоих препаратов. Тем не менее в связи с появлением персистирующих или рецидивирующих симптомов потребность в назначении повторного лечения была довольно высокой (см. таблицу).
В настоящее время продолжается проведение двух испытаний III фазы, в которых используют тот же подход: сравнивают эффективность перорального применения ибупрофена и фосфомицина трометамола, а также эффективность диклофенака и норфлоксацина [18, 19].
Другой подход предусматривает использование фитопрепаратов, таких как Канефрон® N («Bionorica SE»), основными компонентами которого являются золототысячник (Centaurium erythraea), любисток (Levisticum officinale) и розмарин (Rosmarinus officinalis). Самыми активными компонентами являются фенольные гликозиды и фенолкарбоновые кислоты (розмарин, любисток и золототысячник), фталиды (золототысячник), секоиридоиды (золототысячник), эфирные масла (любисток, розмарин) и флавоноиды (золототысячник, розмарин). Одна таблетка, покрытая оболочкой, содержит 18 мг травы золототысячника, 18 мг корня любистока и 18 мг листьев розмарина, а капли во флаконе емкостью 100 г содержат 29 г водно-спиртового экстракта 0,6 г травы золототысячника, 0,6 г корня любистока и 0,6 г листьев розмарина (содержание этанола: 16,0–19,5% (в объемном отношении)). В доклинических исследованиях было зарегистрировано большое количество фармакологических эффектов этого препарата, включая противовоспалительный, диуретический, спазмолитический, антиоксидантный, антибактериальный и нефропротективный [20–22].
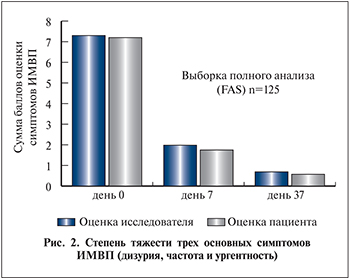
В открытом НКП-соответствующем («надлежащая клиническая практика») нерандомизированном многоцентровом пилотном исследовании на Украине с участием 125 пациенток с клиническими симптомами острого неосложненного цистита изучали эффективность лечения данным препаратом в дозировке 2 драже 3 раза в сутки в течение 7 дней (рис. 2) [23, 24]. Три основных симптома, таких как дизурия, учащенное мочеиспускание и ургентные позывы на мочеиспускание, оценивали по соответствующей шкале тяжести симптомов (0–4 балла) при первом визите к врачу, через 7 и 37 дней от начала лечения и ежедневно по дневникам пациенток. При каждом посещении врача проводили общий анализ крови и биохимический анализ крови, анализ и посев мочи. В случае сохранения или ухудшения симптомов пациенткам назначали антибактериальное лечение.
Основная цель исследования заключалась в определении безопасности препарата и регистрации любых побочных эффектов при его применении. Одной из вторичных конечных точек исследования была оценка частоты положительного ответа на лечение (клиническое выздоровление) в дни посещения врача, т.е. оценка каждого из трех основных симптомов по шкале тяжести не должна была превышать 1 балла (легкая степень). Другими вторичными конечными точками исследования были оценка тяжести и продолжительности симптомов в дни посещения врача, число пациенток, получавших антибактериальную терапию в течение первой недели, и число пациенток с рецидивом цистита, критерием которого считали появление характерных симптомов и бактериурии ≥104 КОЕ в течение периода наблюдения продолжительностью 37 дней.
В общей сложности зарегистрировали 19 нежелательных явлений, однако ни одно из них не было связано с применением препарата. Лечение фитопрепаратом привело к клиническому выздоровлению 71,2% пациенток на 7-й день, и 85,6% – на 37-й со значительным улучшением всех зарегистрированных симптомов. Только 3 (3,4%) пациентки получали антибактериальную терапию в течение первой недели, и ни у одной из них не было рецидива в течение периода наблюдения продолжительностью 37 дней. Приблизительно у половины пациенток выявляли бактериурию (≥103 КОЕ в 1 мл) при каждом визите к врачу (0, 7, 37-й день), хотя не всегда у одних и тех же пациенток. Приблизительно у 20% пациенток первоначальная бактериурия разрешилась, в то время как у аналогичного числа пациенток бактериурию выявляли только при последнем посещении врача. Спектр высеваемых бактерий при проведении обследования во время посещения врача был приблизительно одинаковым, при этом у 50% пациенток в посевах выявлена E. coli.
Результаты данного пилотного исследования необходимо подтвердить в хорошо разработанном проспективном рандомизированном сравнительном испытании, где препаратом сравнения выступал бы один из рекомендованных антибиотиков, например фосфомицина трометамол.
Шкала оценки симптомов острого цистита
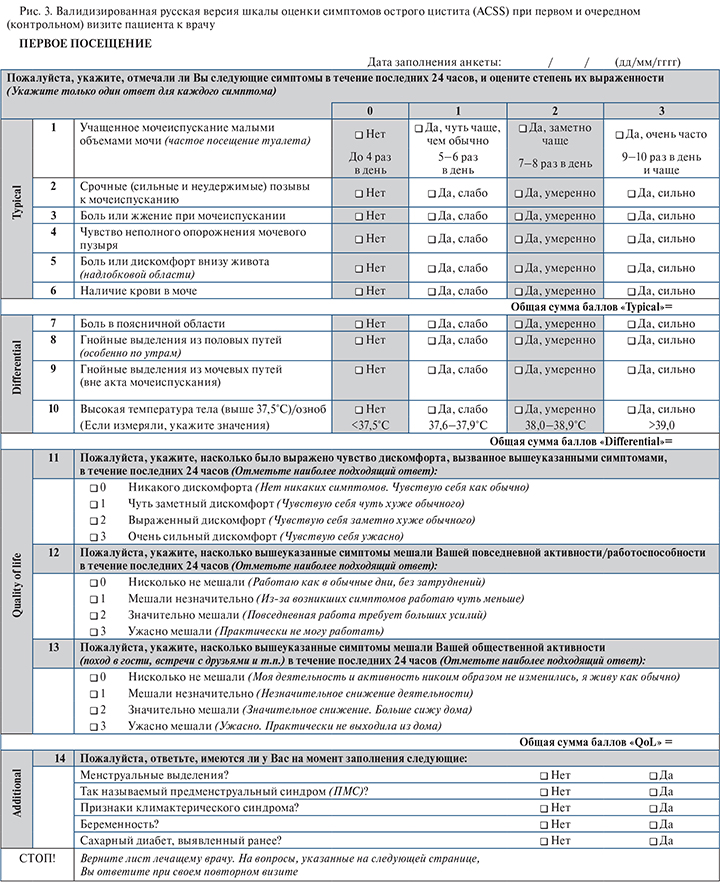
Если в будущем будут проводить сравнение эффективности симптоматических методов лечения и антибактериальной терапии, необходимо более точно оценивать выраженность клинических симптомов. По этой причине была разработана шкала оценки симптомов острого цистита (Acute Cystitis Symptom Score [ACSS]) – первоначально на узбекском языке, а потом переведена на русский и немецкий языки [25]. Шкала ACSS состоит из 18 вопросов, на которые пациентка отвечает самостоятельно. Вопросы разделены на четыре категории: а) вопросы о характерных симптомах (1–5); б) вопросы для дифференциального диагноза (7–10); в) вопросы о качестве жизни (11–13); г) дополнительные вопросы о сопутствующих состояниях (14–18). Пороговое значение 6 баллов при оценке характерных симптомов имело чувствительность 91,2% и специфичность 86,5% в отношении прогнозирования острого цистита. При анализе рабочей характеристической кривой типичных симптомов выявлено, что максимальная площадь под кривой приходилась на ургентные позывы на мочеиспускание (от неконтролируемого позыва на мочеиспускание до непосредственного болезненного мочеиспускания) (0,87; 95% доверительный интервал [ДИ] – 0,84–0,93), а минимальная площадь — на гематурию (0,67; 95% ДИ – 0,64–0,76). В целом площадь под кривой для категории типичных симптомов составила 0,95 (95% ДИ – 0,92–0,97). В исследование вошли данные анкетирования 296 респонденток.
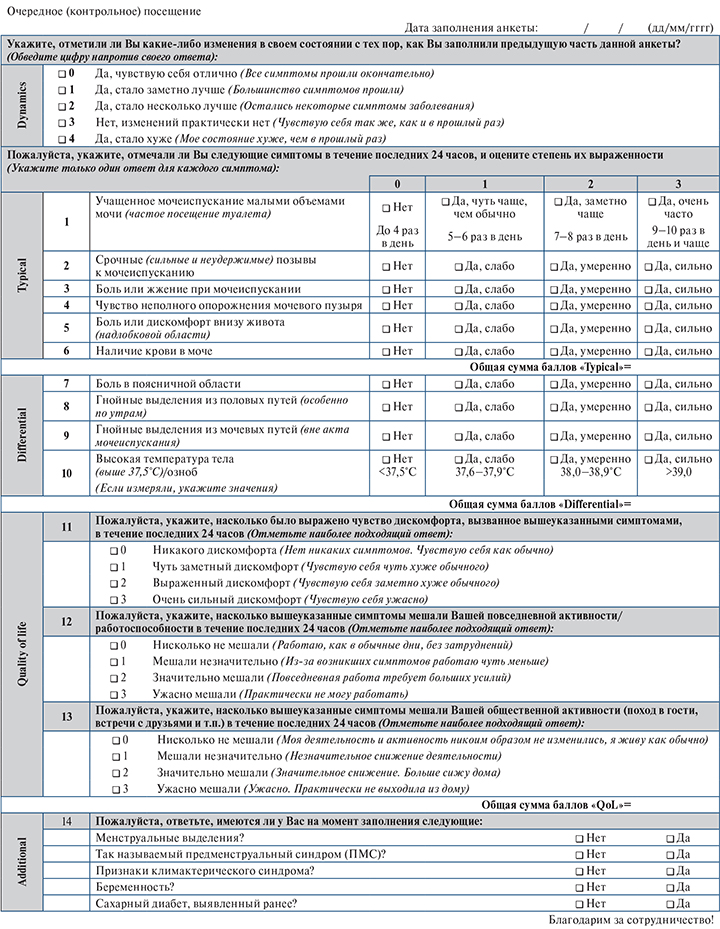
Аналогичные результаты обнаружили при тестировании русской версии ACSS (рис. 3) во время обследования 83 женщин. Оценка 6 баллов и выше в отношении характерных симптомов имела чувст-вительность и специфичность 97,4 и 86,7% соответственно. Наибольшая площадь под рабочей характеристической кривой приходилась на дизурию (боль во время мочеиспускания) (0,94; 95% ДИ – 0,89–1,00), а наименьшая – на гематурию (0,58; 95% ДИ – 0,45–0,71). На секцию характерных симптомов также приходилась максимальная площадь под рабочей характеристической кривой (0,97; 95% ДИ – 0,93–1,00). Чувствительность и специфичность немецкой версии (протестированной с участием 36 женщин) составили 94,7 и 82,4% соответственно. Наибольшая площадь под рабочей характеристической кривой также была выявлена при оценке по секции характерных симптомов и составила 0,95 (95% ДИ – 0,87–1,00). Среди типичных симптомов наибольшая площадь под рабочей характеристической кривой снова приходилась на дизурию (0,89; 95% ДИ – 0,78–1,00). В отношении гематурии площадь под рабочей характеристической кривой составила 0,89 (95% ДИ – 0,85–0,93) и 0,70 (95% ДИ – 0,64–0,76) соответственно. При сравнении с оригинальной (узбекской) версией переведенные и валидированные русская и немецкая версии ACSS были признаны такими же достоверными и надежными, как и оригинальная.
Заключение. В связи с повсеместно возросшей резистентностью уропатогенов ко многим рекомендованным антибиотикам необходимо тщательно изучить все возможности применения альтернативных методов лечения и неантибактериальных препаратов путем проведения хорошо разработанных клинических исследований с высоким уровнем доказательности. В таких клинических исследованиях для диагностики и оценки исходов может быть целесообразно использование валидизированных анкет, например ACSS, уже разработанных на русском и узбекском языках.



