Введение. Рак предстательной железы (РПЖ) является наиболее распространенным злокачественным новообразованием у мужчин, которое в странах Европы и США опережает по заболеваемости рак легких и колоректальный рак [1, 2]. Так, по данным как Европейской, так и Американской ассоциаций урологов, в течение жизни диагноз РПЖ будет поставлен каждому 7-му мужчине. При этом у 80% заболевших будет диагностирован локализованный РПЖ (стадии T1–2N0M0). Ситуация в России, к сожалению, значительно хуже, и на начальные стадии РПЖ приходится лишь 50% случаев [3]. Общепринятый метод лечения локализованного РПЖ в настоящее время – это радикальная простатэктомия (РПЭ), которая в идеале является излечивающей процедурой, практически не снижающей качество жизни пациента.
Помимо онкологического результата зачастую не менее важным для пациентов является и функциональный результат операции. Под функциональным результатом подразумевается сохранение эректильной функции, удержания мочи и нормального акта мочеиспускания. При выполнении РПЭ возможно повреждение структур, ответственных за удержание мочи (шейка мочевого пузыря, мышцы промежности, мембранозный отдел уретры), что может стать причиной стрессового недержания мочи (СНМ) у 6–8% пациентов. Данное осложнение существенно снижает качество жизни пациентов [4]. Другим тяжелым осложнением РПЭ может стать развитие обструктивного мочеиспускания (инфравезикальной обструкции) или острой задержки мочи, вызванной стенозом везикоуретрального анастомоза (СВУА). В свою очередь обструктивное мочеиспускание может стать причиной развития рецидивирующей инфекции мочевыводящих путей. Послеоперационное СНМ и СВУА не являются изолированными патологиями, а зачастую встречаются в комбинации, оказывая выраженное негативное влияние на здоровье и качество жизни пациентов, и, разумеется, наносят значимый экономической ущерб, обусловленный затратами на лечение [5, 6].
В своей работе мы решили оценить частоту, степень сопутствующего СНМ и качество жизни до и после эндоскопической коррекции везикоуретрального анастомоза (ВУА) у пациентов, перенесших радикальное оперативное лечение по поводу РПЖ, а также оценить эффективность первичной и повторных эндоскопических коррекций ВУА; проследить влияние количества перенесенных эндоскопических коррекций на степень СНМ и качество жизни пациентов.
Материалы и методы. Первым этапом проведен ретроспективный анализ количества и вида (открытая позадилонная или лапароскопическая роботассистированная) РПЭ, выполненных в клинике с января 2010 по декабрь 2015 г.
Далее проведен архивный поиск и анализ историй болезней пациентов, обратившихся в нашу клинику с 2010 по 2015 г. в связи с обструктивной симптоматикой и ранее перенесших в клинике РПЭ.

В исследование были включены пациенты с обструктивной симптоматикой, обусловленной СВУА, в последующем перенесшие эндоскопическую коррекцию ВУА. Критерии исключения: наличие у пациента стриктуры уретры в отсутствие признаков стенозирования ВУА; перенесенная отрытая реконструкция ВУА.
В ходе архивного поиска собирались данные о симультанных манипуляциях; количестве и типе перенесенных каждым пациентом эндоскопических коррекций ВУА.
Следующим шагом осуществлен телефонный опрос пациентов, обратившихся в клинику в связи со СВУА.
В ходе опроса собрана следующая информация:
- наличие и степень выраженности СНМ непосредственно после РПЭ и после эндоскопической коррекции ВУА; выраженность СНМ оценивали по количеству урологических прокладок, используемых пациентами в течение суток;
- оценка качества жизни (по шкале QoL) до и после эндоскопической коррекции СВУА;
- превалирующий фактор при оценке качества жизни до и после эндоскопической коррекции ВУА: стрессовое недержание мочи или обструктивная симптоматика;
- наличие на момент опроса обструктивной симптоматики.
На заключительном этапе работы выполнена статистическая обработка полученных результатов с расчетом параметров вариационных рядов (взвешенное среднее значение, среднеквадратическое отклонение [σ], коэффициент вариации [Cv]), применением парного и непарного t-критериев Стьюдента, коэффициента корреляции Пирсона. Статистически значимыми считали различия при р<0,05.
Результаты. В период с 2010 по 2015 г. в нашей клинике было выполнено 1453 РПЭ, при этом зарегистрировано 60 случаев СВУА. Эндоскопическая коррекция ВУА выполнялась пятью хирургами (табл. 1).
Стоит отметить, что тенденция к ежегодному увеличению абсолютного числа случаев СВУА (исключение составляет 2015 г., по-видимому, из-за сравнительно малого времени, прошедшего с момента радикальной операции) пропорционально увеличению выполняемых нами простатэктомий (рис. 1). Заболеваемость СВУА после РПЭ в разные годы варьировала от 2,19 до 6,47% (рис. 2).
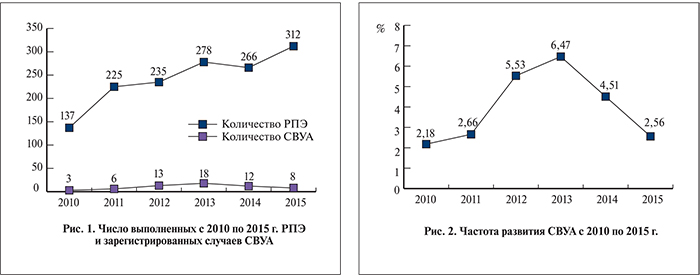
В подавляющем большинстве случаев СВУА развивались после РППЭ – 88% наблюдений (рис. 3).
 Основным методом коррекции ВУА, применяемым в нашей клинике, является эндоскопическое рассечение ВУА «горячим» ножом на 3 и 9 часах условного циферблата и последующая электрорезекция рубцовой ткани в зоне ВУА с оставлением эпителиальных мостиков на 6 и 12 часах условного циферблата. Данную манипуляцию перенесли 57 пациентов. При этом в 7 случаях эндоскопическая коррекция сочеталась с удалением сосудистых клипов «Hem-O-Lock», мигрировавших в зону ВУА, в 4 случаях электрорезекции предшествовала внутренняя оптическая уретротомия (ВОУ) по поводу стриктур бульбозного или мембранозного отдела уретры. В случае развития рецидива СВУА выполняли повторную эндоскопическую электрорезекцию рубцовой ткани. Рассечение рубцовой ткани «холодным» ножом в форме звезды «Мерседес» (на 4, 8 и 12 часах условного циферблата) инициально выполнено 2 пациентам, лазерная вапоризация рубцовой ткани в зоне анастомоза – 1 пациенту.
Основным методом коррекции ВУА, применяемым в нашей клинике, является эндоскопическое рассечение ВУА «горячим» ножом на 3 и 9 часах условного циферблата и последующая электрорезекция рубцовой ткани в зоне ВУА с оставлением эпителиальных мостиков на 6 и 12 часах условного циферблата. Данную манипуляцию перенесли 57 пациентов. При этом в 7 случаях эндоскопическая коррекция сочеталась с удалением сосудистых клипов «Hem-O-Lock», мигрировавших в зону ВУА, в 4 случаях электрорезекции предшествовала внутренняя оптическая уретротомия (ВОУ) по поводу стриктур бульбозного или мембранозного отдела уретры. В случае развития рецидива СВУА выполняли повторную эндоскопическую электрорезекцию рубцовой ткани. Рассечение рубцовой ткани «холодным» ножом в форме звезды «Мерседес» (на 4, 8 и 12 часах условного циферблата) инициально выполнено 2 пациентам, лазерная вапоризация рубцовой ткани в зоне анастомоза – 1 пациенту.
Из исследования были исключены 4 пациента, которым была выполнена открытая реконструкция ВУА (в дальнейшем 2 пациентам наложена эпицистостома в связи с облитерацией ВУА). Из этой группы 3 пациента ранее перенесли 4 эндоскопические коррекции ВУА, 1 – 5 коррекций ВУА. Показанием к открытой реконструкции ВУА стало повторное значительное затруднение мочеиспускания (максимальная объемная скорость мочеиспускания – 5 мл/с и ниже) вплоть до острой задержки мочи в сочетании с технической невозможностью или бесперспективностью, по мнению врачебного консилиума, дальнейших попыток эндоскопический коррекции.
По данным телефонного опроса, СНМ непосредственно после удаления уретрального катетера после РПЭ имело место у 36 (64,3%) пациентов, 32 (88,9%) из которых перенесли РППЭ. Степень СНМ варьировалась от 1 до 9 прокладок в сутки. При этом говорить о какой-либо типичной для данной группы пациентов степени недержания мочи не представляется возможным (взвешенное среднее значение=1,83, σ=1,67; Cv=91,0%).
При оценке качества жизни пациентов до эндоскопической коррекции ВУА по шкале QoL средний балл оказался равным 3,95 (σ=0,64; Cv=16,2%), что говорит о неудовлетворительном качестве жизни (рис. 4). Стоит отметить, что основной вклад в снижение качества жизни до эндоскопической коррекции ВУА внесла именно обструктивная симптоматика. Так, 87,5% (n=49) пациентов сообщили, что главными дезадаптирующими факторами стали именно ослабление струи мочи; частое, зачастую болезненное мочеиспускание; эпизоды острой задержки мочи.
Развитие рецидива СВУА после первой эндоскопической коррекции отмечено в 45% случаев. Пациенты данной группы в дальнейшем перенесли от 2 до 7 эндоскопических коррекций рецидивирующего СВУА.
Эффективность первичной и повторных эндоскопических коррекций ВУА оценена на основании отсутствия у пациентов субъективных признаков обструктивного мочеиспускания. При расчетах также были учтены пациенты, перенесшие открытую реконструкцию ВУА, что свидетельствовало о безуспешности попыток эндоскопической коррекции ВУА (табл. 2).
После эндоскопической коррекции ВУА стрессовое недержание мочи имело место у 46 (82,1%) пациентов, при этом 24 (52,3%) из них перенесли 2 и более эндоскопических коррекций. Из 20 пациентов, полностью удерживавших мочу до эндоскопической коррекции, после операции инконтиненция развилась у 75% (n=15) пациентов.

Пять пациентов сообщили о тотальном СНМ. Количество используемых пациентами прокладок варьировало от 1, применяемой в течение 2 суток, до 12 в сутки. После эндоскопической коррекции степень СНМ увеличилась более чем на 1 используемую в сутки прокладку у 33,9% (n=19) пациентов, более чем на 2 прокладки в сутки у 17,9% (n=10) пациентов.
Судить о какой-либо типичной степени СНМ, как и дооперативной коррекции ВУА, не представляется возможным (взвешенное среднее значение=2,65, σ=2,45; Cv=91,9%). Выявленное в целом изменение степени СНМ оказалось статистически не значимым (парный t-критерий Стьюдента=1,98, p>0,05).
После эндоскопической коррекции ВУА отмечено некоторое улучшение качества жизни пациентов. При этом полученная разница в оценках качества жизни до и после эндоскопической коррекции ВУА является статистически достоверной (парный t-критерий Стьюдента=5,08, p<0,05). Основным фактором, снизившим качество жизни после эндоскопической коррекции ВУА 78,6% пациентов (n=44), назвали СНМ. При этом на оценку качества жизни этой группы больных в заметной степени влияли уровни трудовой и социальной активности пациентов, что привело к разбросу оценок качества жизни от «хорошее» до «очень плохое» (1 и 6 баллов по шкале QoL соответственно). Тотальное СНМ отмечено у 5 пациентов, качество жизни ими было оценено как «плохое» и «очень плохое» (5 и 6 баллов по шкале QoL соответственно). Четыре (7,1%) пациента предъявили жалобы на вновь развившееся ослабление струи мочи, что в основном причиняет им дискомфорт (СНМ при этом имеется у 2 пациентов). Восемь (14,3%) пациентов, полностью удерживавших мочу и не отмечавших обструктивной симптоматики, оценили качество своей жизни как «очень хорошее» и «хорошее» (0 и 1 балл по шкале QoL соответственно). Такой широкий разброс оценок качества жизни не позволяет судить о типичном уровне качества жизни после эндоскопической коррекции ВУА: средний балл по шкале QoL оказался равным 2,54 (σ=0,73; Cv=28,6%).

При оценке влияния количества перенесенных эндоскопических коррекций на качество жизни пациентов и степень СНМ как в общей группе пациентов, так и в группе пациентов с рецидивом СВУА (перенесших 2 и более эндоскопических коррекций ВУА) не выявлено статистически значимых корреляционных связей (табл. 4).
Обсуждение. Ранняя диагностика и широкое внедрение программ скрининга РПЖ, совершенствование оперативной техники и инструментария привели к тому, что все больше больных РПЖ подвергаются оперативному лечению на ранних стадиях заболевания, что позволяет обеспечить 10-летнюю выживаемость на уровне примерно 92%. [7] Высокая ожидаемая продолжительность жизни пациентов после РПЭ диктует необходимость сохранения высокого качества их жизни. Соответственно, большое внимание уделяется функциональным результатам операции.
Незначительное количество исследований посвящено качеству жизни и частоте сопутствующего СНМ у пациентов со СВУА. C. Y. Zhang и соавт. [8] сообщают об изменении субъективной оценки качества жизни с «плохо» на «в общем удовлетворительно» и снижении среднего балла IPSS с 19 (17–24) до 7 (6–8) спустя 12 мес после баллонной дилатации ВУА. R. Wang и соавт. [9] утверждают, что у пациентов со СВУА через 12 мес после эндоскопической коррекции анастомоза не отмечается снижения качества жизни или усугубления степени СНМ по сравнению с группой пациентов без СВУА. Наше исследование, напротив, продемонстрировало значительно большую распространенность и выраженность сопутствующего СНМ, что оказывает серьезное влияние на субъективную оценку качества жизни пациентами, страдающими СВУА.
Развитие в послеоперационном периоде СНМ представляет собой серьезную, пугающую пациентов проблему [4]. Десоциализация, вызванная сопровождающим пациента запахом мочи и необходимостью ношения гигиенических адсорбирующих прокладок или памперсов, мацерация кожных покровов – факторы, обусловливающие выраженное снижение качества жизни пациентов.

Большинство авторов сходятся в оценке частоты развития послеоперационного СНМ, приводя цифры 6–8%. Так, например, в исследовании [10] из 1291 мужчины в возрасте от 39 до 79 лет спустя 18 мес после оперативного лечения инконтинентными оказались 8,4%.
Помимо широко известных предикторов развития послеоперационного недержания мочи, таких как возраст, индекс массы тела, индекс коморбидности, наличие симптомов нижних мочевыводящих путей в предоперационном периоде, многие авторы делают акцент на методике выполнения РПЭ. С широким внедрением в хирургическую практику системы daVinci появилась возможность более прецизионной и экономной резекции тканей, что позволяет снизить травматичность операции и риск послеоперационных осложнений. В систематическом обзоре [11] отмечено, что через 12 мес после РАРПЭ удержание мочи достигнуто 91% (89–92%) пациентов. При этом авторами выявлено достоверное преимущество РАРПЭ перед РППЭ (ОР – 1,53; 95% ДИ – 1,04–2,25; p=0,03).
С целью более раннего восстановления удержания мочи пациентам, перенесшим РПЭ, рекомендовано выполнение комплекса упражнений, предложенных в 1940-х гг. американским гинекологом Арнольдом Кегелем, направленных на развитие и укрепление мышц промежности, в частности поперечнополосатого сфинктера уретры. При сохраняющемся через 12 мес после операции СНМ пациенту могут быть предложены такие варианты лечения, как субуретральная петлевая пластика, имплантация искусственного мочевого сфинктера или использование различных зажимов, налагаемых на половой член.
Обструктивное мочеиспускание в послеоперационном периоде, одной из ведущих причин которого является развитие послеоперационного СВУА, помимо отрицательного воздействия на здоровье пациентов также оказывает выраженное дезадаптирующее влияние. К основным дезадаптирующим факторам относятся ослабление струи мочи, частое, зачастую болезненное мочеиспускание, эпизоды острой задержки мочи, персистирующая инфекция мочевых путей.
По данным разных авторов, частота развития СВУА среди пациентов, перенесших РПЭ, широко варьирует в пределах 0,7–10,6% [12, 13]. Казалось бы, не столь высокие цифры, однако постоянно растущее число выполняемых в мире РПЭ приводит к росту популяции больных СВУА. Так, если взять среднюю частоту развития СВУА за 5%, то в течение года в одних только США из 80 тыс. пациентов, перенесших РПЭ, СВУА будет диагностирован примерно у 5000 пациентов.
Основными факторами риска развития СВУА считаются выраженная интраоперационная кровопотеря, неадекватное сопоставление слизистых оболочек мочевого пузыря и уретры с последующей транссудацией мочи, избыточное натяжение в области ВУА [14, 15]. Обсуждается роль различных типов швов, которыми формируется анастомоз [16–18]; количества и вида перенесенных биопсий предстательной железы; перипростатического воспаления [19]; адъювантной или сальважной дистанционной лучевой терапии [17]; миграции сосудистых клипов, используемых для осуществления гемостаза, в зону анастомоза [20]; предшествующей радикальному лечению трансуретральной резекции простаты [18] а также опыта хирурга в выполнении данного оперативного пособия [21].
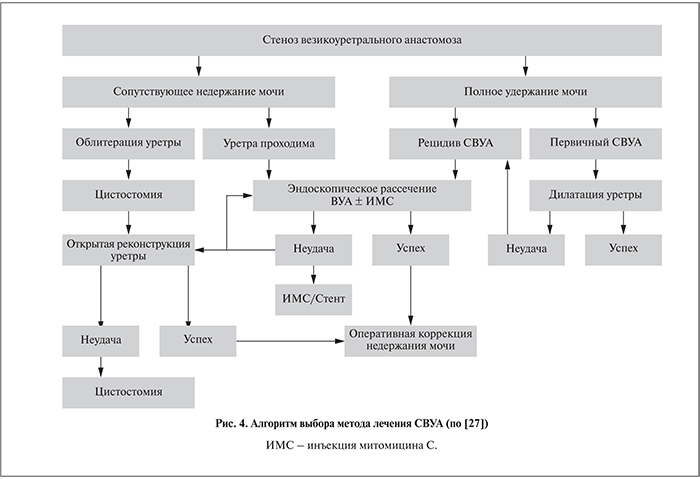
На сегодняшний день не существует единого подхода к лечению СВУА. Разными специалистами в качестве основных приводятся такие способы оперативной коррекции ВУА, как трансуретральная электрорезекция рубцовой ткани или рассечение рубцовой ткани «холодным ножом» с дополнительным (при необходимости) введением в зону рубца митомицина С [22–24]. Рекомендуются такие способы, как вапоризация рубцовой ткани гольмиевым лазером [25, 27, 28] и даже брахитерапия с использованием зерен иридия-192 [26]. Некоторые авторы сообщают об эффективности бужирования и баллонной дилатации ВУА [8, 23]. Данные об эффективности этих методов разнятся. Стоит отметить, что у ряда пациентов имеется тенденция к рецидивированию СВУА.
В обзоре, посвященном методам лечения послеоперационного СВУА, представлен алгоритм выбора тактики лечения пациентов (рис. 4) с оговоркой, что имеющиеся данные об эффективности различных методик оперативной коррекции ВУА широко варьируют от 47 до 100% и основаны эти данные на малом числе наблюдений [27]. Отмечено, что выбор метода коррекции ВУА должен основываться на жалобах, предъявляемых каждым конкретным пациентом, степени выраженности симптомов и индивидуальных анатомических особенностях.
В своей работе мы придерживаемся данной схемы и аналогичной тактики.
Эндоскопические вмешательства широко применяются для коррекции стриктур переднего отдела уретры. Однако доказано, что после неоднократных внутренних оптических уретротомий частота развития рецидивов стриктуры уретры существенно увеличивается и раннее выполнение уретропластики дает значительно лучший долгосрочный положительный результат. Тем не менее на сегодняшний день не ясно, позволяют ли повторные эндоскопические коррекции достигать удовлетворительного положительного результата в случае рецидивов СВУА. В нашем исследовании общая эффективность эндоскопических коррекций ВУА при медиане наблюдения более 12 мес составила 85%. При этом эффективность первичной и повторных эндоскопических коррекций варьировала от 21,2 до 66,7%. Полученные данные соответствуют результатам недавно опубликованного исследования J. R. LaBossiere и соавт. [29]. Авторы продемонстрировали 91%-ную общую эффективность эндоскопических коррекций ВУА, одному пациенту было выполнено в среднем 2,1 вмешательства. Исследователи делают вывод, согласно которому СВУА успешно поддается эндоскопической коррекции, что позволяет избегать проведения сложных реконструктивных операций в большинстве случаев.
Как продемонстрировало наше исследование, сопутствующее СНМ встречается более чем у половины пациентов с СВУА как до (64,3%), так и после (82,1%) эндоскопической коррекции ВУА. Прослеживается явная тенденция к усугублению степени инконтиненции после оперативной коррекции ВУА, хотя она как во всей группе пациентов, так и в группе пациентов, перенесших 2 и более эндоскопических коррекций ВУА, статистически не значима. Объяснить данную тенденцию можно тем фактом, что в ходе формирования СВУА рубцово-склеротический процесс затрагивает все слои мембранозного отдела уретры и шейки мочевого пузыря. Таким образом, как внутренний, так и наружный сфинктеры мочевого пузыря оказываются частично или полностью скомпрометированными и вовлеченными в рубцовый процесс. При повторных эндоскопических коррекциях ВУА сфинктерные механизмы повреждаются еще больше, что усиливает СНМ. Применение консервативных методик лечения послеоперационного СНМ, таких как изменение образа жизни, тренировка мышц тазового дна и мочевого пузыря, использование биологической обратной связи, будет малоэффективным.
«Золотым» стандартом и наиболее эффективным методом лечения пациентов с послеоперационным СНМ является имплантация искусственного мочевого сфинктера [30]. Однако стоит помнить, что нестабильность просвета уретры и риск ее облитерации у пациентов с упорно рецидивирующим СВУА служат противопоказанием к данной операции [31]. Таким образом, полноценное восстановление качества жизни пациентов с СВУА и СНМ должно предусматривать как эффективное устранение СВУА, так и коррекцию СНМ (чаще всего имплантация искусственного мочевого сфинктера). Иными словами, лечение пациентов с СВУА является, по сути, двухэтапным.
На сегодняшний день есть данные об успешном применении различных техник открытой реконструкции ВУА в отношении пациентов со стенозом или полной облитерацией ВУА [32, 33]. Авторы сообщают о стабильном положительном эффекте операции, отсутствии признаков рецидива СВУА через 14–120 мес наблюдения. Отмечается, что после открытой реконструкции ВУА фактически у всех пациентов развивается тотальное СНМ, что в последующем требует имплантации искусственного мочевого сфинктера. Однако применительно к пациентам с уже имеющимся сопутствующим СНМ имплантация искусственного мочевого сфинктера – это не коррекция осложнения открытой реконструкции ВУА, а запланированный этап оперативного восстановления нормального акта мочеиспускания.
Наше исследование имело некоторые ограничения. В связи с тем что обследование пациентов проводилось по принципу телефонного опроса, мы могли судить об отсутствии рецидива СВУА и об эффективности эндоскопических коррекций ВУА лишь на основании субъективных признаков; нами не были получены объективные подтверждения отсутствия рецидива СВУА (данные урофлоуметрии, фиброуретроцистоскопии). Эндоскопические коррекции ВУА выполнялись пятью хирургами, что могло привести к тем или иным различиям в выполнении манипуляций. Не все пациенты смогли точно назвать тип используемых урологических прокладок, что могло сделать оценку степени СНМ несколько неточной. В процессе оценки эффективности эндоскопической коррекции ВАУ мы не принимали во внимание тот факт, что использовались различные методики эндоскопической коррекции, однако доли лазерной вапоризации и рассечения рубца «холодным» ножом в общей группе столь малы, что вряд ли они могли значительно повлиять на результаты исследования.
Выводы
- Рост частоты выполнения РПЭ приводит к увеличению количества случаев СВУА и сопутствующего СНМ.
- При ретроспективном анализе распространенности СВУА отмечена существенно меньшая частота его возникновения после РАРПЭ по сравнению с РППЭ, что можно объяснить значительно меньшей травматичностью оперативного пособия, более экономной резекцией шейки мочевого пузыря и мембранозной уретры, лучшим сопоставлением краев слизистой уретры и мочевого пузыря, более уверенной герметичностью накладываемого ВУА.
- В ходе исследования выявлена высокая частота сочетания СВУА и СНМ, отмечено достоверное улучшение субъективной оценки пациентами качества жизни после эндоскопической коррекции ВУА, что обусловлено изменением паттерна расстройств мочеиспускания, оказывающих основное негативное влияние на качество жизни.
- Несмотря на явную тенденцию к усилению тяжести инконтиненции у пациентов с рецидивным СВУА, не выявлено статистически значимых корреляций между количеством перенесенных эндоскопических коррекций ВУА и степенью выраженности СНМ, а также уровнем качества жизни. Однако этот вопрос требует дальнейшего изучения на более обширных выборках пациентов.
- При оценке эффективности первичной и повторных эндоскопических коррекций ВУА наблюдалось снижение их эффективности от 1-й к 3-й попытке и вновь высокий процент успешных коррекций после 5-й и более попыток. Возможно, это связано с относительно небольшим количеством наблюдений, когда было сделано 4 и более попыток эндоскопической коррекции ВУА.
- Полученные данные не позволяют дать четкий ответ, после какого по счету рецидива СВУА стоит обсуждать с пациентом варианты открытой реконструкции. Данный вопрос должен стать предметом дальнейших исследований.
- Имеющиеся данные об эффективности различных методик оперативной коррекции ВУА и предложенные на их основе алгоритмы лечения основаны на исследованиях, не обладающих достаточной степенью достоверности. Поиск в этом направлении должен продолжаться.
- Многообещающими выглядят сообщения об открытой реконструкции ВУА с последующей оперативной коррекцией СНМ. Однако для формирования достоверных рекомендаций требуются дальнейшие исследования.
Работа выполнена при поддержке РНФ, соглашение № 16-15-00233.



