Все больше исследований свидетельствуют о тенденции к росту заболеваемости инфекциями мочевых путей (ИМП) по всему миру. Одной из нозологических форм в структуре ИМП является острый пиелонефрит (ОП), который может приводить к серьезным, жизнеугрожающим осложнениям. Заболевание с каждым годом поражает все большее число людей, а его течение становится все менее предсказуемым и управляемым в силу ряда объективных причин. Нет сомнений в том, что наиболее эффективно управлять течением заболевания позволяют его раннее выявление, предсказуемость характера течения в зависимости от этиологических и патогенетических факторов, достоверность оценки индивидуализированных рисков на основе ключевых факторов. Именно эти задачи следует сегодня решать с тем, чтобы пролить свет на малоизученные аспекты в вышеупомянутых вопросах.
Настоящая работа проведена с целью анализа имеющихся в мировой литературе данных, касающихся эпидемиологии, этиологии и предрасполагающих факторов развития ОП.
Поиск публикаций осуществляли в базах данных медицинской литературы The Cochrane Database, MEDLINE/PubMed Database, eLIBRARY, ClinicalKey с использованием оператора SQL и ключевых слов «acute pyelonephritis»/«APN» AND «epidemiology»/«incidence»/«frequency»/«etiology»/«factors». Представленный материал включает среди прочих 43 источника за последние 10 лет, из которых 31 публикация за последние 5 лет: наиболее крупных и репрезентативных исследований, отражающих актуальную ситуацию с ОП в популяции пациентов, проживающих на разных территориях и при различных экзогенных и эндогенных условиях.
Эпидемиология
Согласно данным О. И. Аполихина и соавт. [1], число пациентов с заболеваниями мочеполового тракта с 2002 по 2009 г. в России выросло с 12 397 693 до 15 597 948, т.е. на 25,8%. Аналогичная динамика характерна и для относительных значений. Так, показатели в пересчете на 100 тыс. населения также увеличились с 8675,6 до 10 991,9, или на 26,7%. Анализируя динамику регистрации больных гломерулярными, тубулоинтерстициальными, а также другими заболеваниями почек и мочеточников, авторы продемонстрировали рост заболеваемости на 5,8%: с 2 178 807 до 2 304 480. Острый пиелонефрит в России регистрируется с частотой порядка 1,3 млн случаев в год [2]. В 2007–2017 гг. заболеваемость ОП среди военнослужащих пациентов урологических отделений Алтайского края России имела неустойчивый характер. Наиболее высокий уровень заболеваемости отмечен в 2010 г. (59,03±1,55 на 100 тыс. населения), самый низкий – в 2014 г. (42,11±1,32 на 100 тыс. населения) [3].
В одном из крупных исследований распространенности ОП в США, охватившем около 5000 пациентов с января 1997 по декабрь 2001 г., заболеваемость ОП в год составила 15–17 случаев на 10 тыс. населения в женской популяции и 3–4 случая на 10 тыс. населения в мужской популяции. Авторами отмечена стабильность этих показателей за весь период исследования при росте уровня антибактериальной устойчивости патогенов [4]. Со временем ситуация изменилась и заболеваемость ОП в США оценивалась уже на уровне 27,6 случая на 10 тыс. населения [5], при этом авторами также отмечено увеличение показателя антибиотикорезистентности уропатогенов. В Южной Корее уровень заболеваемости ОП отличается от такового в США почти в 1,5 раза. Так, частота ОП на этой территории составляет 39,1 на 10 тыс., возрастая из года в год (35,6 в 2010 г.; 36,7 в 2011 г., 38,9 в 2012 г., 40,1 в 2013 г., 43,8 в 2014 г.; p=0,004). Ограниченные данные на Тайване демонстрируют показатель 23,44 на 10 тыс. женщин. Однако в Канаде средние показатели госпитализации при ОП составили 10,86±0,51 на 10 тыс. женщин и 3,32±0,27 на 10 тыс. мужчин [6–9].
Крайне важными представляются данные Глобального исследования распространенности инфекций в урологии (GPIU), призванного сформировать целостный взгляд на проблему внутрибольничных ИМП. С 2003 по 2010 г. среди 19 756 пациентов 9,4% имели диагноз нозокомиальной ИМП, из них около 70% были женщины. Распространенность ОП составила 20%, став третьей по частоте причиной госпитализаций после асимптоматической бактериурии и цистита [10].
Сравнение данных о различных нозокомиальных ИМП в 2003/2004 и 2008 гг. показало, что распространенность тяжелых вариантов инфекционного процесса, таких как пиелонефрит и уросепсис, возросла, а последующий сравнительный анализ с данными 2013 г. эту тенденцию подтвердил [11]. Доказанной представляется и значительная зависимость эпидемиологических показателей от региона. Так, детальное исследование GPIU в Азии за десятилетний период (2004–2013) продемонстрировало превалирующую распространенность именно ОП (30,7%) [12].
Гендерное соотношение также зависит от региона распространения. Так, в США уровень заболеваемости в женской популяции в 4–5 раз выше, чем в мужской, тогда как в Южной Корее диагноз ОП диагностируется у женщин примерно в 11 раз чаще, чем у мужчин [6].
Важно понимание распределения частоты встречаемости ОП в разных возрастных периодах в популяции (табл. 1).

Увеличился средний возраст больных внебольничным ОП, о чем свидетельствует сравнительный анализ характеристик популяции пациентов в Южной Корее в 2017–2018 гг. по сравнению с 2010–2011 гг. Согласно этому исследованию, объединившему данные 821 пациента, средний возраст больных вырос с 55,8 до 60,7 года. Авторы считают, что также значимо выросла частота бессимптомного течения заболевания [13].
Следует учитывать тот факт, что ОП приводит к госпитализации в женской популяции почти в 5 раз чаще (11,7 против 2,4 на 10 тыс. случаев), а также то, что летальные исходы регистрируют у женщин вдвое реже, чем у мужчин (7,3 против 16,5 на 1000 случаев) [14].
При нозокомиальном ОП популяция пациентов характеризуется более зрелым возрастом и более высокой частотой сопутствующих заболеваний. В этой группе больше мужчин, чем при внебольничном ОП, что, вероятнее всего, обусловлено обструктивной уропатией, связанной с заболеваниями предстательной железы [15].
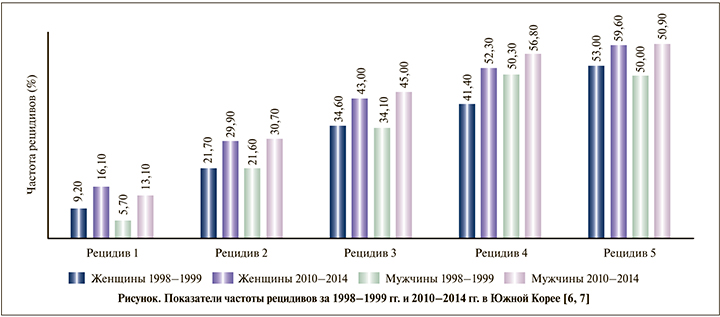
Каждый новый эпизод ОП увеличивает вероятность развития очередного рецидива (см. рисунок). Такая динамика характерна и для мужчин, и для женщин. Если сравнить показатели частоты рецидивов, опубликованные авторами Южной Кореи за 1998–1999 и 2010–2014 гг., то можно заметить выраженный подъем показателей за 15-летний промежуток времени как среди женщин, так и среди мужчин [6, 7].
Этиология
Достоверно доказано, что моча здоровых детей, женщин и мужчин всех возрастных групп нестерильна [16–20]. При этом сходство при гендерном анализе заключается в доминировании коагулазоотрицательных стафилококков (КОС) и коринебактерий, а различия, которых намного больше, позволяют выделить определенные «мужской» и «женский» спектры микробиоты [21]. При ИМП стало сложнее интерпретировать микробные паттерны. Известно, что более частыми патогенами при ИМП являются грамотрицательные палочки. В США, как и на других территориях, представленность микроорганизмов при цистите и пиелонефрите во многом схожа, но разнится по частоте. Так, E. coli вызывает 81–84% случаев пиелонефрита в женской популяции, 71–74% – в мужской; такие уропатогены, как, например, Klebsiella, Citrobacter, и виды Enterococcus встречаются чаще у мужчин [4]. Выяснено, что при остром обструктивном пиелонефрите энтеробактерии выделяют в 76% случаев, причем почти в 48% случаев это E. coli, в 31% – КОС, в 21% – коринебактерии, в 10% – грамотрицательные бактерии, энтерококки, золотистый стафилококк и кандиды – суммарно в 21% случаев [22, 23].
При осложненных, в частности катетер-ассоциированных, нозокомиальных ИМП, E. coli также остается преобладающим уропатогеном, но при этом возрастает роль других аэробных грамотрицательных бактерий, таких как Pseudomonas aeruginosa (~15%) и P. mirabilis (~7,5%), Klebsiella, Citrobacter, Acinetobacter и Morganella. Грамположительные микроорганизмы Enterocccus, S. аureus и грибы рода Candida также являются важными патогенами при осложненных ИМП. В целом S. saprophyticus и Enterococcus вызывают до 23% случаев осложненного ОП, а КОС и S. agalactiae суммарно обусловливают до 8% случаев [24]. Дрожжеподобные грибы рода Candida выделяются из мочи при ОП примерно в 1% случаев [25]. Однако отсутствуют исследования достаточного уровня доказательности, способные пролить свет на пути заражения и нарушения иммунного статуса, происходящие при грибковом поражении чашечно-лоханочной системы, а потенциальные результаты открытий в этой области ожидаемо будут сложны и многообразны ввиду высокой вариативности межвидовых взаимосвязей с другими представителями микробиоты, их взаимодействия с уротелием, а также характера и особенностей врожденного и адаптивного иммунитета [26]. Так, в случае формирования сгустка клеточной массы гифов дрожжеподобных грибов в собирающей системе у пациента может развиться олигурия и усилиться боль. Образуясь в мочевом тракте, такие сгустки могут оставаться бессимптомными до тех пор, пока не вызовут закупорку мочеточников или мочеиспускательного канала. При этом у пациентов с постоянным мочевым катетером будут отсутствовать дизурия или учащенное мочеиспускание, а также какие-либо специфичные жалобы, а пациенты отделения интенсивной терапии часто и вовсе не способны сообщить о каких-либо симптомах [15, 27–29].
Наличие отрицательной культуры мочи в ряде случаев объясняется предшествовавшим исследованию лечением, а также принятой более 50 лет стандартной методикой культурального исследования мочи. При неосложненном пиелонефрите частота расхождения результатов культурального исследования мочи и крови редко превышает 3%, однако при осложненном течении заболевания подобное явление встречается чаще – до 12%, причем в 2/3 случаев наблюдается бактериемия при отрицательном бактериологическом исследовании мочи [30]. Наиболее важным фактором, определяющим степень агрессивности микроорганизмов и их устойчивость к противомикробным препаратам, является условие приобретения инфекции. Так, известно, что показатели заболеваемости и смертности, а также профили антибактериальной устойчивости бактерий, выделяемых у пациентов, длительно находящихся на стационарном лечении, имеющих постоянный катетер, а также недавно перенесших вмешательства на органах мочевого тракта, отличаются от показателей в популяции больных в целом. Однако не обнаружено достоверной взаимосвязи уровней резистентности патогенов с полом, возрастом и сопутствующими заболеваниями [15].
Следует отметить, что среди пациентов старшей группы E. coli встречается реже (60%), а у людей с сахарным диабетом (СД) наблюдается более широкое распространение инфекций, вызванных Klebsiella, Enterobacter, Clostridium или Candida, по сравнению с общей популяцией [5].
Будучи доминирующими патогенами, штаммы E. coli в целом качественно различаются между собой при инфекциях, возникших в разных условиях и биотопах, о чем свидетельствуют исследования о различиях в спектре экспрессируемых факторов вирулентности. Так, у пациентов, госпитализированных с диагнозом ОП, отмечается заметно большее разнообразие генов факторов вирулентности, чем у амбулаторных больных циститом, что характеризует более сложное адаптационное поведение E. coli в случае ОП. Так, гены pap, кодирующие адгезины P-фимбрий, гены traT, отвечающие за синтез белка наружной мембраны, повышают возможности сывороточной резистентности, гены aer, ответственные за систему сидерофоров, а также гены секреторных токсинов hly и опероны «островков патогенности» оказались более распространенными среди штаммов, выделенных из мочи пациентов с ОП, чем с циститом [31–33].
Представляется, что одним из важнейших факторов роста частоты встречаемости ОП в современном мире является стремительная эволюция штаммов E. coli. Так, первым обратившим на себя внимание в 2000-х гг. стал клон ST131 E. coli, обладающий устойчивостью к противомикробным препаратам и обширным профилем вирулентности. Сегодня этот штамм все чаще выявляется как при внебольничных, так и при нозокомиальных ИМП [34].
В клинико-экспериментальном исследовании Л. А. Синяковой и соавт. [35] показана возможная этиологическая роль таких атипичных возбудителей, как Ureaplasma urealyticum и Chlamydia trachomatis, в развитии ОП. Причем патологический процесс протекал с особенностями: баллонная дистрофия эпителия чашечно-лоханочной системы в ранние сроки эксперимента и отсутствие выраженной гранулоцитарной реакции, что при хламидийной инфекции отличается только отложением кальцинатов в канальцах, однако в сочетании с инокуляцией E. coli формирует диффузно-очаговую лимфоидную инфильтрацию с появлением эозинофильных гранулоцитов. При обструкции мочеточника неклостридиальные анаэробные бактерии, в частности Peptococcus niger, Eubacterium spp., Propionibacterium spp., Bacteroides spp., проявляют себя как полноправные этиологические факторы в экспериментальной модели ОП, а микст-инфекция (E. coli и P. niger) протекает тяжелее моноинфекции, что говорит о взаимном усилении патогенного потенциала микроорганизмов [36].
Большинство авторов сходятся во мнении, что постоянно усложняющееся поведение микробных сообществ и нередкая несостоятельность эмпирических подходов, а зачастую и их заметное способствование распространению множественной антимикробной устойчивости требуют проведения исследований, направленных на индивидуализированную оценку качественных и количественных показателей уропатогенов, а также путей их транслокации из различных биотопов в органы мочевой системы. Т. С. Перепанова и соавт. [37], давая характеристику возбудителям ИМП, также пришли к заключению, что на сегодняшний день нет четкого понимания механизмов формирования и условий реализации патогенного потенциала возбудителей, их роли в развитии воспалительных заболеваний и состояния факторов местного иммунитета.
Факторы риска и условия развития заболевания
Факторы риска и условия развития ОП обобщены в табл. 2.
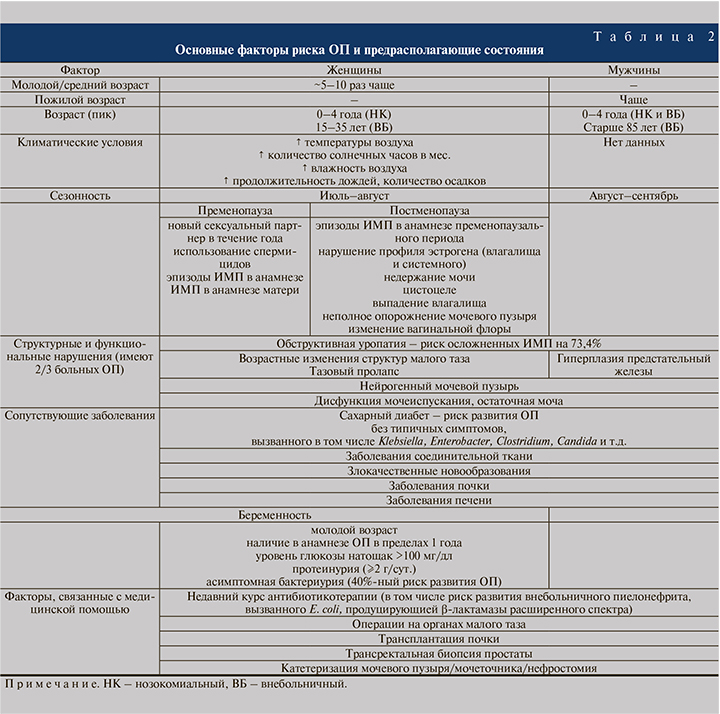
Понимая под факторами риска те условия, внешние и/или внутренние, которые повышают вероятность развития заболевания, и те причины, которые утяжеляют течение ИМП, в том числе ОП, отечественные авторы выделяют следующие блоки. 1. Эндогенные факторы – дисбиотические состояния кишечника, острые кишечные и вирусные инфекции, патология ЖКТ и печени, иммунодефицитные состояния и др.; экзогенные факторы – контакт с уропатогенами, антибиотико- и химиотерапия и др. Данные факторы играют ведущую роль на первом, преморбидном, этапе. 2. Среди экзогенных факторов на этапе транслокации выделяют стрессовые воздействия, антибиотико- и химиотерапию, экзотоксиканты, а основные эндогенные факторы сходны с таковыми на преморбидом уровне. 3. В процессе колонизации ключевыми внутренними факторами становятся наличие в органах мочевой системы рецепторов к уропатогенам, нарушение пассажа мочи. 4. Этапу альтерации способствуют тубулоинтерстициальные нефриты различной этиологии, рефлюкс-нефропатии, мочекаменная болезнь, иммунодефицит и вышеупомянутые факторы внешней среды. 5. И наконец, на этапе санации или персистенции ведущими эндогенными условиями служат нарушения гемо- и лимфодинамики, иммунодефицит, а среди экзогенных неизменно присутствую экзотоксиканты, антибиотико- и химиотерапия [38].
По данным [5], около двух третей пациентов с ОП страдают функциональными или структурными нарушениями мочевыводящих путей, а недавнее применение антибиотиков и обструктивная уропатия ассоциируются с развитием осложненной ИМП в 95,3 и 73,4% случаев соответственно. К тому же такие больные более склонны к плохо поддающемуся пероральной терапии или осложненному бактериемией ОП. Возраст – старше 55 лет, антибиотикотерапия в течение предыдущего года, сахарный диабет представляет собой факторы существенного риска развития внебольничного пиелонефрита, вызванного кишечной палочкой, продуцирующей β-лактамазы расширенного спектра. Предикторами же тяжелого течения инфекционного процесса в мочевыводящих путях служат камни, опухоли, аномалии и стенозы мочевых путей. Оперативные вмешательства на органах малого таза, а также различные манипуляции (катетеризация, трансректальная биопсия простаты) представляют собой предрасполагающие условия для заноса бактерий в изначально интактные зоны.
Пожилые люди более восприимчивы к инфекциям в связи с наличием сопутствующей патологии, острых воспалительных заболеваний мочевыводящих путей и сниженного иммунного ответ (например, в результате использования стероидных средств). Кроме того, у пожилых людей реже можно встретить типичные симптомы инфекций верхних мочевыводящих путей.
Для ОП, вызванного E. coli, основными предрасполагающими факторами являются камни в мочевыводящих путях и связанные с ними обструкции, тогда как Klebsiella чаще выделяют при катетеризации мочевого пузыря [13, 39, 40]. При ОП, вызванном стрептококком группы В, ведущим служит гематогенный путь заражения. В животной модели на мышах исследователями было доказано, что при ОП, вызванном данными микроорганизмами, фактором прогноза является, скорее всего, транзиторная бактериемия, нежели предшествовавшие эпизоды ИМП [41].
Наиболее распространенной сопутствующей патологией у женщин молодого и зрелого возраста является СД, встречающийся у 25–50% пациентов с ОП [42]. В данной когорте пациентов чаще регистрируют бактериемию, а сами пациенты нуждаются в более длительной госпитализации [43].
В целом у пациентов с сопутствующим пиелонефриту СД реже наблюдаются типичные симптомы заболевания, такие как боль в боку или симптомы инфекции нижних мочевых путей, а наличие СД у женщин сразу классифицируется некоторыми клиницистами как осложненное течение ИМП, хотя вопрос остается дискутабельным ввиду мнения других экспертов, считающих, что ИМП у женщин с хорошо контролируемым течением СД в отсутствие других факторов следует все же относить к группе неосложненных инфекций [31, 42–45]. Т. С. Перепанова и соавт. [46] отмечают, что при наличии СД риск развития пиелонефрита возрастает в 7–8 раз. В качестве основных причин авторы выделяют не только глюкозурию, благоприятствующую размножению микрофлоры в урогенитальном тракте, но и нарушение уродинамики вследствие диабетической нейропатии, снижение перфузии тканей почек (интерстициальной ткани и чашечно-лоханочной системы), а также иммунологические нарушения.
У молодых здоровых женщин в пременопаузальном периоде наиболее распространенными предрасполагающими факторами ОП являются недавние половые контакты, использование спермицидов, а также наличие ИМП в анамнезе. Женщины в постменопаузе подвержены повышенному риску ОП по ряду причин: более низкие уровни влагалищного и системного эстрогена, который, как считается, играет роль в сохранении функции мочевого пузыря, поддержании рН влагалища и ее нормальной микрофлоры; эпизоды ИМП в анамнезе; недержание мочи; цистоцеле; выпадение влагалища; неполное опорожнение мочевого пузыря и изменение вагинальной микрофлоры [44, 47].
Результаты обследования 15 тыс. женщин с ОП за 14 лет на Тайване показали, что чем выше температура воздуха, влажность, больше солнечных дней в месяце, а также продолжительность дождей и объем осадков, тем выше ассоциация с ростом заболеваемости ОП. Более того, температура, количество дождевых дней и влажность имеют достоверную линейную корреляцию с уровнем заболеваемости ОП [9]. Данные 14-летнего анализа сезонности ОП на Тайване схожи с таковыми в США, демонстрирующими пик заболеваемости в июле–августе для женщин и августе–сентябре для мужчин [4, 9]. Сезонность авторы исследований объясняют тремя группами факторов: появлением и исчезновением патогенных микроорганизмов, изменением окружающей среды и изменением поведения хозяина [7].
Одним из важнейших состояний, сопряженных с особенно высоким риском развития ОП у женщин, является беременность. В этом случае предикторами заболевания, согласно крупному исследованию, объединившему данные о 370 248 пациентках, служат более молодой возраст, наличие в анамнезе предшествовавшего эпизода ОП в пределах 1 года до беременности, высокий уровень глюкозы натощак (>100 мг/дл) и протеинурия [48]. Во время беременности вследствие стаза мочи, вызванного, возможно, механической непроходимостью и снижением тонуса мочевого пузыря и мочеточника из-за гормональных изменений, повышается восприимчивость к мочевой инфекции. Кроме того, высокий уровень гликозурии и экскреции прогестина и эстрогена с мочой может приводить к снижению устойчивости мочевыводящих путей к бактериальной инфекции. Таким образом, следует обследовать всех беременных на предмет выявления бессимптомной бактериурии [49–53].
Сравнительный анализ данных пациентов начала и конца десятилетия позволяет говорить о возрастающей доле коморбидности в группе больных ОП: заболеваний соединительной ткани, патологии печени и почек, злокачественных новообразований. Подтверждает значимость роли нарушений уродинамики в развитии заболевания достоверный рост встречаемости доброкачественной гиперплазии предстательной железы и нейрогенного мочевого пузыря в популяции [13].
Анализ литературы свидетельствует о разрозненности и ограниченности данных при сравнении заболеваемости ОП в разных странах и различных периодах времени. Отсутствует системность в подходах к оценке и представлении информации в разных регионах. Мировой опыт позволяет отмечать тенденцию к изменению демографического портрета больного острым пиелонефритом, однако мозаичность данных не дает возможности провести более детальный сравнительный анализ в четко определенных клинических подгруппах. Сложность внутринозологической структуры разновидностей ОП сегодня диктует целесообразность обновления подходов к проведению исследований в этой области. При этом само заболевание динамически эволюционирует вместе с его этиологическими агентами, характером социального поведения людей и условий среды в целом.
Согласно мнению исследователей, глобальный взгляд на проблему ОП позволит оперативно выявлять все новые закономерности, систематизировать получаемые данные и прогнозировать поведение болезни как на популяционном уровне, так и на уровне пациента и даже отдельных таксонов микробиоты.



