Введение. Одной из проблем современной репродуктивной медицины является снижение фертильности мужского населения. Этот процесс проявляется увеличением доли бесплодных браков и периодическим пересмотром нормальных значений концентрации сперматозоидов в эякуляте со снижением нижней границы нормы [1–3].
При анализе эякулята в первую очередь оценивают концентрацию и количество сперматозоидов, их подвижность и особенности морфологии [1–3]. Однако установлено, что на фертильность спермы существенное влияние оказывает состав семенной плазмы, который также характеризует состояние органов мужской репродуктивной системы и имеет определенное диагностическое значение [1–6].
В последние годы вырос интерес к исследованию различных белковых компонентов эякулята, в том числе традиционно исследуемых в сыворотке крови [7–11].
Одним из лабораторных тестов, вошедшим в практику клинико-диагностических лабораторий, является определение в крови белка, связывающего жирные кислоты (БСЖК). Данный белок является представителем группы структурно близких белков, обеспечивающих внутриклеточный транспорт жирных кислот, которые объединяют термином БСЖК. Они характеризуются относительно небольшой молекулярной массой порядка 12–16 кДа и классифицируются в зависимости от аминокислотного состава и тканевой локализации на ряд изоформ. Выделяют сердечную (H-FABP, FABP3), печеночную (L-FABP, FABP1), тонкокишечную (I-FABP, FABP2), мозговую (B-FABP, FABP7), эпидермальную (E-FABP, FABP5), адипоцитарную (A-FABP, FABP4) и тестикулярную (T-FABP, FABP9) изоформы [12–16].
Традиционно в литературе наибольшее внимание уделяется изучению клинико-диагностической роли сердечной изоформы БСЖК [12, 14, 17]. Определение уровня БСЖК в других биологических жидкостях ограничено исследованиями экссудатов, ликвора и мочи [18–20]. В доступных источниках нами обнаружена единственная публикация с результатами определения концентрации БСЖК в эякуляте [21]. В связи с этим дальнейшее изучение уровня БСЖК в этой биологической жидкости представляет определенный интерес.
Цель исследования: изучить концентрацию БСЖК в сыворотке крови и образцах эякулята с нормальными и измененными характеристиками.
Материалы и методы. В исследование были включены 82 мужчины, средний возраст которых составил 33,1±4,7 года, проходивших обследование с целью уточнения причины бесплодного брака, у которых отсутствовали жалобы соматического характера и изменения в общем анализе крови и мочи, а также биохимическом анализе крови. Исследование выполнено с соблюдением этических принципов проведения медицинских исследований с участием людей в качестве субъектов, изложенных в Хельсинкской декларации ВОЗ, и было одобрено этическим комитетом ФГБОУ ВО «Пермский государственный медицинский университет им. академика Е. А. Вагнера» Минздрава России.
Образцы эякулята собирали после 2–4 дней полового воздержания и оценивали в соответствии с рекомендациями ВОЗ [3]. Объем эякулята определяли гравиметрически, рассчитывая разницу массы пустого контейнера и контейнера с материалом обследуемых. Вязкость образца оценивали по длине нити, образующейся при извлечении стеклянной палочки из эякулята [1]. Для подсчета концентрации и общего числа сперматозоидов, а также оценки их подвижности использовали анализатор спермы SQA–V («MES», Израиль). Кровь забирали методом венепункции кубитальной вены перед сбором эякулята. Сыворотку крови и семенную плазму отделяли центрифугированием образцов при 3000 об/мин.
Концентрацию БСЖК определяли методом твердофазного иммуноферментного анализа (ИФА) с использованием тест-системы «Белок, связывающий жирные кислоты, – ИФА-БЕСТ» («Вектор-Бест», Россия). Оптическую плотность проб регистрировали на вертикальном фотометре StatFax 3200 («Awareness», США).
В зависимости от результатов лабораторного анализа спермы обследованные были разделены на три группы. Основную группу (n=21) составили мужчины со сниженной фертильностью эякулята, обусловленной олигозооастеноспермией различной степени тяжести. Критерием включения стала концентрация сперматозоидов ниже 20 млн/мл или общее содержание сперматозоидов ниже 40 млн/эякулят [1].
Контрольная группа (n=33) была представлена обследованными с нормальными показателями эякулята: нормальной вязкостью, концентрацией сперматозоидов выше 20 млн/мл и общим содержанием сперматозоидов более 40 млн/эякулят [1].
В группу сравнения (n=28) были включены мужчины с синдромом вискозипатии эякулята при выявлении повышенной вязкости спермы (более 5 мм по тесту отрыва нити) [2]. Характеристика обследованных представлена в табл. 1.

Статистическую обработку результатов проводили с помощью пакета программ STATISTICA v. 7 («StatSoft Inc.». США). Для каждого массива данных рассчитывали параметры описательной статистики: среднюю арифметическую (М), стандартное отклонение (SD), медиану (Me) и интерквартильный диапазон (25%–75%), а также минимальное (min) и максимальное (max) значения. Массивы данных оценивали на наличие и степень выраженности выбросов.
 По результатам оценки с использованием критерия Шапиро–Уилка была отвергнута нулевая гипотеза о нормальном характере их распределения и равенстве дисперсий выборок, что послужило основанием для отказа от использования параметрических критериев при выполнении дальнейшего статистического анализа.
По результатам оценки с использованием критерия Шапиро–Уилка была отвергнута нулевая гипотеза о нормальном характере их распределения и равенстве дисперсий выборок, что послужило основанием для отказа от использования параметрических критериев при выполнении дальнейшего статистического анализа.
Для сравнения двух зависимых выборок использовали критерий Вилкоксона, для сравнения нескольких независимых – H-критерий Краскела–Уоллиса. Количественную оценку линейной связи между двумя случайными величинами определяли с использованием коэффициента ранговой корреляции (R) Спирмена. За максимально приемлемую вероятность ошибки первого рода (р) принимали величину уровня статистической значимости, равную или меньшую 0,05.
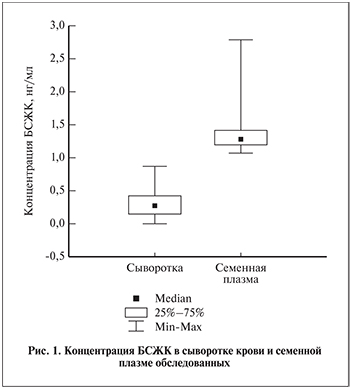
Результаты. У всех обследованных содержание БСЖК в семенной плазме превышало таковое в сыворотке крови более чем в 4 раза. Средние значения различались в 4,42 раза, медианы – в 4,54 (рис. 1). Концентрация БСЖК в сыворотке крови в целом по группе (n=82) равнялась 0,305±0,193 нг/мл, при этом медиана и интерквартильный диапазон составили 0,028 (0,16–0,43) нг/мл, а разброс значений показателя был невелик – от 0,007 до 0,81 нг/мл.
Среднее содержание БСЖК в семенной плазме было значительно выше (p<0,000001), составив 1,347±0,26 (1,27 (1,2–1,42)) нг/мл, и варьировало в диапазоне от 1,08 до 2,79 нг/мл.
Подобное соотношение содержания БСЖК в сыворотке крови и семенной жидкости наблюдалось во всех группах (табл. 2). При оценке корреляционной зависимости выявлено отсутствие достоверной зависимости между содержанием БСЖК в семенной плазме и сыворотке крови как для всех обследованных пациентов (R=0,068194), так и для каждой группы (табл. 2).
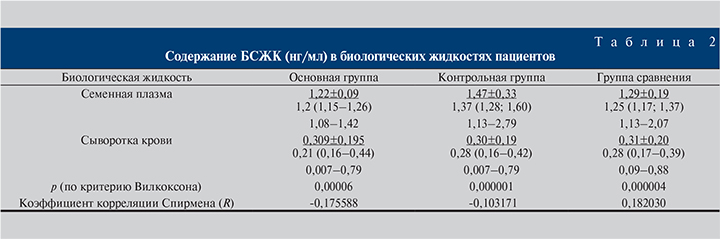
При сравнении результатов сывороточной концентрации БСЖК различия между группами отсутствовали (H=0,037479, p=0,9814; рис. 2, а). Для семенной плазмы, напротив, были установлены статистически значимые различия в содержании БСЖК (H=15,80519; p=0,0004; рис. 2, б). При попарном сравнении полученных данных установлены достоверные различия основной и контрольной групп (p=0,000057), а также между контрольной группой и группой сравнения (p=0,010822). При попарном сравнении других комбинаций достоверных различий выявлено не было.
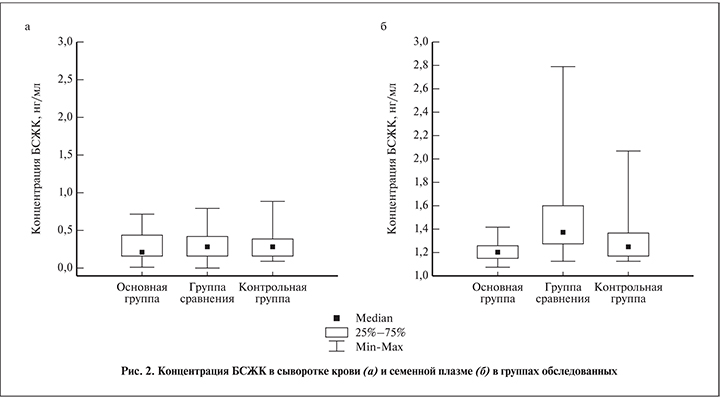
Содержание БСЖК в семенной плазме не зависело от сывороточной концентрации этого соединения, а также от объема и вязкости эякулята, но коррелировало с концентрацией сперматозоидов (R=0,66387) и описывалось уравнением линейного регресса, представленным на рис. 3.
 Обсуждение. Различные изоформы БСЖК представляют собой важные транспортные молекулы, переносящие жирные кислоты к митохондриям или пероксисомам, что в ходе реакций обмена веществ обеспечивает синтез значительного количества универсальных энергетических субстратов, которые могут использоваться клетками в самых различных процессах. Кроме того, они обладают высокой аффинностью и способностью связывать продукты окисления длинноцепочечных жирных кислот и могут быть эффективным эндогенным антиоксидантом [22, 23].
Обсуждение. Различные изоформы БСЖК представляют собой важные транспортные молекулы, переносящие жирные кислоты к митохондриям или пероксисомам, что в ходе реакций обмена веществ обеспечивает синтез значительного количества универсальных энергетических субстратов, которые могут использоваться клетками в самых различных процессах. Кроме того, они обладают высокой аффинностью и способностью связывать продукты окисления длинноцепочечных жирных кислот и могут быть эффективным эндогенным антиоксидантом [22, 23].
Относительно малый размер молекул БСЖК, их локализация в цитоплазме и тесная функциональная связь с митохондриями обеспечивают быстрый выход этих белков из различных тканей при их повреждении, что делает БСЖК чувствительным маркером повреждения клеток [12, 14, 17, 19].
Обнаружение БСЖК в семенной плазме свидетельствует о том, что данный белок синтезируется в клетках репродуктивной системы человека и выделяется в сперму, что подтверждается отсутствием корреляции между его уровнем в сыворотке крови и эякуляте.
Обнаружение БСЖК в эякуляте тест-системой, предназначенной для выявления сердечного изофермента БСЖК, может иметь несколько объяснений. Известно, что ткани характеризуются различным спектром изоформ белков. В связи с этим вполне допустим синтез изоформ БСЖК, характерных для миокарда, в органах репродуктивной системы. В литературе имеются публикации, в которых продемонстрировано присутствие в клетках и тканях изоформ, характерных для других органов [12, 13; например, в моче обнаружена печеночная изоформа БСЖК [16]. Кроме того, производители наборов для ИФА всегда допускают возможность неспецифического взаимодействия компонентов тест-системы с различными белками тканей и биологических жидкостей. Учитывая ограниченное количество работ по оценке уровня БСЖК в эякуляте, мы не можем исключить и такую причину его обнаружения в семенной плазме.
Однако, по нашему мнению, более высокое содержание БСЖК в эякуляте является специфической особенностью данной биологической жидкости. Данный факт может объясняться особенностями ее секреции семенной жидкости. Одним из условий подготовки к исследованию эякулята считается половой покой в течение 2–3 дней [1–3]. В этот период в органах репродуктивной системы происходит накопление сперматозоидов. Логично предположить, что при высокой скорости продукции этих клеток их накапливается больше, чем при низкой. Кроме того, известно, что в организме мужчины часть вырабатываемых сперматозоидов подвергается разрушению [24], что сопровождается высвобождением клеточных белков в семенную плазму. Таким образом, вполне вероятно, что более высокая концентрация БСЖК в сперме у лиц с высокой интенсивностью сперматогенеза является их физиологической особенностью. Низкое содержание БСЖК в эякуляте, возможно, указывает на низкую скорость сперматогенеза.
Выводы
- Концентрация БСЖК в семенной плазме более чем в 4 раза превышает таковую в сыворотке крови.
- Содержание БСЖК в семенной плазме коррелирует с концентрацией сперматозоидов и, возможно, отражает интенсивность сперматогенеза.
- Требуются дальнейшие исследования с целью определения патогенетического и диагностического значения анализа БСЖК в семенной плазме.



