Введение. Бесплодие – это сложная и актульная проблема репродуктологии. Примерно 15% сексуально активных пар не достигают беременности в течение 1 года и обращаются за лечением, а 5% пар остаются бездетными, несмотря на использование широкого арсенала методов лечения. У половины (50%) бездетных пар бесплодие связано с мужским фактором, проявляющимся отклонениями в параметрах эякулята [1]. Данный факт существенно влияет на качество жизни людей и обусловливает огромные социально-экономические издержки [2].
В 30–40% случаев не удается выявить причинный фактор бесплодия даже по результатам всестороннего обследования (идиопатическое бесплодие). У данных пациентов в анамнезе нет заболеваний, нарушающих фертильность, изменений при физикальном обследовании или в показателях гормональных, генетических и биохимических исследований. При этом при анализе эякулята выявляется снижение числа сперматозоидов (олигозооспермия), нарушение подвижности (астенозооспермия) и патология морфологических характеристик (тератозооспермия). Кроме того, часто данные виды патоспермии наблюдаются одновременно и обозначаются как олигоастенотератозооспермия (ОАТ-синдром) [3].
Усовершенствование методов диагностики заболеваний органов мочеполовой системы расширило понимание этиопатогенетической цепи, приводящей к мужскому бесплодию. [1]. В настоящее время существенная роль в развитии как мужского, так и женского бесплодия отводится инфекционному фактору. Доказана широкая вовлеченность микроорганизмов: бактерий, простейших, внутриклеточных паразитов [4].
В последние годы особое внимание уделяется вирусным инфекциям: они рассматриваются в числе возможных деструктивных агентов, которые влияют на мужскую фертильность. Прямые или опосредованные через аутоиммунные процессы токсические эффекты вирусных инфекций человека могут нарушать процессы сперматогенеза, включая метаболическую и двигательную активность сперматозоидов [5–7].
Активно изучается вопрос о причастности папилломавирусной инфекции (ПВИ) к развитию инфертильности, а также степень этого влияния [8].
Хорошо известен вклад ПВИ в развитие онкологических заболеваний мочевыводящих путей и репродуктивных органов как в мужской, так и в женской популяции [9, 10]. Кроме того, ПВИ является широко распространенным заболеванием, передающимся половым путем. Есть немало доказательств взаимосвязи ПВИ и появления генитальных бородавок, рецидивирующей инфекции нижних мочевыводящих путей [11, 12]. Согласно данным крупного метаанализа, среди фертильных мужчин доля инфицированных ВПЧ составила 10%, среди бесплодных мужчин – 16%, что свидетельствуют о причастности ПВИ к развитию инфертильности [13].
В последних мета-анализах сравнение числа бесплодных мужчин в группах мужчин с ПВИ и без таковой подтвердило ранее сформулированные выводы: ПВИ является фактором риска бесплодия с отношением шансов (ОШ) 2,93 и 3,02 соответственно [14, 15]. Авторы указали, что исследований с высококачественным дизайном все еще недостаточно, однако объем выборки, хорошая проработка дизайна обзоров обеспечивают обоснованность их заключений.
Механизм влияния вируса папилломы человека (ВПЧ) на репродуктивную функцию окончательно не установлен. Вероятно влияние на параметры спермы [16, 17]. Возможно, нарушаются процессы бластуляции или имплантации из-за встраивания ДНК вируса в ДНК хозяина и последующего дефектного развития зиготы [18]. Данные противоречивы.
В частности, изменяемый ВПЧ параметр спермы отличается от исследования к исследованию, а в некоторых сообщениях в экспериментальной группе средние показатели спермограммы и вовсе статистически значимо не отличаются от таковых в контрольной. Наконец, реализация генетического механизма исследована в основном in vitro и в единичных экспериментах на животных [19, 20].
Все большую актуальность приобретает вопрос профилактической и лечебной вакцинации мужчин от ВПЧ, а также потребности определения всех типов ВПЧ при использовании вспомогательных репродуктивных технологий (ВРТ) [21–23]. Это определяется ухудшением фертильного потенциала пар, получающих ВРТ, в которых мужчина инфицирован ВПЧ [23].
Несмотря на то что исследователи разносторонне оценили патогенное влияние на фертильность ПВИ в целом и отдельных типов вирусов в частности, мало данных об особенностях воздействия ПВИ в зависимости от количества типов ВПЧ и конкретных их комбинаций в сперме. На наш взгляд, результаты данного анализа помогут выделять группу риска (целевую группу) при отборе кандидатов на лечебную вакцинацию и специфическую очистку спермы при осуществлении ВРТ.
Цели исследования: изучить этиологическую структуру папилломавирусной инфекции (ПВИ) эякулята у мужчин с бесплодием, а также оценить влияние ВПЧ на параметры сперматозоидов (подвижность, количество, морфологию).
Материалы и методы. Проведен анализ результатов обследования 71 пациента в возрасте от 22 до 44 лет с диагнозом «бесплодие», сочетающимся с ПВИ, с отсутствием других факторов риска (врожденные или приобретенные аномалии мочеполовых органов, опухоли репродуктивных органов, варикоцеле, эндокринные нарушения, иммунологические факторы, инфекции мочевыводящих путей и репродуктивных органов). Диагноз «бесплодие» устанавливали на основании неспособности здоровой партнерши забеременеть в течение 1 года при регулярном сексе без контрацепции. Длительность заболевания до первичного обращения к врачу составила от 3 до 16 лет.
Оценка оплодотворяющей способности эякулята проводилась в соответствии с данными и параметрами, рекомендованными ВОЗ (2010) в клинико-диагностической лаборатории. Для идентификации типа вируса использован амплификационный метод ДНК-диагностики (полимеразная цепная реакция – ПЦР). Материалом для исследования служил эякулят.
 Результаты исследования обработаны в электронных таблицах Microsoft Excel из пакета программ Microsoft Office 2007. Статистическую обработку данных проводили с использованием статистического пакета STATISTICA 6.1 (StatSoftInc., США). Расчеты и интерпретацию результатов осуществляли согласно руководству О.Ю. Ребровой. Оценку соответствия распределения признаков закону нормального распределения проводили с применением критерия Шапиро–Уилка. Корреляционную связь оценивали ранговым коэффициентом корреляции Спирмена. Для сравнения распространенности патологии в двух группах применяли критерий χ2. Исследование соответствовало стандартам Хельсинкской декларации.
Результаты исследования обработаны в электронных таблицах Microsoft Excel из пакета программ Microsoft Office 2007. Статистическую обработку данных проводили с использованием статистического пакета STATISTICA 6.1 (StatSoftInc., США). Расчеты и интерпретацию результатов осуществляли согласно руководству О.Ю. Ребровой. Оценку соответствия распределения признаков закону нормального распределения проводили с применением критерия Шапиро–Уилка. Корреляционную связь оценивали ранговым коэффициентом корреляции Спирмена. Для сравнения распространенности патологии в двух группах применяли критерий χ2. Исследование соответствовало стандартам Хельсинкской декларации.
Результаты. По результатам анализа эякулята выявлены следующие варианты патозооспермии: астенозооспермия – 56% наблюдений, астенотератозооспермия – 21%, олигоастенотератозооспермия – 17% и олигоастенозооспермия – 6%.
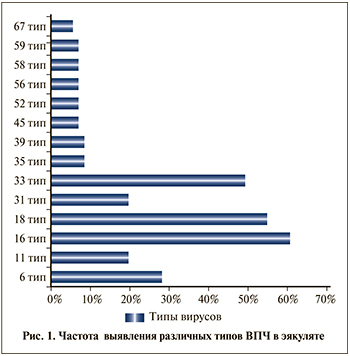
В этиологической структуре доминировали вирусы 16-го и 18-го типов, которые регистрировали у 60,7% и 54,9% пациентов соответственно. Реже выделяли 33-й тип – у 49,3% пациентов, 6-й – у 28,2% и 11-й – у 19,7% пациентов (p<0,05). Небольшой удельный вес составили 35 – 8,5% и 39 – 8,5%.
 В единичных случаях были выявлены следующие типы вирусов: 45,52,56,58,59 — по 7,0%, а 67 тип — 5,8% (p<0,05) (рис. 1).
В единичных случаях были выявлены следующие типы вирусов: 45,52,56,58,59 — по 7,0%, а 67 тип — 5,8% (p<0,05) (рис. 1).
В структуре-ПВИ чаще обнаруживали ассоциации нескольких вирусов (88,7%), реже – моноварианты. Наибольший удельный вес имели сочетания 16-го и 18-го, 16-го и 33-го, 18-го и 33-го типов ВПЧ (рис. 2).
Микст ВПЧ имела статистически значимую слабую обратную корреляцию с общей подвижностью сперматозоидов по сравнению с эякулятом, где был выявлен один тип вируса (r=-0,267, p=0,0244).
Комбинации 6-го и 11-го, 11-го и 16-го, 16-го и 33-го, 31-го и 33-го типов – статистически значимо более тяжелые изменения в эякуляте. В исследуемой группе пациентов олигоастенозооспермия в большинстве случаев наблюдалась при сочетании 31-го типа с 18-м и 33-м типами вируса, олигоастенотератозооспемия – при сочетании 11-го с 16-м типом вируса, а астенотератозооспермия – при ассоциации 11-го, 16-го, 18-го, 33-го вирусов (рис. 3).
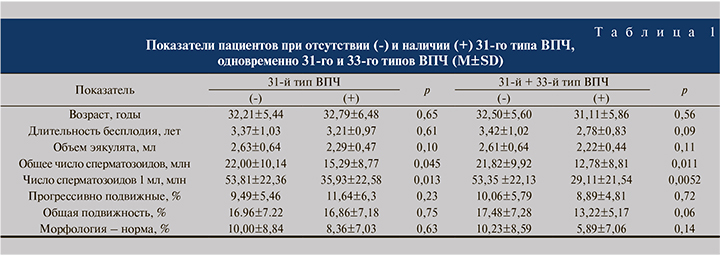
Несмотря на то что в большинстве случаев при наличии в эякуляте 33-го типа вируса отмечались тяжелые формы патоспермии, сравнение показателей эякулята в группе зараженных и в группе не зараженных ВПЧ 33-го типа не выявило статистически значимых различий. Однако при сравнении показателей эякулята в группе зараженных и в группе не зараженных ВПЧ 31-го типа установлено статистически значимое снижение общего количества сперматозоидов и сперматозоидов в 1 мл, где присутствовал ВПЧ 1-типа.
Кроме того, сочетание 31-го и 33-го типов ассоцировалось с более выраженным снижением общего количества сперматозоидов и количества сперматозоидов в 1 мл с большей статистической значимостью по сравнению с другими комбинациями и моноинфекцией ВПЧ 31-го типа. Микст папилломавирусная инфекция, сочетающая 31-й и 33-й типы вирусов, синергирует патогенный потенциал вируса и вызывает более тяжелую патологию эякулята (табл. 1).
Подобную картину наблюдали при оценке 6-го и 11-го типов. Параметры спермограммы групп с наличием или без ВПЧ 11-го типа статистически значимо не различались. Наличие ВПЧ 6-го типа статистически значимо влияло на прогрессивную и общую подвижность сперматозоидов. Сочетание 6-го и 11-го типов значительнее снижало прогрессивную и общую подвижность сперматозоидов по сравнению с другими комбинациями и моноинфекцией ВПЧ 6-го типа (табл. 2).

Обсуждение. В целом частотное распределение типов ВПЧ соответствовало результатам других исследований [15–17].
Несмотря на то что, по данным литературы, патогенез влияния ВПЧ на мужское бесплодие окончательно не установлен, предполагается, что эти механизмы, вероятно, могут быть связаны с нарушением параметров эякулята за счет воздействия патогенного потенциала вируса.
Кроме того, наши результаты демонстрируют существенные различия характеристик сперматозоидов в зависимости от типа, персистирующего ВПЧ.
Во-первых, определенные комбинации типов ВПЧ вызывают более широкий спектр патологии эякулята, а значит, обладают большим патогенным потенциалом и потенциируют повреждающие эффекты друг друга. Такими являются комбинации 6-го и 11-го, 11-го и 16-го, 16-го и 33-го, 31-го и 33-го типов вируса.
Во-вторых, конкретные сочетания типов ВПЧ могут усугублять ухудшение какого-либо параметра, вызванное одним из типов в комбинации, как это проявилось, например, с подвижностью сперматозоидов у зараженных сочетанием 6-го и 11-го типов ВПЧ или с количеством сперматозоидов у зараженных комбинацией типов вируса 31 и 33.
В-третьих, с увеличением числа различных типов ВПЧ даже вне зависимости от конкретного типа ВПЧ в сперме снижалась подвижность сперматозоидов. Простое ли их взаимодействие или повышение вероятности наличия в комбинированной инфекции определенных наиболее патогенных типов оказывало влияние в большей степени, однозначно сказать нельзя. Однако выявленные выраженные отличия при сравнении показателей в зависимости от наличия или отсутствия той или иной комбинации типов ВПЧ позволяют предполагать, что эти утверждения не противоречат друг другу: важно и количество типов ВПЧ, и их «качество», т.е. типовой состав.
Потенциально результаты исследования структуры типов ПВИ и поражения эякулята дают следующие преимущества. Во-первых, в клинической практике будет возможно оценить вероятность связи идиопатического бесплодия и ВПЧ. Например, наличие всего одного типа ВПЧ в сперме с низким патогенным потенциалом маловероятно объяснит бесплодие, в то время как наличие одновременно трех патогенных типов дает возможность рассматривать ПВИ как основную причину. Также это поможет определить и прогноз заболевания, позволит оценить потребность в специальной очистке спермы от вируса при ВРТ и необходимость внесения соответствующих указаний в протоколы ВРТ. Конкретные вероятности в численных выражениях предстоит установить в других исследованиях.
Наша работа имела ряд ограничений. Согласно правилам статистического анализа, рекомендуемое число наблюдений на каждую независимую переменную должно составлять не менее 25–30, т.е. для анализа влияния вирусов на показатели спермы пациентов и возникновения той или иной патологии спермы требуется 350–420 пациентов. Настоящее исследование можно рассматривать только как предварительное, пилотное: ряд сравнений имеет недопустимо малую частоту наблюдений. Это ограничение возможно устранить последующим набором пациентов.
Кроме того, в связи с массой измеряемых параметров стойкие отклонения в некоторых из них можно объяснить случайностью, что также требует воспроизведения в других не обязательно крупных выборках. Важный для нас вопрос: будут ли воспроизводиться нарушения одних и тех же параметров одними и теми же типами ВПЧ в дальнейших исследованиях?
Выводы
1. По результатам проведенного исследования, у пациентов с идиопатическим бесплодием, сочетающимся с ПВИ, отмечаются различные варианты патозооспермии.
2. В эякуляте мужчин с бесплодием чаще всего идентифицировали 16-й (60,7%), 18-й (54,9%), 33 (49,3%) типы ВПЧ. Самые частые сочетания типов ВПЧ: 16-й и 18-й (33,8%), 16-й и 33-й (35,2%), 18-й и 33-й (28,2%).
3. Чем больше типов ВПЧ присутствует в эякуляте, тем ниже показатель общей подвижности сперматозоидов.
4. Наиболее патогенными оказались сочетания 6-го и 11-го, 11-го и 16-го, 16-го и 33-го, 31-го и 33-го типов ВПЧ.
5. Патогенное влияние ВПЧ на параметры сперматозоидов зависит как от количества типов ВПЧ в эякуляте, так и от их конкретных комбинаций.
6. Для стратификации риска бесплодия, вероятности связи бесплодия с ВПЧ в зависимости от количества типов ВПЧ и их конкретных комбинаций в эякуляте полученных данных недостаточно. Требуются дальнейшие исследования на больших выборках для воспроизведения и уточнения полученных результатов.



