Введение. Бесплодием называют неспособность сексуально активной пары, не применяющей контрацепцию, достичь самопроизвольной беременности в течение 1 года [1]. Это состояние требует комплексного обследования обоих партнеров для определения причины бесплодия и ее последующего устранения. Уже из определения становится ясной вся сложность данной проблемы: бесплодие – это характеристика именно пары, и подчас нельзя сделать однозначный вывод о фертильности каждого из партнеров. Нередки случаи, когда каждый из партнеров бесплодной пары в дальнейшем оказывается способным к зачатию ребенка в другой паре. У мужчин репродуктивная способность традиционно оценивается по показателям спермограммы и общему состоянию организма; последнее оценивается посредством сбора анамнеза, общего осмотра, генетического тестирования и определения гормонального статуса [2]. Тем не менее показатели микроскопии эякулята могут не отражать в полной мере фертильность. Предложен ряд углубленных тестов, таких как фрагментация ДНК, биохимический анализ эякулята и т.д., однако их клиническая значимость до сих под остается под вопросом.
У 30–50% пациентов с отклонением показателей спермограммы не удается установить точную этиологию бесплодия [2–4]. В случае исключения женских факторов бесплодия такое состояние квалифицируется как идиопатическое мужское бесплодие (ИМБ) [2, 5]. Существуют различные теории, пытающиеся объяснить этот феномен, большинство из них концентрируется вокруг определяющей роли оксидативного стресса как фактора, способного запустить нарушение механизмов сперматогенеза [6–12].
Для лечения ИМБ международные урологические ассоциации рекомендуют изменение образа жизни и добавление в рацион питания антиоксидантов. Существуют данные, что применение пероральных антиоксидантов может увеличивать количество спермы, ее концентрацию, а также процент подвижных сперматозоидов [13–15]. К сожалению, имеющаяся информация не позволяет сделать однозначное заключение касательно эффективности этих средств – проводимые по более аккуратной и строгой методологии рандомизированные клинические исследования зачастую не находят разницы результатов между антиоксидантами и плацебо [13–17]. Вероятно, это может быть связано с тем, что ИМБ – полиэтиологическое заболевание, далеко не все формы которого ассоциированы с оксидативным стрессом [18–20].
Опубликована информация об эффективности гормональных препаратов – ингибиторов ароматазы и/или селективных модуляторов рецепторов эстрогена в отношении гормонального статуса и показателей спермограммы.
К сожалению, оригинальные исследования этих препаратов содержат значительное количество ограничений, что также не позволяет делать однозначный вывод об эффективности препаратов этих групп при ИМБ [21–25].
Еще одним перспективным направлением лечения ИМБ является восстановление экспрессии собственных пептидов, отвечающих за регуляцию процессов сперматогенеза [26, 27]. В норме регуляторные пептиды и ряд функциональных белков яичка образуют локальную регуляторную сеть и обеспечивают паракринную регуляцию сперматогенеза: чередование этапов созревания сперматозоидов, поступление в них питательных веществ, функционирование гематотестикулярного барьера [28, 29]. При ИМБ выработка этих молекул может нарушаться, из-за чего страдает микрорегуляция процессов метаболизма в тканях яичек [30, 31].
Действующее вещество препарата Фертивелл – комплекс регуляторных пептидов, выделенных из семенников половозрелого крупного рогатого скота. Благодаря низкой молекулярной массе (до 10 кДа) пептиды с током крови достигают тканей яичка, где через запуск регуляторного пептидного каскада нормализуют паракринные взаимодействия.
В экспериментах на клеточной модели окислительного стресса и модели D-галактозного репродуктивного старения у животных доказана способность Фертивелла восстанавливать экспрессию генов и ключевых белков сперматогенеза (Bcl-2, PDGFRα, виментина и др.); снижать повреждения ДНК; повышать митохондриальную активность и устойчивость митохондрий клеток тестикул к повреждениям; снижать избыточный апоптоз, индуцированный различными повреждающими агентами, не нарушая его физиологического уровня, а также повышать жизнеспособность клеток, их устойчивость к повреждениям и активность собственных антиоксидантных ферментативных систем в тканях яичка [32, 33]. Фертивелл прошел полный цикл регистрационных доклинических, а также клинических исследований I–III фаз, где доказал свою эффективность и безопасность [33, 34]. По данным Д. Ю. Пушкаря и соавт. [34], применение препарата Фертивелл у мужчин с бесплодием статистически значимо увеличивает концентрацию сперматозоидов, количество подвижных сперматозоидов, а также абсолютное количество морфологически нормальных форм.
Данная работа является прямым продолжением клинического исследования III фазы, ее цель – изучить отсроченную эффективность и безопасность терапии препаратом Фертивелл у пациентов с нарушениями сперматогенеза в контексте изучения частоты зачатия и исхода беременности у их партнерш на основании сбора, анализа и интерпретации медицинских данных.
Материалы и методы. Проведено ретроспективное наблюдательное исследование по оценке отсроченной эффективности и безопасности препарата Фертивелл в лечении мужского бесплодия. Сбор данных осуществлялся у пациентов, ранее участвовавших в многоцентровом проспективном двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании III фазы эффективности и безопасности препарата PPR-001 (Фертивелл) 5 мг внутримышечно курсом 10 инъекций у мужчин с нарушениями сперматогенеза (олиго- и/или астенозоспермией) и бесплодием по протоколу № TST-06-2019, теми же исследователями. При сборе информации проводился ретроспективный обзор результатов лечения пациентов, проведенный в рамках предшествовавшего клинического исследования .
Для подтверждения идиопатического характера бесплодия в исследовании III фазы проводилось комплексное обследование, в том числе включившее определение уровня гормонов. Пациенты были разделены в соотношении 1:1 и получали Фертивелл или плацебо. В соответствии с правилами проведения регистрационных клинических исследований во время терапии (3 мес.) и далее в течение 1 мес. после нее все пациенты применяли двойной метод контрацепции (барьерная контрацепция+местные спермицидные препараты).
В рамках настоящего ретроспективного исследования исследователи проводили созвон с мужчинами – участниками исследования TST-06-2019, объясняли им цели, задачи и процедуры данного наблюдательного исследования в соответствии со стандартным текстом, одобренным Этическим комитетом, и просили их согласия на предоставление информации в соответствии со стандартным вопросником. Пациенты, отказавшиеся от телефонного опроса, не включались в исследование.
По результатам опроса оценивались факт зачатия в паре в течение 1 года после старта курса терапии; время от завершения курса до наступления зачатия; факт приема пациентом других препаратов для лечения бесплодия в период после завершения наблюдения в исследовании III фазы и до наступления зачатия; исход беременности; антропометрические показатели/показатели здоровья новорожденного ребенка (рост, вес, оценка по шкале Апгар, наличие или отсутствие врожденных пороков развития), которые могут быть ассоциированы с мужской репродуктивной функцией и качеством эякулята отца (обезличенные данные со слов пациента).
Статистический анализ проводился с использованием программы StatTech v. 3.1.10 (разработчик – ООО «Статтех», Россия) и SPSS v. 20.0. Показатели эффективности представлены с помощью описательной статистики (среднее значение, стандартное отклонение, медиана, межквартильный интервал – для количественных переменных; абсолютное число, доля, распределение – для качественных переменных). Выбор параметрических или непараметрических критериев для тестирования статистических гипотез определялся результатами критерия Шапиро–Уилкса (с заключением о наличии/отсутствии статистически значимых различий распределения соответствующего показателя от закона нормального распределения). Расчет достоверности различий переменных, подчиняющихся биномиальному распределению, производился по формуле p=pbin(p’,n1,a1,n1)*pbin(p’,n2,a2,0), где n1 – число испытаний в группе препарата, a1 – число беременностей в ней, n2 – число испытаний в группе плацебо, a2 – число беременностей в ней. p’ – приведенная вероятность, вычисляемая по формуле (a1+a2)/(n1+n2). Для сравнения независимых количественных переменных использовался непараметрический ранговый критерий Манна–Уитни. Для оценки значимости различий исходов в зависимости от воздействия фактора риска использовался критерий Хи-квадрат. Для оценки силы связи между фактором риска и исходом использовалось нормированное значение коэффициента Пирсона. Значение p<0,05 расценивалось как статистически значимое.
Результаты. Согласие на предоставление информации и участие в данном исследовании получено от 76% участников клинического исследования III фазы (76 пациентов), включая 42 пациента, входивших в группу плацебо, и 34 – в группу препарата Фертивелл.
Все пациенты, включенные в исследование, по условиям протокола КИ III фазы были нормогонадотропными (с уровнем общего тестостерона крови более 12 нмоль/л, при отсутствии характерных клинических проявлений), с уровнем ФСГ и ЛГ не выше нормальных значений (ФСГ≤11,1мЕД/мл, ЛГ ≤8,6 мМЕ/мл), уровнем пролактина менее 1000 мЕД/л, уровнем простатического сывороточного альбумина (ПСА) ≤4 нг/мл, без анамнестических элементов экскреторного бесплодия (перенесенный ранее острый эпидидимит, травмы яичка, оперативное лечение по поводу экскреторного бесплодия и т.д.). В исследование не вошли пациенты с азооспермией, наличием признаков инфекции мочевыводящих путей, хронического воспаления предстательной железы, придатка яичка или самого яичка, варикоцеле III, IV степеней, пиоспермии, а также пациенты с врожденными аномалиями развития мочеполовых органов (экстрофией мочевого пузыря, гипоспадией, эписпадией, крипторхизмом).
В период до 4 мес. от старта терапии (то есть весь курс терапии длительностью 10 нед. и 1 мес. после окончания курса) наступление беременности не было возможным из-за использования двойной контрацепции по условиям протокола исследования III фазы. Таким образом, в ходе настоящего ретроспективного исследования представлялось возможным оценить только отсроченный эффект препарата через 1 мес. и более после окончания курса.
В течение от 4 до 12 мес. после старта терапии спонтанная беременность наступила у 13 пар из 42 (30,95%) в группе плацебо и у 17 пар из 34 (50%) в группе препарата Фертивелл.
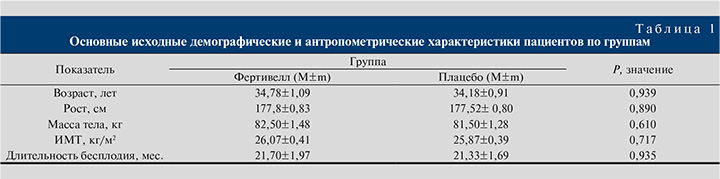
Выявлена зависимость между возрастом пациента и наступлением беременности в бесплодной паре в группе плацебо, но не в группе пациентов, получавших терапию препаратом Фертивелл. Так, средний возраст пациентов, получавших терапию препаратом Фертивелл, составил 35,47±1,39 года в группах у пар с наступившим зачатием и 35,0±1,68 года в группе без зачатий, разница между группами недостоверна (p>0,05). При анализе параметров группы плацебо выявлен достоверно более низкий исходный возраст пациентов в группе с наступившим зачатием: 31,77±1,30 против 35,28±1,48 года у пациентов без наступления зачатия в паре (p=0,042). Связи вероятности наступления беременности с остальными исходными параметрами (вес, рост, ИМТ пациента, длительность бесплодия и др.) в основной группе и группе плацебо не было выявлено, группы по данным показателям были сопоставимыми.
Информация об основных демографических и антропометрических характеристиках пациентов по группам приведена в табл. 1.
У всех участников исследования, сообщивших о наступлении беременности, последняя завершилась рождением живого ребенка. У одной пары из группы препарата Фертивелл родилась двойня, во всех остальных случаях ребенок был единственным.
Следует отметить, что 4 пары из группы препарата Фертивелл воспользовались вспомогательными репродуктивными технологиями (ВРТ). Только у 1 из этих 4 пар родился ребенок. В остальных 3 случаях беременность не наступила. Участник исследования, у которого родился ребенок после ВРТ, сообщил, что пара использовала технологию экстракорпорального оплодотворения (ЭКО) с интрацитоплазматической инъекцией сперматозоида (ИКСИ) и криопротокол. Результат этого участника расценен как положительный в отношении зачатия, поскольку, согласно криопротоколу, эмбрионы заморожены в 2020 г., а беременность развивалась в апреле 2022 г. (роды – 2023 г.).
По результатам опроса 3 пациентов, сообщивших о неудаче ВРТ: в одной паре использовалась технология ЭКО, которая не увенчалась успехом из-за непроизошедшего прикрепления зиготы к эндометрию; остальные 2 пары не предоставили информации об использованном методе ВРТ. Ни одна пара из группы плацебо не воспользовалась ВРТ в течение года после старта терапии в клиническом исследовании III фазы. Из дополнительных препаратов, способных влиять на фертильность, 2 участника из группы плацебо принимали дополнительно кломифен, в результате беременность в этих парах так и не наступила. Приема других лекарственных препаратов для терапии бесплодия в ходе данного исследования отмечено не было.
Данные о частоте наступления беременности в парах участников исследования приведены в табл. 2 и на рисунке.
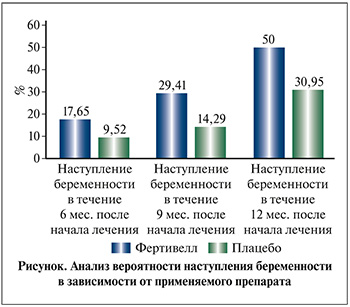
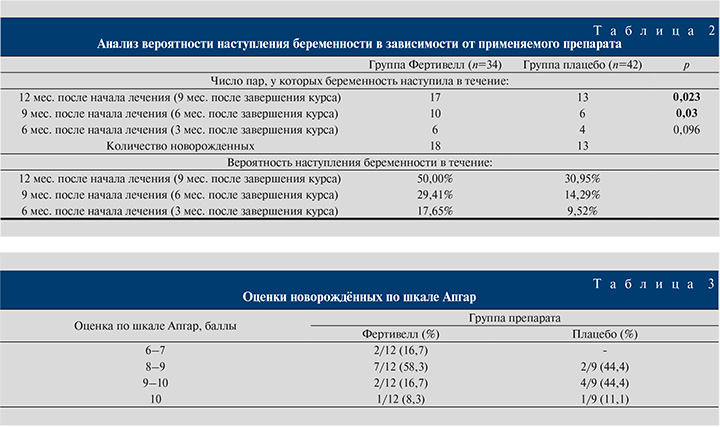
При оценке вероятности развития беременности в зависимости от применяемого препарата установлено статистически значимое различие между группами Фертивелл и плацебо в период 4–12 мес. от начала лечения (1–9 мес. после окончания курса), p=0,023. При этом клиническая значимость различий оказалась столь же высокой: шанс наступления беременности в группе Фертивелл был в 2,231 раза выше, чем в группе плацебо, 95% ДИ: 0,873–5,700. Различия также оказались достоверными для срока 4–9 мес. от начала терапии или 1–6 мес. после завершения курса (p=0,03).
Медиана промежутка времени от завершения курса до наступления беременности составила 4 (2; 7) мес. в группе препарата Фертивелл и 6 (1,75; 8,25) мес. в группе плацебо (p>0,05).
У партнерш еще одного из участников группы плацебо и двух участников группы Фертивелл беременность наступила более чем через 1 год после начала курса терапии (июль–декабрь 2022 г.). Эти результаты не учитывались при подсчете количества случаев наступления беременности в течение первого года после курса лечения.
По результатам телефонного опроса 9 пациентов из группы плацебо и 12 из группы препарата Фертивелл сообщили информацию о состоянии здоровья своих новорожденных детей по шкале Апгар. Распределение оценок приведено в табл. 3. Оценки новорожденных детей по шкале Апгар в баллах между двумя группами значимо не различались (p>0,05).
Остальные участники исследования, согласившиеся ответить на вопросы, не предоставили информации о состоянии своих новорожденных детей.
У мужчин в группе препарата Фертивелл родились 10 девочек и 8 мальчиков, а в группе плацебо 6 девочек и 6 мальчиков, еще 1 пациент не предоставил информации о поле ребенка. В среднем в группе плацебо рост новорожденных детей составлял 51,6±2,6 см, вес 3,4±0,33 кг, роды наступали на 39,3±1,2 недели беременности. В группе применения препарата Фертивелл в среднем рост новорожденных детей составлял 49,9±4,1 см, вес – 3,2±0,7 кг, роды наступали на 38,5±2,1 недели беременности. Антропометрические параметры новорожденных детей между двумя группами значимо не различались (p>0,05).
Обсуждение. Проведен ретроспективный анализ отдаленных результатов лечения препаратом Фертивелл по сравнению с плацебо. Вероятность наступления беременности в паре в периоды 6 и 9 мес. после окончания 10-недельного курса терапии была статистически значимо выше при применении препарата Фертивелл. Следует отметить, что в проведенном исследовании наблюдается не только статистически значимая, но и клинически существенная разница между группами – исследуемый препарат Фертивелл в среднем в 2,2 раза повышает шанс успешной беременности в паре, то есть проявил себя в качестве весьма перспективного средства для лечения ИМБ.
Как показало предыдущее исследование [34], Фертивелл достоверно улучшает показатели качества эякулята у пациентов с мужским фактором бесплодия: увеличивает концентрацию сперматозоидов на 254% от исходного, т.е. более чем в 3 раза, что в 5 раз превышает показатели в группе плацебо, увеличивает долю сперматозоидов с прогрессивной подвижностью на 125% от исходного, т.е. более чем в 2 раза, что в 3,5 раза превышает показатели в группе плацебо, а также повышает абсолютное количество морфологически нормальных форм сперматозоидов по сравнению с исходными данными в 2,6 раза через 3 нед. после завершения курса, при эффекте плацебо не более 6,7–11%, при сопоставимых исходных параметрах и идентичных рекомендациях по изменению образа жизни и питания в основной группе и в группе плацебо.
Настоящее исследование оценивало клинический эффект от описанных лабораторных улучшений. Установлено, что применение препарата Фертивелл у пациентов с олигоастенозооспермией и бесплодием и связанное с ним улучшение показателей спермограммы – основные факторы, оказавшие влияние на вероятность зачатия, поскольку возраст, индекс массы тела, другие исходные параметры и сопутствующая терапия были сопоставимыми между группами пациентов, в парах которых произошло зачатие ребенка (критерий Манна–Уитни, p>0,05). У 13 из 17 пациентов из группы Фертивелл, у которых произошло зачатие в течение 1 года после старта терапии, по результатам клинического исследования III фазы отмечено значимое улучшение показателей спермограммы (не менее чем на 20% увеличение значения концентрации и прогрессивной подвижности сперматозоидов в эякуляте по сравнению с исходным уровнем), что говорит о прямом влиянии улучшения лабораторных показателей, вызванного исследуемым препаратом, на вероятность зачатия ребенка, причем корреляция между этими показателями сильная (критерий хи-квадрат, p=0,004; нормированное значение коэффициента Пирсона =0,663).
Эффективность всех остальных препаратов, используемых в лечении бесплодия, остается спорной и в полной мере не доказанной – на сегодняшний день ни один из существующих препаратов не позволяет добиться 100%-ной излечиваемости ИМБ или хотя бы приблизиться к этому показателю. Во многом это обусловлено малоизученностью самого заболевания, его этиологии и много-образием звеньев патогенеза. Разнообразные патогенные эффекты могут реализовываться через прямое токсическое воздействие, например при воздействии свободных радикалов на молекулы, путем нарушения паракринной регуляции экспрессии генов или через эпигенетические механизмы [4, 6, 36, 9–12, 18–20, 35].
Основываясь на представленных данных, наибольший научный интерес при ИМБ в настоящий момент представляет поиск агентов, способных воздействовать комплексно: повышать жизнеспособность развивающихся репродуктивных клеток, их устойчивость к разнообразным повреждениям и наряду с этим контролировать локальную (паракринную) регуляцию сперматогенеза в семенных канальцах.
Препараты на основе регуляторных полипептидов семенников, по-видимому, можно назвать наиболее физиологичными и универсальными в этом отношении. Они не только воздействуют на отдельные этапы патогенеза болезни, оказывают комплексное протективное влияние, но и восстанавливают саморегуляцию тканей семенников, что находит отражение как в положительной динамике показателей эякулята, так и в клинической успешности терапии мужского бесплодия.
Ограничением данного исследования можно считать выход ряда пациентов из-под наблюдения (24%). Тем не менее это не помешало получить достаточные для анализа группы и статистически достоверные данные. Другим ограничением являлось применение контрацепции в ходе проведения регистрационного клинического исследования (суммарно до 4 мес. от начала исследования). Можно рассчитывать, что в реальной клинической практике, где нет необходимости в такой мере, частота беременностей на фоне Фертивелла будет еще выше за счет возможного зачатия на фоне терапии и в первый месяц после завершения курса препарата. Еще одно ограничение, вытекающее из дизайна исследования: пациенты наблюдались уже после окончания КИ III фазы и, соответственно, в этот период уже не были ограничены в сопутствовавшей терапии и могли принимать другие препараты/БАДы, влияющие на шанс зачатия. Это означает, что в группе плацебо на самом деле мы можем наблюдать еще и эффект стандартной терапии антиоксидантами и другими препаратами.
Заключение. Фертивелл – лекарственный препарат на основе регуляторных пептидов семенников, предназначенный для лечения идиопатического мужского бесплодия. Применение препарата Фертивелл не только увеличивает концентрацию сперматозоидов, количество подвижных и морфологически нормальных форм сперматозоидов, но и статистически значимо увеличивает вероятность наступления беременности в паре и живорождения.
Доказана эффективность препарата в отношении повышения частоты зачатий и живорождений при наличии мужского фактора бесплодия в паре в когорте нормогонадотропных пациентов с олигоастенозооспермией в возрасте от 21 до 55 лет при исходном отсутствии признаков экскреторного бесплодия, инфекций мочевыводящих путей, предстательной железы, придатка яичка или самого яичка, без врожденных аномалий развития мочеполовых органов с длительностью бесплодия в паре от 1 до 6 лет.
Дополнительно отмечена клинически значимая тенденция к более быстрому наступлению беременности в паре при применении препарата Фертивелл по сравнению с контрольной группой. Таким образом, препарат может быть рекомендован при идиопатическом бесплодии как самостоятельный метод терапии, так и в сочетании со вспомогательными репродуктивными технологиями.



