Введение. Среди трансмиссивных инфекций, передающихся в результате присасывания иксодовых клещей, особое место занимает гранулоцитарный анаплазмоз [1]. Ранее считалось, что анаплазмоз, вызванный Anaplasma marginale или A. ovis, может встречаться только у сельскохозяйственных и домашних животных, при этом установлено, что инфекция анаплазмами способна вызывать появление цитогенетических нарушений в виде микроядер, которые образуются в результате отставания в митозе целых хромосом и их фрагментов [2]. Кроме того, в литературе имеются сообщения о способности анаплазм вызывать самые различные поражения репродуктивной системы у самцов с развитием бесплодия [3, 4]. Показано, что повышенное число клеток с микроядрами ассоциировано с присутствием в генотипе человека некоторых вариантов гена LIG4 Thr9Ile [5]. Известно, что Lig IV – белок, кодируемый этим геном, представляет собой ДНК-лигазу, которая осуществляет негомологическое соединение однонитевых разрывов в двухцепочечном полидезоксинуклеотиде в АТФ-зависимой реакции [6].
Существует мнение, будто именно двухнитевые повреждения ДНК приводят к появлению микроядер в делящейся клетке [7]. Каких-либо сведений о роли анаплазм в цитогенетических поражениях репродуктивной системы у человека в доступных научных источниках мы не обнаружили. Совершенно очевидно, что исследование роли анаплазм в поражении генетических структур репродуктивной системы человека актуально, поскольку не исключено, что инфекция, вызванная этими риккетсиями, может быть причиной появления генетических нарушений в потомстве.
Цель настоящего исследования в оценке роли гранулоцитарного анаплазмоза человека (ГАЧ), вызванного Anaplasma phagocytophilum, в индукции цитогенетических нарушений сперматозоидов и кариопатологических изменений эпителиоцитов урогенитального тракта в зависимости от полиморфизма гена фермента ДНК-лигазы IV (Lig4 Thr9Ile).
Материалы и методы. Проведено обследование 129 лиц мужского пола, больных ГАЧ, вызванным A. phagocytophilum, находившихся на лечении в инфекционных отделениях больниц Ханты-Мансийска, Тюмени и Томска. Для анализа у всех обследуемых были взяты образцы спермы и эпителия урогенитального тракта. Одновременно проведено анкетирование, позволившее составить представление о преморбидном фоне и возможных факторах риска обследуемых доноров. У каждого человека в цитологических препаратах анализировали не менее 1000 эпителиоцитов и сперматозоидов. При изучении морфологии сперматозоидов регистрировали изменения размера, формы, дефекты акросомальной области, удвоение головки, аномалии шейки и хвоста [8], а также учитывали строгие критерии Крюгера [9]. У всех обследованных лиц были проанализированы следующие кариопатологические изменения эпителиоцитов урогенитального тракта: встречаемость клеток с микроядрами и протрузиями, кариолизисом, кариорексисом, кариопикнозом и вакуолизацией ядра. Методические особенности приготовления препаратов и их анализ изложены нами ранее [10]. Кроме того, семенная жидкость изучена на предмет лейкоцитоспермии. Особое внимание при этом обращали на присутствие в сперме инфицированных нейтрофилов, содержащих интрацитоплазматические морулы анаплазм.
Большинство обследованных мужчин жаловались на отсутствие либидо, резкую утрату полового влечения, что и послужило одним из мотивов для изучения сперматозоидов в семенной жидкости. Контрольную группу составили 84 мужчины, являющихся донорами станций переливания крови и студентами медицинских вузов Томска и Тюмени. Средний возраст больных составил 28,3±3,9, доноров контрольной группы – 24,5±5,8 года. Больные и здоровые доноры в течение года до проведения настоящего исследования не подвергались рентгенологическим обследованиям и не получали лекарственной терапии. Предварительно от каждого обследованного было получено информированное согласие на проведение настоящего исследования, соответствовавшего требованиям Хельсинкской декларации Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2013 г. и Правилами клинической практики в Российской Федерации, утвержденными Приказом Минздрава РФ № 266 от 19.06.2003.
Диагноз устанавливали на основании клинической картины и эпидемиологических данных, результатов темнопольной микроскопии мазков крови с выявлением интрацитоплазматических морул анаплазм в инфицированных нейтрофилах, а также положительных результатов серологических тестов, включивших выявление специфичных IgM и IgG в сыворотке крови в иммуноферментном анализе, для чего использовали диагностические тест-системы фирмы «Омникс» (Россия). Для подтверждения диагноза у всех обследованных с помощью ПЦР выявлено наличие праймеров на участок ДНК 16S-субъединицы рРНК возбудителя. Использовали наборы для выделения геномной ДНК из бактерий компании «Синтол» (Россия). Синтез олигонуклеотидов осуществлен на автоматическом ДНК/РНК синтезаторе ASM1000 («Биоссет», Россия). Очистка выполнена и в полиакриламидном геле. Амплификация проведена на приборе типа Терцик-МС2 (Россия) с применением термостабильной Taq-полимеразы («СибЭнзим», Россия), согласно рекомендациям фирмы – производителя полимеразы. Анализ продуктов ПЦР проведен при помощи электрофореза в 1,5%-ном агарозном геле, содержащем бромистый этидий. Документирование результатов осуществлено на системе гель-документирования («Компания Биоком», Россия), состоявшей из трансиллюминатора УВТ-1 (для детекции фрагментов нуклеиновых кислот в ультрафиолете) и системы обработки изображений «ViTran Photo».
Всем обследованным проведено молекулярно-цитогенетическое исследование деконденсированных сперматозоидов методом флуоресцентной in situ гибридизации (FISH). С целью определения уровня анеуплоидий сперматозоидов использована многоцветная проба AneuVysion для 18-й и 21-й хромосом («Abbott», США). Сперму трижды отмывали фосфатным буфером, после чего осадок помещали на стекла при температуре 50°С и далее фиксировали на протяжении 18 ч при t -20 °C. Сперматозоиды деконденсировали путем инкубации в 0,1N-ном растворе гидроксида натрия. Далее проводили предгибридизационную подготовку препарата с нанесением пробы CEP18 и LSI21 на предварительно отмеченные зоны гибридизации. Стекло с нанесенными зондами помещали в гибридизатор с установленной программой денатурации и гибридизации при t 37°С длительностью от 4 до 12 ч. Затем препараты окрашивали и проводили детекцию флуоресцентных сигналов согласно стандартному протоколу. Для определения уровня анеуплоидий в сперматозоидах анализировали 1000 клеток. Исследование уровня фрагментации ДНК проводили методом SCD («Sperm Chromatin Dispertion test») с использованием коммерческого набора Halosperm («Halotech DNA», Испания). При этом подсчитывали 500 клеток c оценкой размера ореола вокруг головки сперматозоида.
Статистическую обработку осуществляли с использованием пакета статистических программ STATISTICA v.10.0 и BIOSTAT (Primer of Biostatistic version 4.03, США). Частоты гаплотипов сцепленных локусов для гена LIG4 Thr9Ile рассчитывали в программе «The EH software program, Rockefeller University» (США). Все количественные показатели исследования обрабатывали с применением корреляционного анализа по Спирмену и t-критерия Стьюдента для независимых выборок, поскольку тестирование закона распределения при помощи критерия Колмогорова–Смирнова не выявило отличий от нормального. Анализ статистических различий качественных признаков проведен с использованием критерия χ2 с поправкой Йейтса на непрерывность [11]. Различия сравниваемых результатов (X±m, где X – выборочное среднее арифметическое, m – ошибка среднего арифметического) считали статистически значимыми при p<0,05.
Результаты и обсуждение. Полученные результаты свидетельствуют: у больных ГАЧ – носителей аллеля Ile как в гомозиготном, так и в гетерозиготном состоянии наблюдается значимое увеличение всех анализируемых показателей по сравнению с контролем (см. таблицу). У носителей гена Ile, больных ГАЧ, по сравнению с контролем было в 2,7 раза больше сперматозоидов с фрагментацией хромосом. Отмечено полное отсутствие в сперматозоидах больных 21-й хромосомы в 5,2±0,8‰ (гомозиготы Ile/Ile) и 3,5±0,7‰ (гетерозиготы Thr/Ile) клеток, что существенно выше, чем в контроле (0,8±0,4‰; p<0,01, и 0,4±0,2‰; p<0,01 соответственно). Аналогичная закономерность отмечена и в отношении носителей генотипа Thr/Thr. Кроме того, у больных наблюдалось увеличение числа дисомных сперматозоидов по 21-й хромосоме. Частота нуллисомий по 18-й хромосоме практически не отличалась от аналогичных значений, зарегистрированных в отношении 21-й хромосомы (p>0,05).
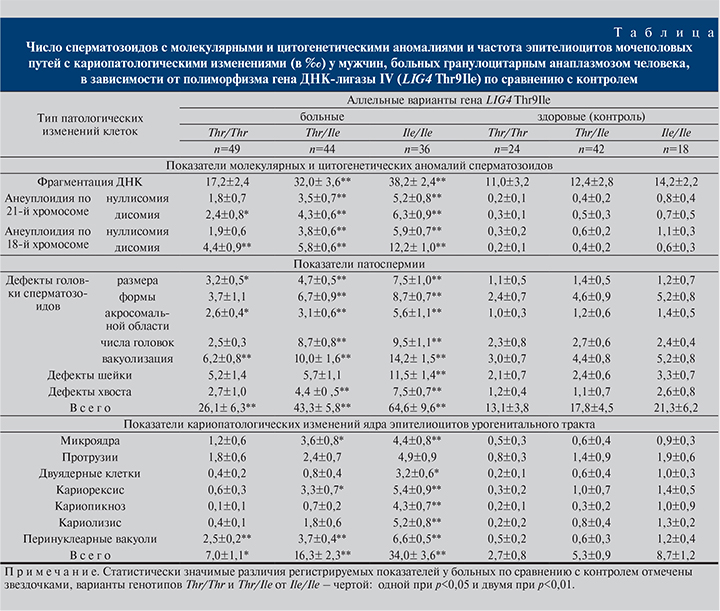
В то же время у носителей Ile/Ile сперматозоиды с дисомией по 18-й хромосоме встречались значимо чаще, чем таковые с дисомией по 21-й хромосоме (12,2±1,0‰ и 6,3±0,9‰ соответственно; p<0,01). Как известно, трисомия-21 имеет в основном материнское происхождение и напрямую зависит от возраста, а аномалии в числе хромосом по 18-й хромосоме более свойственны мужским половым клеткам [12].
Анализ морфологических изменений сперматозоидов выявил значительное увеличение в семенной жидкости больных ГАЧ числа сперматозоидов с дефектами головки, изменением размеров и формы головки, аномалиями акросомальной области, двойной головкой, а также с дефектами шейки и хвоста (p<0,01). Особенно существенно был повышенным уровень патологически измененных сперматозоидов у больных – носителей рецессивного гомозиготного генотипа Ile/Ile. Так, например, общее число сперматозоидов с молекулярными и цитогенетическими аномалиями у этой группы больных составило 64,6±9,6‰, у больных с генотипом Thr/Thr – 26,1±6,3‰ (p<0,01). В целом число аномальных сперматозоидов у больных – носителей Ile/Ile превышало таковой в контроле в 3,1 раза.
Известно, что разрывы ДНК возникают в процессе ремоделирования хроматина при формировании ядра сперматозоида, где гистоны нуклеосом замещаются на протамины. Затем возникшие разрывы ДНК репарируются при участии лигаз [13]. Как свидетельствуют полученные нами данные, в случае наличия в генотипе больных гомозиготного варианта гена LIG4 Thr9Ile–Ile/Ile статистически значимо повышалась фрагментация ДНК в сперматозоидах. Одновременно в эпителиоцитах урогенитального тракта наблюдалось существенное увеличение числа клеток с микроядрами. Если в случае сперматозоидов возможно предположить, что у больных ГАЧ недостаточная ферментативная активность при наличии варианта гена Ile/Ile снижает процесс репарации ДНК при ремоделировании ядра сперматозода, то во втором случае (в эпителиоцитах) не исключено образование микроядер за счет негомологического соединения однонитевых разрывов в двухцепочечном полидезоксинуклеотиде в АТФ-зависимой реакции, что способствует формированию фрагментов хромосом и их отставанию в митозе и как следствие – к образованию микроядер [10].
Апоптотический процесс распада хроматина ядра может выглядеть в эпителиоцитах урогенитального тракта как кариолизис. Кариорексис – это заключительный этап гибели клетки, часто ассоциированный с многогрупповым аномальным митозом [10]. У гомозиготных (Ile/Ile) больных ГАЧ число эпителиоцитов урогенитального тракта с перинуклеарной вакуолью, знаменующей начало апоптотического процесса [14], было значимо выше, чем в контрольной группе (p<0,01). То же можно сказать и о частоте клеток с кариорексисом (p<0,01) или кариолизисом (p<0,01). Возрастание числа клеток с кариопикнозом у пациентов, имеющих генотип Ile/Ile, может свидетельствовать о снижении активности экспрессируемых участков генома эпителиоцитов [15].
Есть мнение, будто повышенная фрагментация и разрывы в ДНК сперматозоидов свидетельствуют об интенсивности апоптоза. Известно, что более 75% сперматогониев находятся в состоянии апоптоза. Разрушающиеся клетки фагоцитируются клетками Сертоли. Некоторая часть этих клеток попадает в семенную жидкость и визуализируется как патологически измененные сперматозоиды. Таким образом, снижение интенсивности апоптоза приводит к существенному увеличению числа атипичных сперматозоидов в семенной жидкости [16, 17].
Одной из причин возникновения разрывов в ДНК сперматозоидов служат реактивные формы кислорода и активация окислительного стресса. При этом запускается процесс разрушения сперматогониальных клеток организма [18]. Эффекты ROS/RNS на клетках были широко исследованы. Показано, что эти высокореактивные соединения повреждают клеточные макромолекулы, включая ДНК и ферменты [19]. Цитогенетический эффект анаплазм и других инфекционных агентов может быть обусловлен окислительным стрессом, вызванным внедрением паразита в организм [20]. Проведенные нами исследования также указывают на то, что у больных ГАЧ статистически значимо повышается число цитогенетических нарушений как в сперматозоидах, так и в эпителиоцитах урогенитального тракта. Известно, что сперматозоиды спонтанно производят разнообразные реактивные формы кислорода, включая супероксид анион радикал, пероксид водорода и оксид азота [21]. В свою очередь повышенная активность окислительного стресса может, по-видимому, способствовать кариопатологическим изменениям как в самих сперматозоидов, так и в эпителиоцитах урогенитального тракта человека. Мишенью активных форм кислорода может стать и ДНК сперматозоида, что дестабилизирует структуру макромолекулы, обусловливая появление ее разрывов [22]. Кроме того, снижение уровня антиоксидантов в секретах половых путей способствует окислительному стрессу и увеличению частоты разрывов в ДНК сперматозоидов и как следствие – приводит к снижению мужской фертильности. Известно, что дефицит фермента ДНК-лигазы IV, наблюдаемый у носителей генотипа ile/ile, сопровождается выраженной иммуносупрессией, что усугубляет течение инфекционного процесса и одновременно снижает способность клеток восстанавливать двухцепочечные разрывы, обеспечивающие появление микроядер [10, 23]. Возможен и другой механизм возникновения регистрируемых аномалий. Так, имеются свидетельства того, что при анаплазмозе развивается аутоиммунный орхит [4]. Разрушение гемотестикулярного барьера, наблюдаемое авторами при экспериментальном заражении животных анаплазмами, ведет к попаданию в кровоток семенников разрушенных клеток, что вызывает формирование антиспермальных и антинуклеарных антител, которые, по-видимому, могут служить одной из причин возникающих кариопатологических изменений в эпителии урогенитального тракта, а также патоспермии и молекулярно-цитогенетических поражений сперматозоидов, наблюдаемых при этом заболевании [24]. По мнению S.H. Sinclair et al. [25], на сегодняшний день единственными известными прокариотическими нуклеомодулинами, которые непосредственно связываются с ДНК млекопитающих и влияют на окружающий хроматин клеток хозяина, остаются нуклеомодулины бактерий семейства Anaplasmataceae, к которому и относятся анаплазмы. Авторы предположили, что нуклеомодулины могут действовать широко, воздействуя на целые геномы соседних неинфицированных клеток путем ремоделирования хроматина, изменяя его структурную организацию. Вполне возможно, что именно с этим процессом связаны наблюдаемые нами кариопатологические процессы в эпителиоцитах урогенитального тракта, а также и цитогенетические и морфологические изменения сперматозоидов семенной жидкости. Наши исследования свидетельствуют: в случаях, когда в семенной жидкости присутствуют нейтрофилы, содержащие интрацитоплазматические морулы анаплазм, наблюдается значимое возрастание числа сперматозоидов с фрагментацией ДНК и анеуплоидией.
Увеличение уровня цитогенетических нарушений в сперматозоидах больных ГАЧ следует учитывать в работе медико-генетических консультаций, поскольку не исключено, что такого рода изменения в хромосомном аппарате половых клеток могут стать причиной рождения генетически аномального потомства.
Заключение. Таким образом, цитологический анализ больных ГАЧ свидетельствует о значимом возрастании числа сперматозоидов с дефектами головки, шейки и хвоста и с фрагментацией ДНК, моно- и трисомиями по 18-й и 21-й хромосомам, а также об увеличении частоты появления эпителиоцитов урогенитального тракта с кариопатологическими изменениями. Установлен генетический полиморфизм последствий ГАЧ, поскольку наиболее существенные цитогенетические изменения наблюдались у больных – носителей генотипа Ile/Ile гена LIG4 Thr9Ile.



