Введение. При мужском бесплодии хирургическое лечение клинического варикоцеле в 4,1 раза увеличивает вероятность естественного зачатия [1] и в 1,7, когда применяется до использования вспомогательных репродуктивных технологий [2]. В то же время варикоцелэктомия не всегда приводит к восстановлению фертильности: улучшение спермограммы после операции имеет место в 60–80% случаев, беременность наступает в 30–45% случаев [3–7]. Использование микрохирургических паховых или субингвинальных доступов сопровождается меньшим числом рецидивов и послеоперационных осложнений [8, 9], обеспечивает более высокий уровень наступления естественной беременности [10], однако проспективных рандомизированных клинических исследований достаточной мощности, сравнивающих эффективность различных вмешательств при варикоцеле, не проводилось [11]. При этом лекарственная терапия, в частности применение нутриентов-антиоксидантов, дает в общей выборке сходное увеличение процента наступивших беременностей (отношение шансов [ОШ]=1,7–3,7) и родов (ОШ=1,2–2,2) как при естественном зачатии, так и при использовании вспомогательных репродуктивных технологий [12, 13].
Цель исследования: оценить эффективность микрохирургической и лапароскопической варикоцелэктомии для коррекции патозооспермии, в т.ч. фрагментации ДНК, по сравнению с наблюдением и терапией нутриентами с использованием критериев «стандартизованная эффективность/Standardized effect (Es)» и «клинически значимые» изменения.
Материалы и методы. Проведено многоцентровое исследование типа случай–контроль со стратифицированной рандомизацией по группам. Ретроспективно проанализированы электронные истории болезни мужчин в возрасте от 18 до 50 лет, обратившихся в клиники уроандрологического профиля Москвы по поводу отсутствия желанной беременности в браке более года. Пациенты прошли комплексное клинико-лабораторное обследование в соответствии с рекомендациями ВОЗ [14, 15]. Определение фрагментации ДНК сперматозоидов проводили методом дисперсии хроматина в агарозном геле [16].
Методом стратифицированной рандомизации были сформированы четыре группы пациентов с варикоцеле, соответствовавших нижеперечисленным критериям включения и исключения.
Критерии включения: 1) бесплодный брак более 1 года; 2) половая жизнь без контрацепции не реже 1 раза в неделю; 3) клиническое варикоцеле слева или двустороннее; 4) олиго-, астено- и/или тератозооспермия при исходной концентрации от 1 до 80 млн/мл (~50% процентиль по ВОЗ [14]); 5) отсутствие инфекций репродуктивного тракта (C. trachomatis, M. genitalium, U. urealyticum, M. hominis, T. vaginalis); 6) отсутствие признаков воспалительного процесса дополнительных половых желез; 7) отсутствие выраженной соматической патологии; 8) отсутствие психосексуальной и эякуляторной дисфункций.
Критерии исключения: 1) азооспермия и грубая олигозооспермия (концентрация <1 млн/мл), при которой высок риск генетических нарушений [11, 17]; 2) неспособность соблюдать рекомендации врача и проходить плановые обследования; 3) наличие инфекционно-воспалительного процесса в форме пиоспермии и/или бактериоспермии [14] исходно или при повторном обследовании; 4) нормозо-оспермия по ВОЗ [14].
Оценивали изменения показателей спермы за 3-месячный период в следующих группах: в группе наблюдения (контрольная), в которой мужчины не получали никакого лечения (А; n=33); в группе терапии нутриентами (БАДы «Профертил», или «АндроДоз», или «БестФертил», или «УльтраФертил» в рекомендованных производителями дозировках) (Б; n=63); в группе варикоцелэктомии микрохирургической субингвинальным мини-доступом (В; n=86); в группе лапароскопической варикоцелэктомии (Г; n=36). Пациенты групп В и Г никакого дополнительного лечения не получали.
Исходно выраженность варикоцеле и показатели спермограммы пациентов разных групп статистически не различались (p>0,05, табл. 1). Хронологическое смещение при наборе данных существовало, но без сезонного фактора.
Статистический анализ с применением пакета программ Statistica («StatSoft», США). «Нормальность» распределения оценивали по критерию Шапиро–Уилка. Средние значения по группам представляли в виде M±SD, медианы 25-го 75-го процентилей, диапазона «невыпадающих значений». Значимость различий между группами оценивали с помощью критериев Стьюдента (t), Манна–Уитни, знаков (Z), χ2 и Вилкоксона; различия считали статистически значимыми при p<0,05. Вычисляли стандартизованную эффективность (Standardized effect/Es) наблюдаемых изменений параметров спермограммы по алгоритму Power Calculation пакета Statistica (StatSoft, США). Чтобы оценить статистическую значимость различий между группами, сравнивали: 1) средние величины этих изменений (Х2–Х1 для n1, n2, n3, n4 пациентов с учетом знака изменений) по t-критерию для независимых групп; 2) средние ранги значений Х2–Х1 с помощью критерия Манна–Уитни; 3) частоты случаев улучшения каждого из параметров по критерию χ2. «Клинически значимым» считали изменение числа прогрессивно подвижных сперматозоидов в эякуляте на 7,2 млн; этот показатель рассчитан из минимально нормальных значений спермограммы по ВОЗ [14]: 1,5 мл (объем)×15 млн/мл (концентрация)×0,32 (32 % прогрессивно подвижных).
Все мужчины дали информированное согласие на использование данных их обследования в научных целях. Этический комитет МГУ одобрил проведение исследования.
Результаты. Возраст пациентов, включенных в исследование, статистически значимо (p>0,05) не отличался, составив 34,0±5,8, 33,7±5,2, 32,1±4,9 и 30,7±4,5 года в группе А, Б, В и Г соответственно.
Исходно различий в средних значениях и частоте случаев олиго-, астено- и тератозооспермии между группами не было (табл. 1): олигозооспермия (изолированно или в сочетании с астено- и/или тератозооспермией) в группах А, Б, В и Г имела место в 35, 27, 32 и 58%, астенозооспермия – в 47, 41, 56 и 64%; тератозооспермия – в 79, 81, 72 и 69% наблюдений соответственно (для всех p>0,05).
В контрольной группе изменения отдельных показателей стандартной спермограммы через 3 мес. наблюдения отсутствовали (табл. 1; p>0,05).
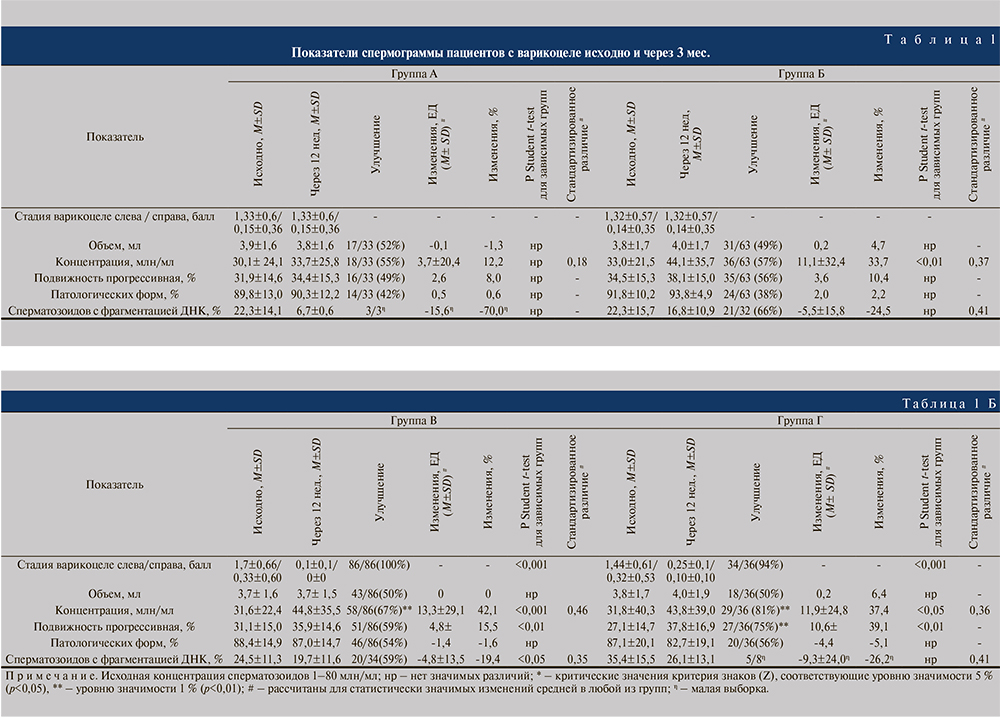
У пациентов, получавших нутриенты (группа Б), увеличилась концентрация сперматозоидов: средняя – на 11 млн/мл (см. табл. 1; p<0,01), медиана – на 6 млн/мл (p<0,05); увеличение концентрации констатировали в 57% случаев (p>0,05). Процент сперматозоидов с фрагментацией ДНК уменьшился на 5,5% (p<0,05), позитивная динамика отмечена в 66% наблюдений (см. табл. 1, рис. 1).
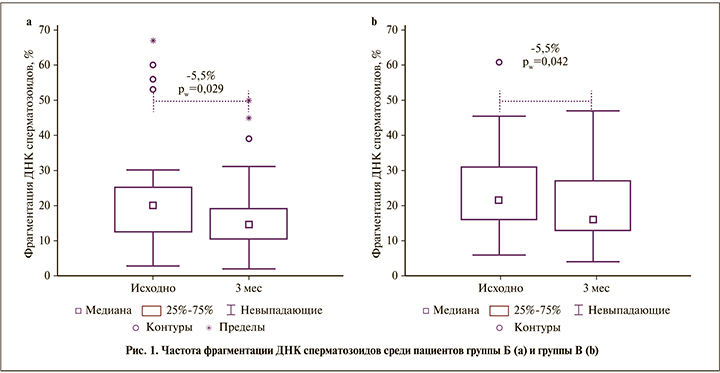
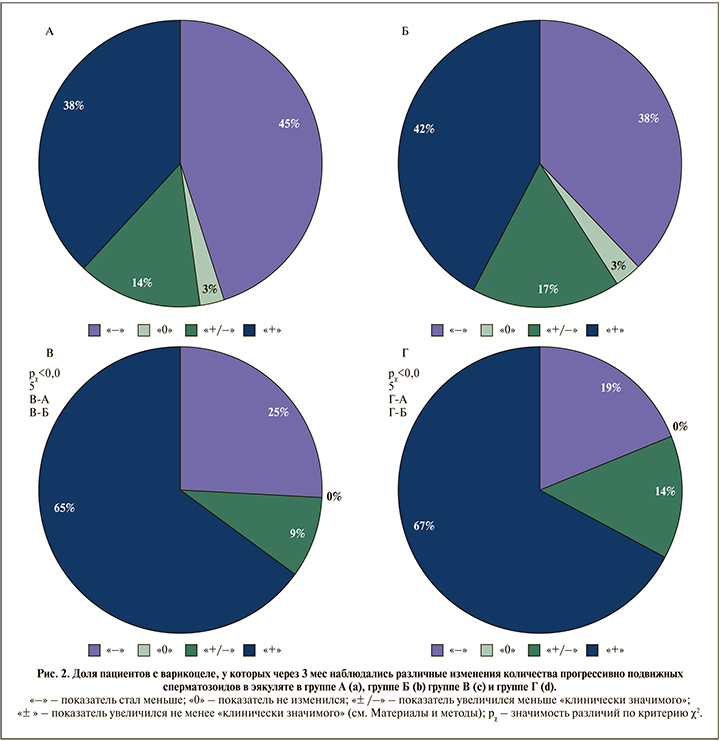
У пациентов после варикоцелэктомии (группы В и Г) произошло существенное увеличение концентрации, прогрессивной подвижности, процента сперматозоидов без фрагментации ДНК (см. табл. 1, рис. 1). Общее число прогрессивно подвижных сперматозоидов в группе В увеличилось в среднем на 25 млн (+67% от исходного; p<0,001), в группе Г – на 36 млн (109% от исходного; p<0,001); позитивная динамика имела место в 72 и 81% случаев (в обоих случаях p<0,01). Медианы изменились меньше (табл. 2): +17 и +21 млн в группе В и Г соответственно (p<0,001). Доля сперматозоидов с фрагментацией ДНК снизилась на 4,8% для средней (см. табл. 1; p<0,05) и на 5,5% для медианы (см. рис. 1; p<0,05); позитивная динамика отмечена в 59% случаев (p>0,05). «Клинически значимый» эффект в группах варикоцелэктомии имел место в 2/3 случаев (рис. 2): в 65% в группе В и в 67% в группе Г, что существенно чаще, чем в контрольной группе А (38%) и у получавших нутриенты в группе Б (42%) (p<0,05); различий между группами В и Г при этом не было (p>0,05). В сравнении с группой пациентов, получавших нутриенты (Б), изменения в группе Г (лапароскопия) статистически значимы (p<0,05), а в группе В (микрохирургия) – нет (p>0,05). Es для общего количества прогрессивно подвижных сперматозоидов в эякуляте составил в группе А 0,22, в группе Б 0,29, в группе В 0,44 и в группе Г 0,70.
Обсуждение. Сопоставление наших результатов с опубликованными ранее данными [1, 10, 11, 18–20] показывает, что в нашем исследовании наблюдалось сходное увеличение концентрации и подвижности сперматозоидов, но не было снижения процента патологических форм (хотя при лапароскопии произошло снижение на 4,4%, но статистически не значимое). Вероятно, это объясняется тем, что в нашей выборке было меньше пациентов с олигозооспермией и больше с тератозооспермией.

Улучшение качества спермы в группах оперированных пациентов по сравнению с контрольной группой (наблюдения) и отсутствие различий между группами оперированных пациентов были предсказуемыми. Однако сравнение с группой пациентов, получавших нутриенты, показало, что различие было статистически значимым только для группы с лапароскопической варикоцелэктомией (см. табл. 2). Применение критерия Es по отношению к количеству прогрессивно подвижных сперматозоидов в эякуляте показало, что он выше после лапароскопической операции, чем после микрохирургической: 0,70 и 0,44 соответственно при 0,29 у получавших нутриенты и 0,22 в контрольной группе наблюдения (принято считать, что величина меньше 0,2 свидетельствует об отсутствии эффекта, от 0,2 до 0,5 – о слабом эффекте, от 0,5 до 0,8 – о среднем, больше 0,8 – о сильном эффекте). То есть через 3 мес. после операции лечебный эффект лапароскопической операции был выше, чем микрохирургической. Возможно, это связано, с тем, что в группе лапароскопической варикоцелэктомии исходно было больше пациентов с низкой концентрацией сперматозоидов (при равенстве средних медиана меньше, чем в других группах), поэтому после операции был достигнут более заметный эффект. Мета-анализ А. Agarwal et al. [18] также показал несколько большее увеличение концентрации после лапароскопии, чем после микрохирургии (+12,0 и +9,9 млн/мл соответственно) для пациентов с олигозооспермией. Можно было предположить, что различие в эффекте обусловлено различиями в выраженности варикоцеле. Только что опубликованный мета-анализ показал [21]: увеличение средней концентрации сперматозоидов у мужчин с варикоцеле 1-й, 2, 2–3 и 3-й степеней составило 5,5, 8,9, 12,7 и 16,0 млн/мл соответственно; среднее улучшение процента подвижных сперматозоидов – на 9,6%, 10,6, 10,8 и 17,7% соответственно [21]. Однако в нашей работе средняя степень варикоцеле составила 1,70 в группе микрохирургической варикоцелэктомии и 1,44 – в лапароскопической (см. табл. 1), т.е. более выраженный эффект был получен при меньшей степени варикоцеле. Не было значимых различий и в частоте рецидивов. В связи с этим считаем, что наблюдаемые различия связаны со сроком наблюдения после операции: микрохирургическая операция субингвинальным доступом приводит к отеку в области семенного канатика, что в свою очередь приводит к временному ухудшению кровоснабжения яичка и нарушению сперматогенеза. В результате после микрохирургической операции мы получим более отсроченный эффект, чем после лапароскопической.
Наше сравнительное исследование также показывает, что любая из выполняемых нами операций более эффективной, чем терапия нутриентами, когда имеет место снижение количества и подвижности сперматозоидов. Однако в отношении фрагментации ДНК варикоцелэктомии и прием нутриентов обусловливают одинаковый результат – снижение фрагментации ДНК на 5,5% (по данным мета-анализа [20], после варикоцелэктомии фрагментация ДНК уменьшается в среднем на 3,4%). Es сходен в группах лапароскопии, микрохирургии и терапии нутриентами (0,41, 0,35 и 0,41 соответственно), при этом эффект считается «слабым». Следовательно, при нарушениях фрагментации ДНК консервативное лечение нутриентами практически так же полезно, как варикоцелэктомия. Очевидно, положительный эффект и терапии, и варикоцелэктомии на фрагментацию ДНК сперматозоидов связан с уменьшением оксидативного стресса [3, 22–24].
Применению лекарственных препаратов с целью улучшения качества спермы у пациентов с варикоцеле, был посвящен обзор H. Garg и R. Kumar [25]. Авторы отмечают, что подобно эмпирической лекарственной терапией при идиопатическом мужском бесплодии эмпирическая медикаментозная терапия при бесплодии, связанном с варикоцеле, не анализировалась в хорошо проведенных исследованиях, которые могли бы обеспечить высокий уровень доказательности. Тем не менее показатели улучшения параметров спермы по сравнению с плацебо могут достигать 38–46% [25]. Проблема не только в малом числе исследований в этом направлении, но и в методических фактических ошибках, допускаемых исследователями. В частности, в большом отечественном проспективном исследовании [26] сравнили результаты микрохирургической варикоцелэктомии (n=728) с результатами консервативного лечения (n=107) и контрольной группой (n=56). Ожидаемо было показано, что варикоцелэктомия улучшает качество спермы, а именно: «привела к увеличению концентрации активно подвижных сперматозоидов у 64,9%, доли морфологически нормальных сперматозоидов – у 45,1%» [26, c. 81]. При этом в группе получавших лекарственную терапию (кломифен цитрат, витамины А, Е, селен, L-карнитин, пентоксифиллин, антиоксиданты – дозы не указаны) концентрация увеличилась у 29,9%, доля подвижных категории А – у 10,3%, уменьшилось число патологических форм у 0,9% пациентов. Но из законов статистики известно, что если какой-то показатель постоянно случайным образом меняется (например, любой показатель спермограммы [14]), то в отсутствие внешнего воздействия повторное значение с вероятностью примерно 50% будет или больше, или меньше исходного. Такие разнонаправленные и примерно одинаковые по величине изменения мы видели в контрольной группе в нашем исследовании (рис. 2). Поэтому нет никакого разумного объяснения, почему в группе пациентов, получавших терапию широко применяемыми для лечения мужского бесплодия препаратами, не только не получили никакого улучшения, о чем пишут авторы, а наоборот, произошло значительное ухудшение: если у 32 пациентов из 107 (29,9%) концентрация стала больше, то у 75 стала меньше, а по критерию знаков (Z) 75 из 107 это статистически значимое (p<0,001) ухудшение. Еще более выраженное ухудшение соответствует описанным изменениям подвижности и морфологии. Это ставит под сомнение достоверность выводов данной работы.
Недавний мета-анализ подтвердил, что терапия нутриентами улучшает результаты и после варикоцелэктомии [27].
Заключение. Варикоцелэктомия приводит к увеличению числа прогрессивно подвижных сперматозоидов в эякуляте через 3 мес. в среднем на 20 млн, при этом «клинически значимый» эффект (+7,2 млн) происходит в 2/3 случаев. Различия между микрохирургической и лапароскопической операциями незначимы, но стандартизованная эффективность через 3 мес. больше при лапароскопической операции, чем при микрохирургической (Es – 0,70 и 0,44, при 0,29 у получавших нутриенты и 0,22 в контрольной группе). Очевидно, это связано с более длительным периодом нормализации кровообращения после операции субингвинальным доступом. Варикоцелэктомия приводит к уменьшению фрагментации ДНК сперматозоидов в среднем на 5,5% с улучшением показателя у 59% пациентов, но 3-месячная терапия нутриентами снижает фрагментацию ДНК сходным образом (-5,5%; в 66 % наблюдений улучшение).



