Введение. Рак предстательной железы (РПЖ) является одним из наиболее часто встречающихся злокачественных новообразований у мужчин. Во всем мире РПЖ занимает второе место в структуре онкологической заболеваемости и шестое место в структуре онкологической смертности [1]. К факторам развития РПЖ относят естественное старение организма, генетическую предрасположенность, образ жизни и профессиональную вредность [2]. Учеными многократно высказывалось предположение о том, что не последнее место в канцерогенезе предстательной железы играет вирусная инфекция [3,4]. Наибольшую роль отводят таким вирусам, как вирус папилломы человека (ВПЧ, human papillomavirus – HPV), вирус простого герпеса 1-го и 2-го типов (Herpes simplex virus – HSV-1 и HSV-2), вирус герпеса 6-го типа (Human herpes virus – HHV-6), цитомегаловирус (Cytomegalovirus – CMV), вирус Эпштейна–Барр (Epstein–Barr virus – EBV) [5].
Герпесвирусы вовлечены в патогенез некоторых онкологических заболеваний, таких как рак шейки матки [6], рак желудка [7], рак мочевого пузыря [8,9], лимфопролиферативные заболевания [10]. Высказываются предположения относительно взаимосвязи герпесвирусов и РПЖ, однако данные, подтверждающие такую взаимосвязь, крайне ограниченны. Наличие HSV-2 ассоциировано с повышенным риском рака предстательной железы (ОШ=1,209; 95%ДИ=1,003–1,456), в то время как для HHV-8 аналогичной взаимосвязи обнаружено не было [11]. Наличие ВПЧ (без деления на типы) в ткани предстательной железы одними исследователями рассматривается как фактор, ассоциированный с повышенным риском канцерогенеза этого органа [12, 13], в то время как другие предполагают наличие такой взаимосвязи только для ВПЧ-16 [14, 15].
С учетом неоднозначности и ограниченности данных о взаимосвязи различных представителей семейства герпесвирусов и РПЖ нами было проведено собственное исследование, целью которого было оценить взаимосвязь вирусной инфекции с РПЖ, а также с клинико-морфологическими особенностями доброкачественной гиперплазии предстательной железы (ДГПЖ) и РПЖ.
Материалы и методы. В настоящее исследование включены 98 пациентов, прооперированных по поводу ДГПЖ или РПЖ в период с 2019 по 2021 г. РПЖ на дооперационном этапе был подтвержден у всех пациентов путем патоморфологического исследования биопсийного материала. Пациентам с ДГПЖ (n=48) была выполнена трансуретральная резекция простаты (ТУРП), а пациентам из группы РПЖ (n=50) – лапароскопическая или робот-ассистированная радикальная простатэктомия. В полученных образцах операционного материала проведена ПЦР в режиме реального времени на наличие вирусов папилломы человека (ВПЧ), вирусов простого герпеса 1-го и 2-го типов (HSV-1 и HSV-2), цитомегаловируса (CMV), вируса Эпштейна–Барр (EBV), вируса герпеса 6-го типа (HHV-6).
Биологический материал
Для проведения ПЦР-исследования была использована нативная ткань предстательной железы, фрагменты которой размером 5х5х5 мм были отобраны в процессе патоморфологического исследования и помещены отдельно в криопробирки с 1 мл реагента IntactRNA (Евроген, Россия) –
фиксатор, предназначенный для быстрой стабилизации клеточных нуклеиновых кислот в тканях. Далее образцы были инкубированы в течение часа при комнатной температуре (согласно инструкции к реагенту), а затем были помещены в холодильник с температурой -70о по Цельсию. Непосредственно перед исследованием образцы ткани размораживались, фиксатор IntactRNA удалялся с помощью механического одноканального дозатора, после чего ткань гомогенизировалась в пробирках типа «Эппендорф» объемом 1,5мл с помощью одноразовых тефлоновых пестиков. Полученный гомогенизат незамедлительно использовался для выделения ДНК.
Выделение ДНК из образцов ткани
ДНК выделялась набором реагентов ExtractDNA Blood&Cells (Евроген, Россия) согласно инструкции к набору. Выявление ДНК ВПЧ проводилось с помощью набора для ПЦР «АмплиСенс® ВПЧ ВКР генотип-титр-FL» (ЦНИИ эпидемиологии, Россия); ДНК ВПГ1 и ВПГ2 проводилась с помощью набора для ПЦР «АмплиПрайм® HSV-I / HSV-II» (Некст Био, Россия); ДНК цитомегаловируса (ЦМВ), вируса Эпштейна–Барр (ЭБВ), вируса герпеса 6-го типа (ВГ-6) с помощью набора реагентов для ПЦР «АмплиПрайм® EBV/CMV/HHV6» (Некст Био, Россия).
Проводилась количественная ПЦР ДНК образцов тканей предстательной железы вместе с контрольными образцами. Несмотря на это, оценивалось присутствие и количество каждого из генотипов в формате «геномный эквивалент на реакцию» с известной концентрацией фрагментов вирусной ДНК. Постановка ПЦР выполнялась в стандартных прозрачных ПЦР-планшетах на 96 лунок с помощью термоциклера C1000 с оптическим модулем CFX96 Touch (Bio Rad, США), по программе температурного цикла и режима измерения флуоресценции, согласно инструкциям к вышеуказанным наборам реагентов для ПЦР. Полученные прибором данные измерения уровня флуоресценции по 4 каналам детекции обрабатывались с помощью программы CFX Manager v.3.0 (Bio Rad, США). Значение концентрации ДНК человека в образцах ДНК по фрагменту b-глобинового гена составляло не менее 1000 геномных эквивалентов на реакцию, при построении калибровочной прямых коэффициент корреляции (R^2) составил не менее 0,9, показатель эффективности ПЦР по стандартным образцам – в диапазоне 0,8–1,2.
Статистическая обработка данных проведена при помощи программного обеспечения STATISTICA12. Оценка нормальности распределения выполнена при помощи критерия Колмогорова–Смирнова. Сравнение показателей в двух группах для непрерывных нормально распределенных переменных проведено с использованием критерия Т-Стьюдента, для непрерывных ненормально распределенных переменных с использованием критерия Манна–Уитни, для номинальных переменных с использованием Хи-квадрата. Различия считались статистически значимыми при p<0,05.
Результаты. В настоящее исследование было включено 98 больных, средний возраст составил 68,3 года. Из них у 48 (49%) мужчин была диагностирована ДГПЖ (средний возраст – 69,6 года), а у 50 (51%) мужчин диагностирован РПЖ (средний возраст – 67,2 года). Общая характеристика выборки и сравнение основных показателей между пациентами с ДГПЖ и РПЖ представлены в табл. 1. В ходе анализа установлено, что для пациентов с РПЖ помимо меньшего объема предстательной железы и более высокого уровня ПСА была характерна большая частота выявляемости вирусов в ткани предстательной железы по сравнению с пациентами с ДГПЖ: 50,0 и 31,3% соответственно, р=0,046. Также у пациентов с РПЖ ночная поллакиурия встречалась реже, чем у пациентов с ДГПЖ, что может быть связано с большим объемом предстательной железы среди последних.
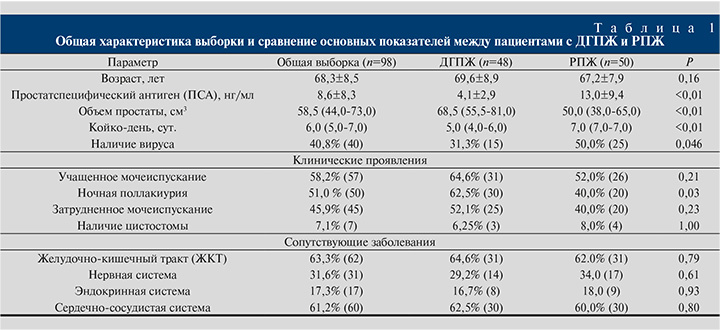
Распределение вирусов, выделенных из ткани пациентов с ДГПЖ и РПЖ, представлено на рис. 1 А и Б соответственно.
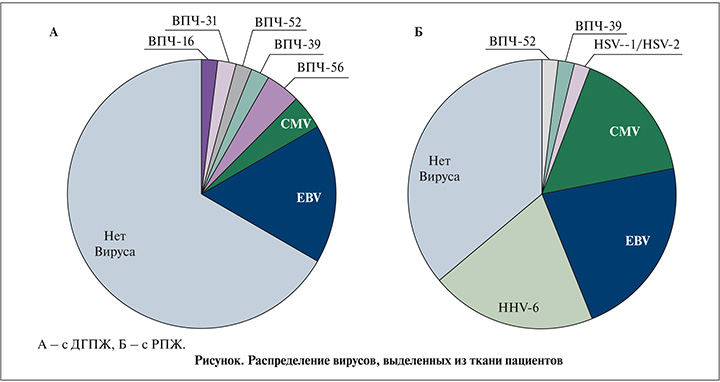
У пациентов с РПЖ вирус в ткани предстательной железы встречался гораздо чаще, чем у пациентов с ДГПЖ, причем самым распространенным вирусом как при РПЖ, так и при ДГПЖ оказался EBV. Вторым по частоте встречаемости вирусом у пациентов с РПЖ оказался HHV-6, который не был выявлен ни у одного из пациентов с ДГПЖ. Сравнение и процентное распределение вирусов в двух группах представлены в табл. 2.
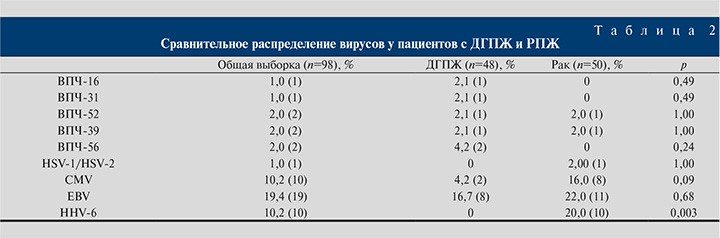
Как видно из табл. 2, единственным значимо отличающимся в двух группах вирусом оказался HHV-6, присутствовавший у 20% пациентов с РПЖ и не выявляемый у пациентов с ДГПЖ (р=0,003). Отмечалась тенденция более частого выявления CMV среди пациентов с РПЖ (16,0% для РПЖ и 4,2% для ДГПЖ), однако различия оказались статистически незначимыми при пограничных значениях р (р=0,09).
С учетом небольшого количества отдельно взятых вирусов в каждой из групп дальнейший анализ проводился исходя из наличия или отсутствия вируса. Все обследуемые пациенты были разделены на две группы в зависимости от наличия или отсутствия вирусной инфекции в ткани предстательной железы: в первую группу вошли 58 больных (59,2%), не являвшихся носителями вирусной инфекции, в то время как у 40 других больных (40,8%) была диагностирована вирусная инфекция. Сравнение основных клинико-морфологических характеристик среди пациентов с вирусной инфекцией и без нее представлено в табл. 3. В ходе анализа было обнаружено, что для пациентов с вирусной инфекцией в предстательной железе был характерен более продолжительный срок госпитализации, это может быть связано с большим распространением рака предстательной железы в данной группе: рак предстательной железы среди пациентов-вирусоносителей встречался в 62,5% наблюдений, в то время как среди пациентов без носительства вирусной инфекции – в 43,1% (р=0,046).
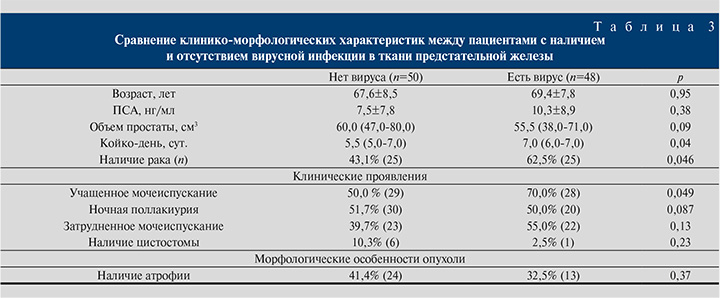
На следующем этапе проведен раздельный анализ основных клинико-морфологических характеристик в двух группах: среди пациентов с ДГПЖ и РПЖ в зависимости от наличия или отсутствия вирусной инфекции в ткани предстательной железы. Результаты представлены в табл. 4.
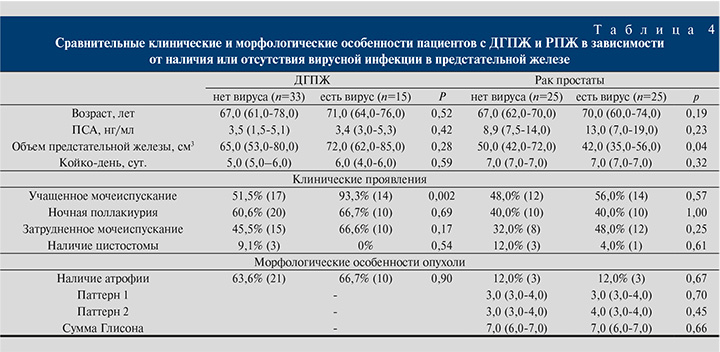
У больных ДГПЖ и вирусной инфекцией чаще отмечалось учащенное мочеиспускание по сравнению с пациентами без вирусной инфекции: 93,3 против 51,5% (р=0,002). По остальным параметрам группы оказались сопоставимыми. У больных РПЖ без вирусной инфекции средний объем предстательной железы оказался больше, чем в группе РПЖ с вирусной инфекцией (50,0 см3 и 42,0 см3 соответственно, р=0,04). По остальным параметрам группы оказались сопоставимыми. Для пациентов с РПЖ без наличия вирусной инфекции второй паттерн по шкале Глисона составил 3,0 баллов, в то время как при наличии вирусной инфекции – 4,0 балла, однако различия оказались статистически незначимыми, это связано с малой выборкой пациентов в указанной группе.
Обсуждение результатов. Вирусные инфекционные агенты участвуют в канцерогенезе шейки матки, печени, желудка, а также кожи [16]. Наибольшая доказательная база представлена для рака шейки матки: показано, что он ассоциирован с ВПЧ-16, ВПЧ-18 типов. В 2022 г. S. Pimple и соавт. утверждали, что шанс возникновения рака шейки матки у женщин, инфицированных ВПЧ-16, ВПЧ-18 типами, может достигать 70% [6]. В настоящее время появились исследования ассоциации вирусов у мужчин с онкологическими заболеваниями органов репродуктивной системы [17, 18]. Самым распространенным гендерно-ассоциированной злокачественной опухолью у мужчин является рак предстательной железы [1]. Однако многие авторы рассматривают вирусную инфекцию в качестве лишь возможного фактора риска этиопатогенетического звена [3, 19]. В связи с этим наше исследование было посвящено влиянию сопутствующей вирусной инфекции с потенциальным онкогенным действием на клинико-морфологические особенности ДГПЖ и РПЖ.
У пациентов с вирусной инфекцией РПЖ встречался в 62,5% случаев, в то время как среди больных без РПЖ – в 43,1%. Наиболее часто встречающимся вирусом в общей выборке был вирус Эпштейна–Барр (19,4%), однако различия в частоте встречаемости данного вируса у пациентов с РПЖ и ДГПЖ выявлено не было. Вторым по частоте встречаемости вирусом у пациентов с РПЖ оказался HHV-6, который не был обнаружен у пациентов с ДГПЖ, а третьим по распространенности оказался цитомегаловирус.
Первые публикации относительно взаимосвязи герпесвирусов и РПЖ появились еще в 1980-х гг., однако дальнейшего активного развития данное направление не получало на протяжении 40 лет и на сегодняшний день литературные данные все еще существенно ограниченны. В 1973 г. в исследовании Y. M. Centifanto и совт. при электронной микроскопии в клетках аденокарциномы предстательной железы были обнаружены частицы герпесвирусов, что не было характерно для образцов пациентов с ДГПЖ [20].
В 1977 г. E. J. Sanford и соавт. показали, что цитомегаловирус, выделенный из ткани предстательной железы в экспериментах in vitro и in vivo, способен трансформировать нормальные клетки предстательной железы в клетки со злокачественным потенциалом [21]. После трансформации большинство клеток аденокарциномы прекращало экспрессировать антигены CMV, это рассматривалось исследователями как защитный механизм опухоли от опосредованной лимфоцитами цитотоксичности. При этом в таких условиях в сыворотке крови определяется высокий титр антител против CMV [21]. CMV встречался в гистологическом материале рака простаты и согласно данным отечественных коллег. Согласно Р. Б. Самосонову и соавт. (2012) 87% изученных образцов рака простаты содержали генетический материал CMV. Дополнительно выявленными вирусами были EBV, HHV-8 и HPV [22]. Позднее данной группой ученых было установлено, что у больных, находящихся на разных подстадиях стадии Т2, вирусная нагрузка увеличивается от Т2а до Т2с [23]. Полученные данные, по мнению авторов, показывают, связь между CMV и РПЖ может быть больше, чем просто случайность [21].
В 1983 г. I Boldogh и соавт. проанализировали распределение CMV и HSV-2 в ткани предстательной железы. ДНК CMV была обнаружена в 2 из 9 образцов ДГПЖ и в 3 из 10 образцов РПЖ, в то время как ДНК HSV-2 у пациентов с ДГПЖ не выявлялась, а у пациентов с РПЖ присутствовала в 2 образцах [19]. На данные работы, сделанные еще в конце XX в. ссылается большое количество более поздних литературных обзоров, опубликованных уже в XXI в., где обсуждается роль вирусной инфекции в канцерогенезе предстательной железы [21, 24]. Однако к единому мнению и однозначному ответу исследователи все еще не пришли в связи с отсутствием современных экспериментальных работ в данном направлении. Тем не менее наше исследование запустило данный процесс, предоставив экспериментальные обоснования поднятым ранее вопросам. В нашей работе показано, что CMV встречался у 8 (16%) из 50 пациентов с РПЖ и у 2 (4,2%) из 48 пациентов с ДГПЖ , однако, несмотря на имеющуюся тенденцию, различия оказались статистически незначимыми (р=0,09). Для HSV-1 и HSV-2 различий в частоте встречаемости обнаружено не было в связи с низким распространением данного вируса в исследуемой группе пациентов: HSV-1 и HSV-2 встречались у 1 пациента с ДГПЖ и не встречались у пациентов с РПЖ.
Наибольший интерес представляют данные относительно HHV-6, который в настоящем исследовании встречался только у пациентов с РПЖ. HHV-6 представляет собой тропный к Т-лимофоцитам вирус, выделенный у пациентов с оппортунистическими инфекциями и лимфопролиферативными заболеваниями [25, 26]. HHV-6 является возможным кофактором вируса иммунодефицита человека путем совместного поражения CD4+ Т-клеток с ускоренным цитопатическим эффектом [27]. HHV-6 может встраивать свой геном в участок 17р13 хромосомы 17, потенциально влияя таким образом на онкогенез [28]. В нашей работе впервые было показано, что HHV-6 обнаружен у 20% пациентов с РПЖ и не был выявлен у пациентов с ДГПЖ (p=0,003); это может косвенно судить о его возможной роли в канцерогенезе РПЖ. Впрочем публикаций, подтверждающих данную взаимосвязь при РПЖ, на сегодняшний день нет. Тем не менее в литературе представлен ряд работ, указывающих на роль вируса герпеса 6-го типа при раке желудка [29,30], раке яичников [31], раке грудной железы [32]. Дополнительно в работе Alberto L. Escudero и соавт. (2005) была установлена ассоциация герпеса вируса 6-го типа в раке мочевого пузыря, где все образцы с наличием ДНК герпеса вируса 6-го типа имели высокую степень злокачественности. При этом в контрольных образцах (без рака мочевого пузыря) ДНК рассматриваемого вируса обнаружена не была [8].
Таким образом, полученные нами предварительные результаты указывают на возможную роль герпеса вируса 6-го типа в канцерогенезе предстательной железы. Однако с учетом отсутствия подтверждающих данную теорию публикаций тема требует дальнейшего углубленного изучения. Вместе с тем CMV гораздо чаще встречается у пациентов с РПЖ, но в то же время различия оказались статистически незначимыми.
Основным ограничением настоящего исследования является объем изучаемой выборки, что не позволило провести полноценный анализ с учетом каждого конкретного вируса. Между тем, учитывая промежуточный характер исследования, мы планируем избежать данного ограничения после завершения набора выборки.
Заключение. В последние годы все чаще обсуждается, что герпесвирусы могут играть определенную роль в канцерогенезе предстательной железы. Однако имеющиеся на сегодняшний день литературные данные, подтверждающие такую взаимосвязь, весьма ограниченны. В настоящем исследовании впервые показано наличие ассоциации между раком предстательной железы и HHV-6, который не встречался у пациентов с доброкачественной гиперплазией предстательной железы. Помимо этого нами выявлена тенденция более частой встречаемости CMV у пациентов с раком предстательной железы по сравнению с пациентами с доброкачественной гиперплазией. Для подтверждения выявленной взаимосвязи необходимо проведение дальнейшего исследования с привлечением большей когорты пациентов, что позволит составить представление о многоступенчатом процессе злокачественной трансформации и, возможно, откроет новые терапевтические возможности для профилактики и лечения.



