Введение. Рак предстательной железы (РПЖ) представляет собой актуальную проблему современной онкоурологии, сохраняя за собой лидирующие позиции в структуре заболеваемости злокачественными новообразованиями по всему миру; отмечается тенденция роста показателя заболеваемости РПЖ [1–5]. У пациентов, перенесших трансплантацию сердца (ТС), онкологические заболевания являются наиболее частой причиной смерти, поскольку обязательное применение препаратов, вызывающих иммуносупрессию у пациентов после ТС, повышает риск развития злокачественных новообразований [6, 7]. На онкогенез после ТС влияет множество механизмов, в том числе снижение иммунореактивности пациента из-за хронической иммуносупрессии, повышенное влияние онкогенных вирусов, интенсивность и продолжительность иммуносупрессии [8].
Основные методы лечения локализованного РПЖ включают активное наблюдение, лучевую терапию (брахитерапию и дистанционную лучевую терапию) с гормональной терапией или без нее и хирургическое вмешательство [9]. Вместе с тем большинство лечебных воздействий, которые применяются при онкологических заболеваниях, могут возыметь нежелательные последствия у пациентов после ТС. В частности, препараты для андроген-депривантной терапии, химиопрепараты различных групп имеют кардиотоксичное действие, что обусловливает ограничение их применения у больных после ТС [10]. На сегодняшний день отсутствуют крупные исследования, в которых изучались бы преимущества какого-либо из этих методов лечения у пациентов с пересаженным сердцем и РПЖ.
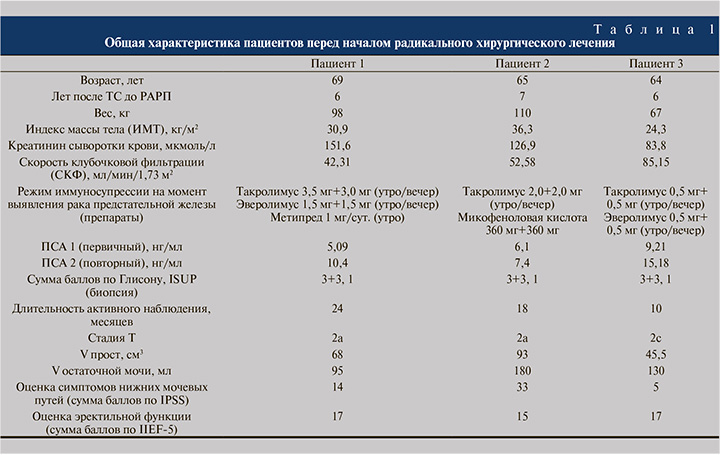
Материалы и методы. За период с февраля 2021 по ноябрь 2021 г. в НМИЦ им В. А. Алмазова были выполнены три робот-ассистированные радикальные простатэктомии по поводу локализованного РПЖ у пациентов после перенесенной ТС. Всем пациентам была осуществлена ортотопическая ТС по бикавальной методике в условиях экстракорпорального кровообращения. У всех больных был ишемический генез хронической сердечной недостаточности. Одному пациенту операция выполнена в 2014 г., двум другим – в 2015 г. Поддерживающая иммуносупрессивная терапия включала применение ингибиторов кальциневрина (n=3; такролимуса), антиметаболитов (n=1; микофеноловая кислота), блокаторов mTOR (mammalian target of rapamycin) (n=2; эверолимус) и глюкокортикостероидов (n=1; метилпреднизолон). Несмотря на диагностированную онкопатологию, один из пациентов продолжил получать микофеноловую кислоту в связи с наличием в анамнезе нежелательного явления на применение эверолимуса. При плановом обследовании у всех больных выявлено повышение уровня простатоспецифического антигена (ПСА), в связи с чем после дообследования (ультразвуковое исследование [УЗИ] малого таза, магнитно-резонансная томография/мультиспиральная компьютерная томография [МРТ/МСКТ] малого таза) была выполнена трансректальная мультифокальная биопсия предстательной железы, гистологически верифицирована аденокарцинома. Также во всех случаях выполнялась позитронно-эмиссионная томография (ПЭТ)/КТ всего тела с 68Ga-простат-специфическим мембранным антигеном (ПСМА). На момент установки диагноза у всех троих пациентов имел место локализованный процесс низкого риска, в связи с чем консилиумом было принято решение об активном наблюдении. Во всех трех случаях за период наблюдения (10–24 мес.) зафиксировано повышение уровня ПСА в динамике, в связи с чем пациентам предложено радикальное лечение. С учетом большого количества остаточной мочи у всех троих пациентов лучевые методы лечения не рассматривались и была избрана тактика оперативного вмешательства в объеме робот-ассистированной радикальной простатэктомии (РАРП). Основные демографические и предоперационные показатели представлены в табл. 1.
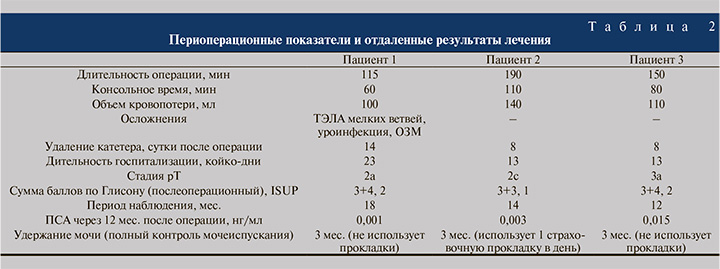
Результаты. Все пациенты были госпитализированы за 3–4 дня до планируемой операции. Подготовка к операции, а также курация пациентов осуществлялись совместно урологами и кардиологами-трансплантологами. В рамках подготовки перед операцией была выполнена редукция иммуносупрессивной терапии (пропуск микофеноловой кислоты/эверолимуса) с вечера накануне операции и в день хирургического вмешательства. Также временно отменен прием антиагрегантов (n=2) и новых оральных антикоагулянтов (n=1) с последующим назначением подкожных инъекцией эноксапарина натрия. После стабилизации состояния пациентов и отмены антикоагулянтов прямого действия возобновлен прием антиагрегантов или апиксабана. Основные периоперационные показатели изложены в табл. 2.
Пациент 1:
Пациент В. 69 лет в 2015 г. перенес ТС по бикавальной методике по поводу ишемической болезни сердца (ИБС), постинфарктного кардиосклероза (ПИКС) (острый инфаркт миокарда [ОИМ] от 2010 г.) с исходом в дилатацию камер сердца, хроническую сердечную недостаточность (ХСН) III–IV функционального класса (ФК). В анамнезе также имплантация постоянного электрокардиостимулятора, тромбоэмболия легочной артерии, хроническая болезнь почек (ХБП) С3б.
В качестве поддерживающей имунносупрессивной терапии пациент принимал таблетки такролимус в дозировке 3,0 мг в 08.00 и 3,0 мг в 20.00, таблетки эверолимус 1,50 мг в 10.00 и 1,25 мг в 22.00. В связи с планируемым оперативным вмешательством последний был отменен вечером накануне перед операцией, его прием был возобновлен на следующий день после операции.
Следует отметить, что у пациента после пересадки по результатам элетрокардиографии (ЭКГ) регистрируется два водителя ритма (электрофизиологическая особенность работы сердечного трансплантата) и ритм работы кардиостимулятора, что затрудняет диагностику нарушений ритма. Учитывая это, у хирурга было существенное ограничение в использовании монополярной коагуляции, что в свою очередь затрудняло процесс выполнения операции, особенно в условиях постоянного приема препаратов, влияющих на систему гемостаза (до госпитализации пациент принимал ривороксабан 15 мг/день, в день госпитализации переведен на подкожные инъекции эноксапарина натрия в дозировке 0,8 мл 2 раза в день). Со дня поступления проводилась инфузионная терапия (гидратация изотоническим физиологическим раствором 1000 мл в сутки) для профилактики прогрессии почечной дисфункции. С первых суток послеоперационного периода объем инфузии составлял 2000 мл/сут. со спазмалитиком (дротаверин 20 мг). В связи с нарастанием почечной дисфункции к инфузионной терапии добавлен S. Euphillini 10 мл – 2,4%. С учетом выпитой жидкости и инфузионной терапии введенный объем составлял 4 л/сут. под контролем суточного диуреза и жидкостного баланса, а также показателей азотемии.
02.02.2021 в ФГБУ «НМИЦ им В. А. Алмазова» выполнена робот-ассистированная радикальная простатэктомия.
В послеоперационном периоде выполнялись контроль артериального давления и пульса дважды в день, трехчасовая термометрия. На 3-и сутки послеоперационного периода у пациента была диагностирована тромбоэмболия мелких ветвей легочной артерии (ТЭЛА) (с повышением уровня Д-димера до 1,790 мкг/мл FEU, подтверждена при МСКТ органов грудной клетки). С учетом иммунокомпрометированного статуса, появления фебрильной лихорадки, нарастания уровня С-реактивного белка назначена антибактериальная терапия. Применение антикоагулянтов продолжено. С целью оценки функции сердечного трансплантата на 4-е сутки после операции выполнялась эхокардиография (Эхо-КГ), при которой функциональные нарушения функции не выявлены. С четвертых суток послеоперационного периода в связи с текущим воспалительным процессом прием эверолимуса был приостановлен и возобновлен с 15-х суток после операции. В раннем послеоперационном периоде помимо этого отмечалось повышение уровня креатинина крови до 223 мкмоль/л, по поводу чего проводилась инфузионная терапия под конт-ролем электролитного баланса. Следует также отметить, что в послеоперационном периоде отмечались повторные эпизоды повышения температуры тела до фебрильных значений (максимально 38,6оС), что было связано с инфекцией мочевыводящих путей, и сопровождались минимальным повышением воспалительных маркеров; лейкоцитоза не наблюдалось, максимальный уровень С-реактивного белка составлял 31,4 мг/л. На фоне проводимой антибактериальной противовоспалительной дезинтоксикационной терапии отмечалась положительная динамика. На 7-е сутки после операции выполнена цистография, по результатам которой экстравазации контрастного вещества за пределы везикоуретрального анастомоза не наблюдалось. В тот же день был удален уретральный катетер, после чего возникла острая задержка мочи и был вновь установлен уретральный катетер. На 14-е сутки после повторного проведения цистографии уретральный катетер был удален. Пациент выписан из стационара на 15-е сутки после операции в удовлетворительном состоянии.
Пациент 2:
Пациенту Ф. 65 лет в 2014 г. выполнена ортотопическая ТС по бикавальной методике по поводу ИБС, стенокардии напряжения III ФК. ПИКС. ХСН III ФК.
В анамнезе: гипертоническая болезнь III стадии, риск – 4, хронический бронхит с частыми обострениями, двусторонняя полисегментарная пневмония 2016 г.
В качестве поддерживающей имунносупрессивной терапии пациент принимал таблетки такролимус 2,0 мг в 08.00 утра и 1,5 мг в 20.00 вечера по четным/2,0 мг в 08.00 утра и 2,0 мг в 20.00 вечера по нечетным дням, а также таблетки микофеноловой кислоты 360 мг в 10.00 и 360 мг в 22.00, последний был временно отменен в связи с оперативным вмешательством (за день до операции). Прием микофеноловой кислоты был возобновлен с 4-х суток послеоперационного периода. Со дня поступления в стационар пациент был переведен с приема таблеток ацетилсалициловой кислоты 100 мг утром на подкожные инъекции эноксапарина натрия в дозировке 0,8 мл/сут. (с последующим возобновлением приема ацетилсалициловой кислоты в прежней дозировке с 5-х суток послеоперационного периода). Со дня поступления проводилась инфузионная терапия аналогично, как у пациента 1.
26.08.2021 больному выполнена робот-ассистированная радикальная простатэктомия. Послеоперационный период протекал без осложнений. Дренаж из брюшной полости удален на 3-и сутки послеоперационного периода. По результатам цистографии, выполненной на 7-е сутки после операции, признаков экстравазации контрастного вещества за пределы везикоуретрального анастомоза не выявлено. Уретральный катетер удален на 8-е сутки после операции. Отмечено немедленное удержание мочи после удаления катетера. В контрольных анализах крови и мочи – без воспалительной реакции. Пациент выписан на амбулаторное лечение в удовлетворительном состоянии на 11-е сутки после операции.
Пациент 3:
Пациенту Г. 64 лет в 2015 г. выполнена ортотопическая трансплантация сердца по бикавальной методике по поводу ИБС, стенокардии напряжения III ФК, постинфарктного кардиосклероза (ИМ 1996, 2014) с исходом в дилатацию камер сердца.
В анамнезе: гипертоническая болезнь III ст. Риск – 4. Первичная дисфункция трансплантата, правожелудочковая недостаточность, легочная гипертензия от 21.08.2015, реконвалесцент. Острое почечное повреждение от 21.08.2015, реконвалесцент. Внебольничная пневмония от 2016, 2019, 2020 гг., реконвалесцент. Хроническая обструктивная болезнь легких (ХОБЛ) II стадии, ремиссия.
В качестве поддерживающей иммуносупрессивной терапии пациент принимал таблетки такролимус (1 мг 2 раза в день), а также таблетки эверолимус (0,5 мг 2 раза в день), последний был временно отменен в связи с оперативным вмешательством (за день до операции). Прием эверолимуса был возобновлен на следующий день после операции. Пациент также принимал в постоянном режиме таблетки ацетилсалициловой кислоты 100 мг/сут. – препарат также был временно отменен за 5 дней до операции, со дня поступления в стационар пациент был переведен на подкожные инъекции эноксапарина натрия в дозировке 0,4 мл дважды в сутки. Пациент снова был переведен на прием антиагреганта в прежней дозировке с 5-х суток послеоперационного периода. Со дня поступления проводилась инфузионная терапия аналогично, как у пациентов 1 и 2.
09.11.2021 в ФГБУ «НМИЦ им В. А. Алмазова» выполнена робот-ассистированная радикальная простатэктомия. В послеоперационном периоде без осложнений. Дренаж удален на 3-и сутки после операции. На 8-е сутки после операции выполнена цистография, по данным которой признаков экстравазации контрастного вещества в проекции везикоуретрального анастомоза нет. Мочевой катетер удален на 8-е сутки послеоперационного периода. После удаления катетера отмечается немедленное удержание мочи. Пациент был выписан на амбулаторное лечение в удовлетворительном состоянии на 11-е сутки послеоперационного периода.
Ни у одного из пациентов в течение периода наблюдения (12–18 мес., в среднем 14,6 мес.) не отмечено биохимического рецидива РПЖ, прогрессирования заболевания – показатели ПСА крови в пределах нормы (0,001–0,015 нг/мл).
Во всех наблюдениях восстановление удержания мочи отмечено к 3-му месяцу после операции (пациенты используют не более 1 «страховочной» урологической прокладки в день). Ни в одном наблюдении не было зафиксировано поздних послеоперационных осложнений за период наблюдения.
Обсуждение. РПЖ является одним из наиболее часто встречающихся онкологических заболеваний у пациентов после ТС [11, 12]. В крупном исследовании Liauw и соавт. были проанализированы результаты лечения 320 больных РПЖ после трансплантации органов. Авторы заключают, что пациенты после трансплантации солидных органов, в том числе сердца, должны получать лечение в соответствии с текущими стандартами оказания медицинской помощи онкологическим больным, в том числе опцию активного наблюдения при РПЖ низкого риска [13].
Существуют работы, демонстрирующие эффективность лучевой терапии в лечении РПЖ у пациентов, перенесших ТС. Так, в исследовании Oh и соавт., в котором представлено 28 наблюдений проведения радиотерапии (брахитерапии и дистанционной лучевой терапии) пациентам после предшествовавшей трансплантации солидных органов были достигнуты хорошие онкологические результаты, в том числе показатели безрецидивной (95,8%) и общей (93,8%) выживаемости при приемлемом уровне токсичности [14].
В исследовании Coombs и соавт. продемонстрированы сопоставимые с общей популяцией больных РПЖ онкологические показатели при брахитерапии пациентов с РПЖ после трансплантации органов [15].
Первое клиническое наблюдение выполнения радикальной позадилонной простатэктомии у больного с трансплантированным сердцем было представлено в 1995 г. G. Ciancio и соавт. (США) [16]. С тех пор хирургическое лечение у этой категории пациентов успешно применяется в экспертных центрах. Несмотря на это, на данный момент не существует крупных исследований, посвященных робот-ассистированной радикальной простатэктомии у пациентов, перенесших трансплантацию сердца. Мировые данные ограничиваются единичными представлениями клинических наблюдений. В 2012 г. Axcrona и соавт. (Норвегия) было опубликовано представление клинического наблюдения выполнения РАРП пациенту после перенесенной ТС [17]. В 2013 г. еще одно клиническое наблюдение выполнения подобной операции представлено Singh и соавт. (США)[18]. В обоих наблюдениях решение о необходимости выполнения радикальной простатэктомии принято на основании повышения уровня ПСА крови во время периода наблюдения (поскольку оба пациента были квалифицированы в группу активного наблюдения в связи с локализованным процессом низкого риска). Также Rose и соавт. в своем исследовании проанализировали 20 наблюдений проведения робот-ассистированных радикальных простатэктомий пациентам с трансплантацией солидных органов, из которых у 3 больных имела место ТС. В данной работе заключается, что робот-ассистированная радикальная простатэктомия является технически осуществимым методом лечения тщательно отобранных пациентов с трансплантацией солидных органов [19].
Насколько нам известно, мы представляем первое наблюдение выполнения роботизированной лапароскопической радикальной простатэктомии у пациента с предшествующей трансплантацией сердца в России и Восточной Европе. Интраоперационных и послеоперационных осложнений не было, также не было никаких осложнений во время проведения анестеологического пособия. Время операции было сопоставимым со средним временем робот-ассистированной простатэктомии, сделанной в нашем учреждении. Длительность госпитализации у пациентов после трансплантации сердца была значимо больше, чем в общей когорте пациентов, в связи с более длительной подготовкой к вмешательству, а также более длительным наблюдением после удаления мочевого катетера [20]. В послеоперационном периоде у пациентов не было никаких клинических, инструментальных признаков сердечно-сосудистой декомпенсации.
У пациентов не было выявлено клинических признаков каких-либо серьезных послеоперационных осложнений. Считаем обязательным ведение таких пациентов совместно с кардиологом-трансплантологом, обязательное обсуждение каждого пациента на мультидисциплинарном консилиуме с участием уролога, онколога, кардиолога-трансплантолога, анестезиолога-реаниматолога.
Заключение. Настоящий отчет свидетельствует о технической возможности применения робот-ассистированной радикальной простатэктомии у пациентов после трансплантации сердца с удовлетворительными периоперационными показателями, а также онкологическими и функциональными исходами.
В работе с такими пациентами считаем важными следующие пункты:
- Ведение, подготовка к операции, а также лечение в послеоперационном периоде таких пациентов должно осуществляться в условиях многопрофильного центра экспертного уровня с участием мультидисциплинарной команды врачей – урологов, онкологов, кардиологов-трансплантологов и других специалистов.
- Диспансеризация пациентов позволяет своевременно выявлять онкопатологию в посттрансплантационном периоде и подготавливать пациента к плановому оперативному вмешательству. В случае развития осложнений и сопутствующих заболеваний преемственность между врачами различных специальностей и трансплантологами, как и между амбулаторным и стационарным этапами наблюдения, позволяет индивидуализировать алгоритм ведения больного и улучшает его выживаемость.
- Хирургическое вмешательство после ТС должно проводиться на фоне временной редукции иммусупрессивной терапии. Также подготовка больных включает выбор антибиотикопрофилактики с учетом лекарственных взаимодействий и данных анамнеза, коррекции кроверазжижающей терапии и проведения инфузионной терапии для профилактики ухудшения почечной дисфункции.
- Техника выполнения хирургического вмешательства трансплантированным пациентам значимо не отличается от общепринятых методик, но требует учета перенесенных в анамнезе операций и сопутствующих заболеваний.
- При оценке течения раннего послеоперационного периода у реципиентов сердца должны учитываться следующие особенности: атипичная симптоматика из-за иммунокомпрометированного статуса, наличие денервированного сердца (низкая вариабельность частоты сердечных сокращений (ЧСС), синусовая тахикардия, два водителя ритма из синусового узла), динамика исходной анемии, концентрации иммуносупрессивных препаратов и влияние применяемых антикоагулянтов.



