Рубцовая деформация шейки мочевого пузыря (РДШМП) характеризуется развитием соединительнотканного рубцового процесса вследствие воспаления в области шейки мочевого пузыря с частичным вовлечением в процесс мочеиспускательного канала и стенки мочевого пузыря [1]. РДШМП была впервые описана американским урологом F. M. Denslow в 1918 г. в виде осложнения открытого хирургического лечения гиперплазии простаты [2]. В настоящее время РДШМП наиболее часто встречается в качестве осложнения после эндоскопических оперативных вмешательств на простате [3–5]. Среди осложнений после трансуретральной резекции простаты (ТУРП) встречаемость РДШМП находится в диапазоне от 4,9 [5] до 12,3% [6]. Частота развития РДШМП после аденомэктомии, по данным Европейской ассоциации урологов, составляет 6% [7]. По данным анализа более 2000 пациентов с РДШМП, статистически достоверной разницы в группах ТУР и энуклеации по частоте возникновения рубцовой деформации выявлено не было [8].
Для лечения РДШМП можно рассматривать инцизию холодным ножом, биполярную и монополярную электрорезекцию, лазерную инцизию и установку простатического стента [5]. Как правило, первым этапом проводят эндоскопическое лечение, при этом показатель его эффективности не превышает 72% [9]. При возникновении рецидива, пациенты рассматриваются как резистентные к эндоскопическому лечению, тогда может быть выполнено более радикальное лечение, в т.ч. открытые или лапароскопические реконструктивные операции, в отдельных случаях вплоть до выполнения простатэктомии [10, 11].
С учетом высокой частоты развития РДШМП, а также высокой частоты неэффективности первичного лечения было предложено множество альтернативных методик, среди которых можно выделить комбинацию эндоскопического оперативного лечения с последующим введением антипролиферативных агентов (митомицин С, триамцинолон), регенеративных агентов (гиалуронидазы, препаратов коллагена), а также применение эндоуретральной брахитерапии. Эффективность комбинированного лечения не превышает 72–93% [9, 12–14].
Одним из наиболее перспективных малоинвазивных методов профилактики рецидива РДШМП является баллонная дилатация рубцово-деформированной шейки мочевого пузыря под трансректальным ультразвуковым контролем. Метод был разработан и предложен коллективом кафедры урологии и андрологии факультета фундаментальной медицины МГУ им. М. В. Ломоносова в 2019 г. [15].
Баллонная дилатация рубцово-деформированной шейки мочевого пузыря под трансректальным ультразвуковым контролем
Баллонная дилатация рубцово-деформированной шейки мочевого пузыря под трансректальным ультразвуковым контролем – малоинвазивная манипуляция, которую можно выполнять в амбулаторных условиях в качестве метода профилактики рецидива РДШМП после этапа эндоскопического лечения.
Данная методика подразумевает производимую под ТРУЗ-контролем (трансректальным ультразвуковым контролем) установку уретрального катетера Фолея, позиционирование баллона катетера в поперечнике рубцового кольца и раздувание его до формирования изгиба по типу «талии». Это позволяет производить постепенное эластическое растяжение шейки мочевого пузыря, предохраняя ее от избыточной травматизации и агрессивного рубцевания, после чего аналогичное раздувание производится непосредственно в ложе удаленной транзиторной зоны простаты с длительностью экспозиций в обоих случаях в течение 5 мин. Лечебный эффект в данном случае достигается за счет стабилизации рубцового кольца на уродинамически приемлемом уровне на фоне систематического и неагрессивного растяжения рубцового кольца баллоном уретрального катетера. Процедура осуществляется в несколько сеансов до получения желаемого эффекта и закрепления результатов растяжения шейки мочевого пузыря. Оптимальным сроком начала лечения является срок в 3 нед. от момента оперативного лечения. Повторные сеансы проводятся по схеме 1 раз в 3–6 нед. с постепенным увеличением интервала между сеансами, с длительностью курса не менее 4 процедур [16].
По данным открытого рандомизированного проспективного контролируемого (с параллельным контролем) одноцентрового исследования [17], эффективность эндоскопического лечения РДШМП в сочетании со стандартной медикаментозной терапией в группе из 75 пациентов составила 72,0 %, в то время как в группе эндоскопического лечения РДШМП в сочетании со стандартной медикаментозной терапией и программной баллонной дилатацией шейки мочевого пузыря под ТРУЗ-контролем (n=45) эффективность составила 86,7%.
Полученные данные позволяют говорить о высокой эффективности данной методики по сравнению с имеющимися альтернативными методами, однако процент рецидива РДШМП в основной группе остался достаточно высоким – 13,3% пациентов.
Модификация поверхности уретральных катетеров с помощью УЗ-индуцируемого лекарственного покрытия
С целью улучшения результатов лечения РДШМП был предложен уретральный катетер с биополимерным покрытием, способный депонировать лекарственный препарат и высвобождать его под воздействием диагностического ультразвука. Указанное покрытие представляет собой тонкую биополимерную пленку (от 1 до нескольких микрон) из полимолочной кислоты (Polylactic Acid – PLA) с множеством упорядоченных, герметично закрытых микроконтейнеров, содержащих лекарственное вещество [18] (рис. 1).

На моделях in vitro и in vivo было доказано, что такой способ инкапсуляции позволяет сохранять биологически активные свойства лекарственного препарата, а также высвобождать его под воздействием ультразвука [19–24]. Так, по данным одного из экспериментальных исследований, при имплантации под кожу бедра лабораторного животного биополимерной пленки с инкапсулированным гидрохлоридом адреналина дистанционное воздействие низкоинтенсивного терапевтического ультразвука на область проекции имплантата приводило к высвобождению препарата из микроконтейнеров, что подтверждалось выраженной вазоконстрикцией, регистрируемой на стороне имплантации [25].
В качестве депонируемого вещества для покрытия уретральных катетеров был применен метилпреднизолон в форме лиофилизата, являющийся хорошо растворимым в воде низкомолекулярным препаратом с высокой биодоступностью, а также выраженным антипролиферативным и противовоспалительным действием.
Безопасность применения предложенного уретрального катетера с покрытием из биополимерной пленки с УЗ-индуцированным высвобождением метилпреднизолона для выполнения баллонной дилатации шейки мочевого пузыря была экспериментально оценена in vivo на кроликах [18]. Для данного опыта 12 здоровых взрослых здоровых самцов-кроликов были разбиты на две группы: экспериментальную и контрольную – по 6 особей в каждой. Испытуемым животным под общим наркозом производилась установка уретральных катетеров Фолея 6 Ch. С раздуванием их в шейке мочевого пузыря, в экспериментальной группе применялись уретральные катетеры с покрытием, в контрольной группе – без покрытия, длительность экспозиции в обеих группах составила 10 мин, при этом в экспериментальной группе в течение всего времени экспозиции на баллон уретрального катетера производилось локальное воздействие ультразвуком (рис. 2).
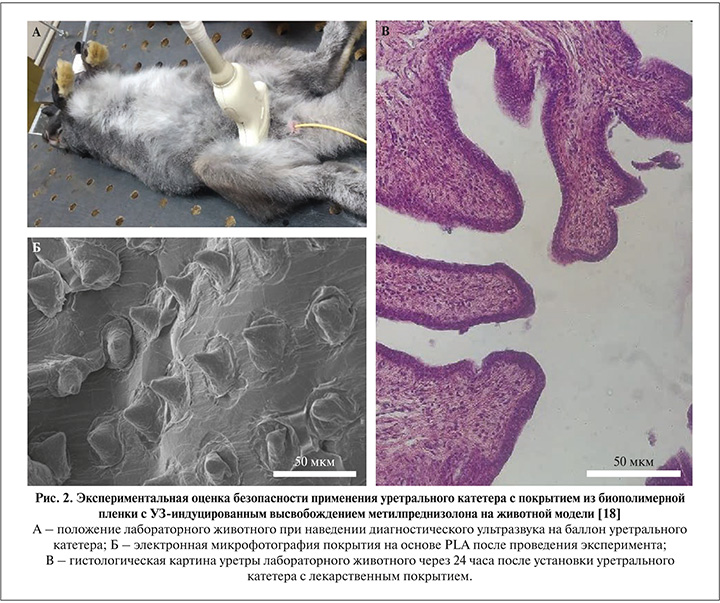
Гистологическое исследование уретры и шейки мочевого пузыря лабораторных животных через 24 ч после установки уретральных катетеров не показало значимых различий между наблюдаемыми группами и продемонстрировало отсутствие негативных последствий использования применения уретрального катетера с покрытием из биополимерной пленки с УЗ-индуцированным высвобождением метилпреднизолона по сравнению с катетером без покрытия.
Внедрение в клиническую практику
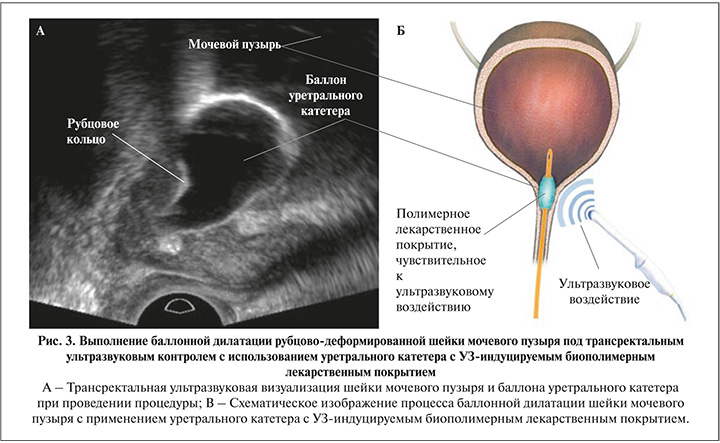
Техника выполнения предложенной методики по сравнению со стандартной баллонной дилатацией шейки мочевого пузыря под трансректальным УЗ-контролем отличается только последовательностью производимых раздуваний баллона катетера, так как при использовании катетера с лекарственным покрытием для создания высокой концентрации препарата непосредственно в зоне рубцевания наиболее целесообразным является производить первое раздутие баллона непосредственно в области ложа удаленной гиперплазии простаты. Далее баллон сдувается и перемещается в область рубцового кольца, после чего раздувается повторно в наиболее узком месте. Длительность экспозиции в обоих положениях суммарно составляет 10 мин – по 5 мин в каждом. Улучшение эффекта по сравнению со стандартной баллонной дилатацией шейки мочевого пузыря обеспечивается за счет поступления под действием ультразвуковых волн лекарственного препарата в область рубцового кольца и антипролиферативного воздействия на фиброзную ткань (рис. 3).
Предложенная методика получила одобрение локального этического комитета МНОЦ МГУ им. М. В. Ломоносова, в условиях которого в 2021 г. стартовало открытое проспективное одноцентровое исследование. На сегодняшний день в исследование включены 13 пациентов с двумя и более рецидивов рубцовой деформации шейки мочевого пузыря после эндоскопического удаления гиперплазии простаты. Планируемое количество участников исследования – 40 пациентов, в связи с чем набор пациентов продолжается.
Имеющийся опыт применения баллонной дилатации шейки мочевого пузыря с применением стандартного уретрального катетера Фолея продемонстрировал высокий потенциал данной методики. Данные литературы о комбинации эндоскопического лечения с местным и системным применением антипролиферативных агентов, в том числе ГКС, позволяют рассчитывать на улучшение результатов лечения рецидивирующей рубцовой деформации шейки мочевого пузыря при сохранении малой инвазивности и возможности проведения процедуры в амбулаторных условиях.



