Введение. Среди факторов, влияющих на выбор антибактериального препарата, одно из ведущих мест занимает чувствительность к нему возбудителя инфекционного процесса. Это особенно относится к внебольничным инфекциям мочевых путей (ИМП), для которых терапия в большинстве случаев назначается эмпирически. В Российской Федерации, как и во многих странах мира, в последние годы отмечается резкое снижение чувствительности внебольничных уропатогенов [1–5]. Энтеробактерии, прежде всего Escherichia coli, оставаясь основным бактериальным возбудителем ИМП [6, 7], отличаются высокой способностью к формированию вторичной резистентности к антибиотикам различных классов, что в современных условиях требует мониторинга и анализа динамики устойчивости к антимикробным препаратам. Это также чрезвычайно важно в контексте утвержденного плана по реализации Стратегии предупреждения распространения антимикробной резистентности, обновления существующих клинических рекомендаций и повышения эффективности проводимого лечения.
В настоящее время одной из наиболее значимых проблем химиотерапии внебольничных ИМП является глобальный рост продукции бета-лактамаз расширенного спектра (БЛРС) во внебольничной среде [8] и устойчивости к фторхинолонам [9].
Целью данного многоцентрового проспективного эпидемиологического исследования динамики антибиотикорезистентности возбудителей внебольничных ИМП в различных субпопуляциях пациентов («ДАРМИС-2018») стало изучение in vitro активности антимикробных препаратов в отношении клинических изолятов, выделенных от пациентов с внебольничными ИМП в различных регионах России, Беларуси и Казахстана.
МАТЕРИАЛЫ И МЕТОДЫ
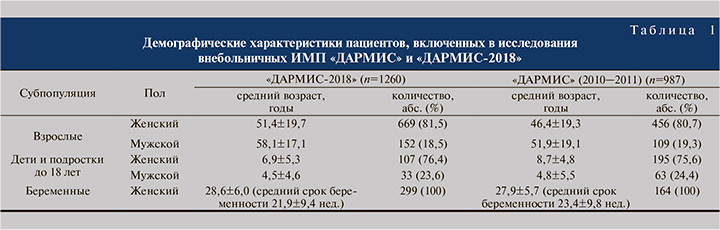
Источники бактериальных изолятов. В исследование «ДАРМИС-2018» было включено 1260 бактериальных изолятов из 34 центров (поликлиник и стационаров) 24 городов России (Братск, Воронеж, Екатеринбург, Иркутск, Йошкар-Ола, Казань, Киров, Краснодар, Нижневартовск, Новокузнецк, Новосибирск, Омск, Ростов-на-Дону, Самара, Санкт-Петербург, Северск, Смоленск, Сургут, Тольятти, Томск, Ульяновск, Челябинск, Якутск, Ярославль), Беларуси (Гомель) и Казахстана (Караганда). Данные изоляты были получены в 2017–2018 гг. от детей и взрослых обоего пола всех возрастных групп с острыми (и обострением хронических) внебольничными ИМП, включая беременных с бессимптомной бактериурией, при выделении возбудителя в диагностически значимом титре из образцов средней порции свободно выпущенной мочи, полученной после туалета половых органов, либо мочи, собранной катетером или с помощью детского мочеприемника.
Все изоляты были распределены по группам в зависимости от субпопуляции пациентов, из образцов мочи которых они были получены. Таким образом, в исследование вошли 821 изолят из субпопуляции взрослых, 299 изолятов из субпопуляции беременных и 140 изолятов из субпопуляции детей и подростков до 18 лет (табл. 1).
Выделение и первичную идентификацию бактериальных изолятов проводили в локальных клинических микробиологических лабораториях центров – участников исследования. Полученные штаммы с заполненными индивидуальными регистрационными картами (ИРК) отправляли на транспортных средах в центральную лабораторию НИИ антимикробной химиотерапии ФГБОУ ВО СГМУ Минздрава России, в которой выполняли окончательную видовую идентификацию всех полученных изолятов и определение их чувствительности к антимикробным препаратам. Контаминированные или нежизнеспособные штаммы из исследования исключали.
Энтеробактерии составили 89,2% от всех выделенных бактериальных возбудителей (88,9% в субпопуляции взрослых; 89,3% в субпопуляции беременных и 91,4% в субпопуляции детей и подростков до 18 лет). Наиболее частыми видами были Escherichia coli (69,4; 73,6 и 77,1% в субпопуляции взрослых, беременных, детей и подростков до 18 лет соответственно) и Klebsiella pneumoniae (11,5; 10,4 и 7,1% соответственно; табл. 2).

Видовая идентификация и хранение изолятов. Все изоляты были идентифицированы до вида методом матрично-ассоциированной лазерной десорбции/ионизации – времяпролетной масс-спектрометрии (MALDI-TOF MS) с использованием системы Microflex LT и программного обеспечения MALDI Biotyper Compass 4.1.80 («Bruker Daltonics», Германия). Рекомендуемые значения Score ≥2,2 были использованы в качестве критерия надежной видовой идентификации. До проведения анализа изоляты хранили в заморозке при температуре -70°С в триптиказо-соевом бульоне с добавлением 30% глицерина.
Определение чувствительности к антибактериальным препаратам. Чувствительность ко всем антибактериальным препаратам определяли методом последовательных разведений в бульоне Мюллера–Хинтон («Oxoid», Великобритания) в соответствии с требованиями Европейского комитета по определению чувствительности к антимикробным препаратам (EUCAST, www.eucast.org) и стандартов ISO 20776-1:2006/ГОСТ Р ИСО 20776-1-2010 [10, 11]. Категории чувствительности изолятов к антимикробным препаратам определяли на основании пограничных значений минимальных подавляющих концентраций (МПК) в соответствии с критериями EUCAST, версия 9.0 [12]. Для контроля качества определения чувствительности использовали штаммы E. coli ATCC®25922, E. coli ATCC®35218, S. aureus ATCC®29213, E. faecalis ATCC®29212 и P. aeruginosa ATCC®27853.
Выявление продукции β-лактамаз расширенного спектра (БЛРС). Наличие БЛРС определяли у всех изолятов энтеробактерий с МПК минимум одного из исследуемых оксиимино-β-лактамов (цефотаксим, цефтазидим, цефепим) >1 мг/л на основании фенотипического метода оценки их синергизма с клавулановой кислотой. Заключение о продукции БЛРС делали в случае снижения МПК оксиимино-β-лактама в присутствии клавулановой кислоты в фиксированной концентрации 4 мг/л в 8 и более раз [13].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
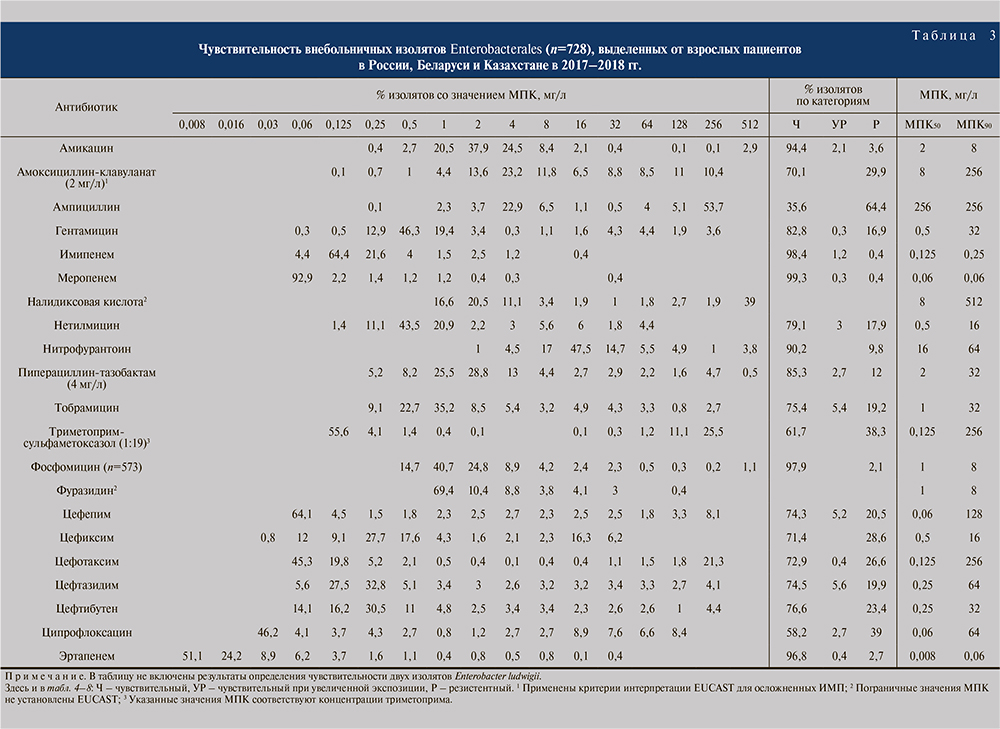
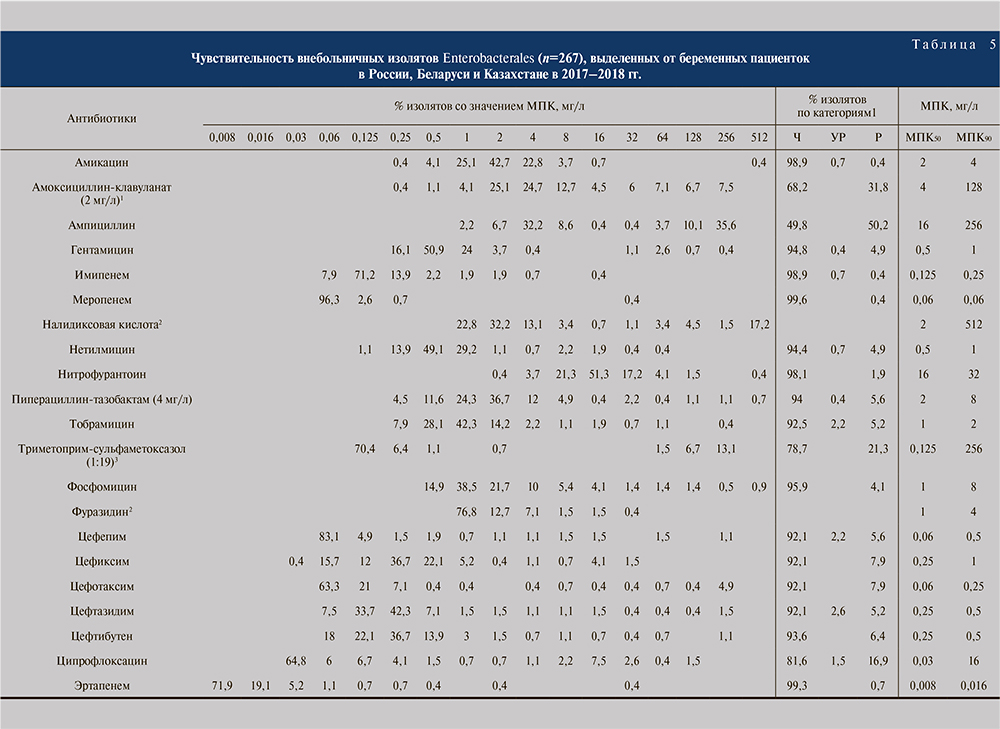
Результаты оценки чувствительности всех изолятов порядка Enterobacterales, а также отдельно E. coli в зависимости от категории пациентов представлены в табл. 3–8.
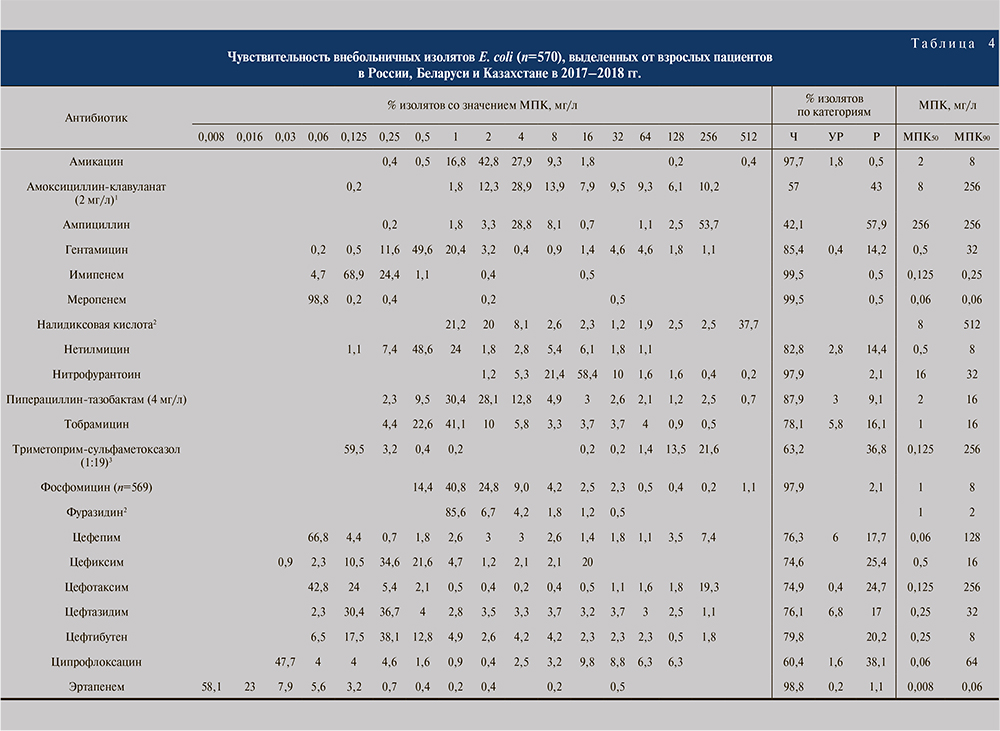


Внебольничные ИМП у взрослых. В отношении основного уропатогена – E. coli – максимальную активность из пероральных препаратов продемонстрировали фосфомицин и нитрофурантоин (по 97,9%; табл. 4). Из парентеральных препаратов наибольшей активностью обладали карбапенемы – имипенем и меропенем (по 99,5%), эртапенем (98,8%), а также амикацин (97,7%) и пиперациллин/тазобактам (87,9%). Высокая частота резистентности штаммов E. coli была зарегистрирована для ампициллина (57,9%), амоксициллина/клавуланата (43,0%) и триметоприма/сульфаметоксазола (36,8%). Отдельно стоит обратить внимание на низкую чувствительность изолятов E. coli к ципрофлоксацину (60,4%), что оказалось существенно ниже результатов, полученных 7 лет назад [3, 4]. По сравнению с предыдущим исследованием «ДАРМИС» также снизилась чувствительность E. coli к цефалоспоринам (цефепим – 76,3%, цефиксим – 74,6%, цефотаксим – 74,9%, цефтазидим –76,1% и цефтибутен – 79,8%).
В отношении суммарно всех энтеробактерий наибольшую активность показали меропенем (99,3%), имипенем (98,4%), эртапенем (96,8%), амикацин (94,4%), фосфомицин (97,9%) и нитрофурантоин (90,2%; табл. 3).
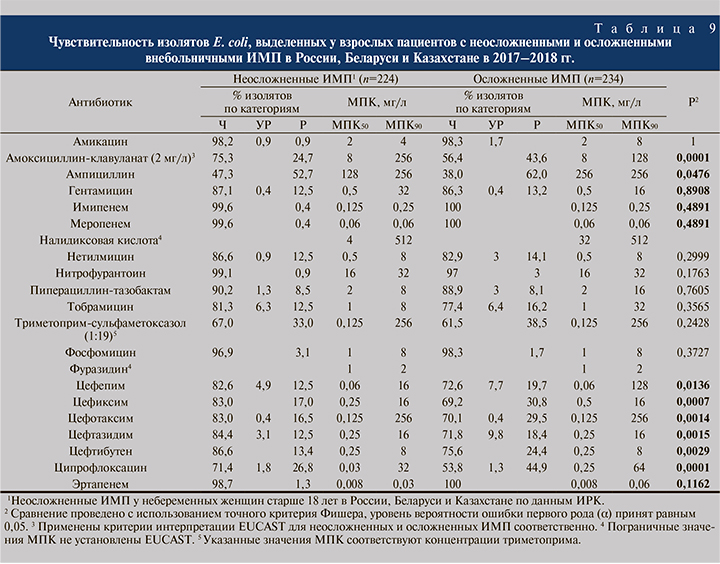
С клинической точки зрения имеет значение разделение внебольничных ИМП у взрослых на неосложненные и осложненные, поэтому данные чувствительности E. coli по ним приведены по отдельности (табл. 9). Для большинства антибактериальных препаратов показатели чувствительности в группе осложненных ИМП оказались ниже, причем эта разница была статистически значимой для ампициллина, амоксициллина/клавуланата, всех протестированных цефалоспоринов и ципрофлоксацина.
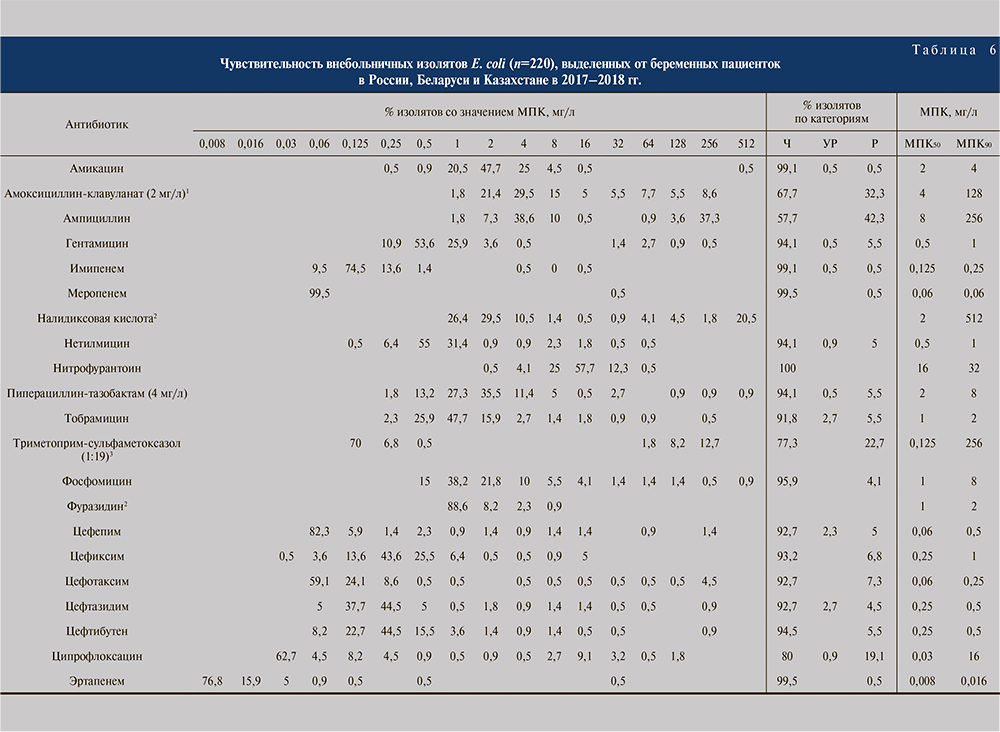
Внебольничные ИМП у беременных. В данной субпопуляции были проанализированы изоляты, полученные от беременных женщин с симптоматическими внебольничными ИМП (39,8%), а также с бессимптомной бактериурией беременных (60,2%), поскольку данная категория требует назначения антибактериальной терапии. Отдельно стоит отметить, что для данной категории пациентов изолятов из Беларуси и Казахстана не было.
В целом показатели резистентности у беременных были ниже, чем в субпопуляции взрослых. В отношении E. coli максимальную активность из пероральных препаратов также продемонстрировали фосфомицин (95,9%) и нитрофурантоин (100%; табл. 6). Из парентеральных препаратов наибольшей активностью обладали карбапенемы – эртапенем и меропенем (по 99,5%), имипенем (99,1%) и амикацин (99,1%). Доля резистентных штаммов E. coli для ампициллина составила 42,3%, амоксициллина/клавуланата – 32,3% и триметоприма/сульфаметоксазола – 22,7%. Чувствительность изолятов E. coli к ципрофлоксацину для данной субпопуляции была равна 80,0%. Чувствительность E. coli к цефалоспоринам превысила 90% и составила для цефепима 92,7%, для цефиксима 93,2%, для цефотаксима 92,7%, для цефтазидима 92,7% и для цефтибутена 94,5%.
В отношении всех Enterobacterales in vitro активность выше 95% продемонстрировали меропенем (99,6%), имипенем (98,9%), эртапенем (99,3%), амикацин (98,9%), фосфомицин (95,9%) инитрофурантоин (98,1%), а ниже 90% только ципрофлоксацин (81,6%), триметоприм/сульфаметоксазол (78,7%), амоксициллин/клавуланат (68,2%) и ампициллин (49,8%; табл. 5).
Внебольничные ИМП у детей и подростков до 18 лет. Наивысшие показатели чувствительности E. coli в этой субпопуляции пациентов тоже были отмечены для фосфомицина (99,1%) и нитрофурантоина (96,3%; табл. 8). Из парентеральных препаратов ни одного резистентного изолята E. coli к протестированным карбапенемам (имипенему, меропенему, эртапенему) выделено не было. Чувствительность к амикацину и пиперациллину/тазобактаму составила 97,2 и 89,8% соответственно. Большая доля штаммов E. coli была резистентна к ампициллину (52,8%), амоксициллину/клавуланату (48,1%) и триметоприму/сульфаметоксазолу (32,4%). Чувствительными к ципрофлоксацину оказались 80,6% изолятов E. coli. Чувствительность E. coli к цефалоспоринам составляла около 80%: к цефепиму – 80,6%, цефиксиму – 79,6%, цефотаксиму – 80,6%, цефтазидиму – 81,5% и цефтибутену – 80,6%.
В отношении всех энтеробактерий наибольшую активность в субпопуляции детей показали меропенем (100%), эртапенем (100%), имипенем (98,4%), амикацин (97,7%), фосфомицин (99,1%) и нитрофурантоин (93,8%; табл. 7). Наименьшие значения чувствительности изолятов порядка Enterobacterales в данной категории пациентов были зарегистрированы для ампициллина (41,4%), амоксициллина/клавуланата (52,3%) и триметоприма/сульфаметоксазола (68,8%).
Поскольку исследование «ДАРМИС-2018» в точности соответствует дизайну и методологии исследования «ДАРМИС», проведенного в 2010–2011 гг., особого внимания заслуживает оценка динамики частоты продукции БЛРС среди внебольничных изолятов E. coli. По результатам фенотипических тестов она увеличилась более чем в 2 раза, составив 21,9% во всех трех субпопуляциях пациентов в странах – участницах исследования против 9,6% в 2010–2011 гг. [4]. При этом в России для некоторых категорий пациентов этот показатель был еще выше [14]. Частота продукции БЛРС в Казахстане и Беларуси по итогам исследования «ДАРМИС-2018» составила 31,3 и 21,6% соответственно, но из-за относительно небольшого количества протестированных изолятов из этих стран полученные данные имеют существенные ограничения.
Заключение. Результаты настоящего исследования свидетельствуют о росте резистентности к большинству антибактериальных препаратов среди внебольничных штаммов Enterobacterales, в частности E. coli. Особую тревогу с практической точки зрения вызывают высокая резистентность к фторхинолонам и резкий рост продукции БЛРС у энтеробактерий. Поскольку в большинстве случаев терапия внебольничных ИМП проводится эмпирически, в рекомендуемых схемах терапии следует учитывать вышеописанные данные, а также результаты локального мониторинга чувствительности уропатогенов и достоверной микробиологической диагностики.



