Введение. Оперативные вмешательства на органах малого таза нередко сопровождаются функциональными нарушениями со стороны нижних мочевыводящих путей (НМП). Известно, что нарушение трофики и иннервации детрузора может быть следствием его травмы при реконструкции тазовых отделов мочеточников [1]. Однако многие вопросы диагностики и лечения изменений накопительной и эвакуаторной способности мочевого пузыря после оперативных вмешательств остаются открытыми. До 1980-х гг. можно было лишь клинически, частично – рентгенологически оценивать состояние НМП, в то время как изучение эвакуаторной и накопительной способности мочевого пузыря было недоступно. Лишь с появлением комплексного уродинамического исследования стало возможным объективизировать клинические данные, которые дополнялись измерениями физических характеристик, оценивающих функцию мочевого пузыря и его замыкательного аппарата [2].
Представление об особенностях иннервации тазовых участков мочеточников и мочевого пузыря помогает установить причину уродинамических нарушений, которые могут быть следствием оперативных вмешательств на их дистальных отделах. Особый интерес представляют результаты анатомических исследований, в ходе которых выявлено существование тесной связи между мочеточниково-пузырным соустьем и иннервацией мочевого пузыря, установлено, что последний иннервируется строго унилатерально [3, 4]. Интерес вызывают не только изначальные нарушения функционирования НМП, но и влияние на их функцию разных реконструктивно-пластических операций. В первую очередь речь идет о пластиках тазовых отделов мочеточников, что связано с анатомо-топографической близостью их к мочевому пузырю. Из-за его травмы, особенно при использовании обширных лоскутов из стенки детрузора для замещения протяженных дефектов мочеточников, изменяются функциональные характеристики НМП [5, 6]. Одни авторы считают, что таким лоскутом можно заместить дефект длиной до 12 см. Другие утверждают, что подобные вмешательства довольно травматичны, и сообщают о прямой зависимости между длиной лоскута и степенью нарушения уродинамики в НМП в послеоперационном периоде [7]. Однако данная проблема остается практически не освещенной в современной литературе. Имеются лишь единичные публикации иностранных авторов, касающиеся влияния вмешательств в зоне уретеровезикального сегмента на функцию мочевого пузыря.
Цель исследования: представить результаты сравнительного исследования функционального состояния мочевого пузыря (МП) после замещения тазового отдела мочеточника собственными тканями, участками тонкой кишки или червеобразным отростком.
Материалы и методы. Нами был выполнен ретроспективный анализ реконструктивных операций при протяженных дефектах дистальных отделов мочеточников, выполненных 273 больным. Протяженные стриктуры мочеточников чаще всего развивались после лучевой терапии (29,1%) вследствие ятрогенных повреждений при оперативных вмешательствах на органах малого таза (25,5%) и являлись осложнением операций на верхних мочевыводящих путях (19,2%).
Сравнение проводили в группах в зависимости от вида пластики. Непрямой уретероцистанастомоз (УЦА) в разных модификациях (Боари, Демеля, сочетание Демеля с псоас-хитч) осуществлен 142 (52%) пациентам; уретероаппендикоцистанастомоз – 23 (8,4%), тонкокишечная пластика с замещением тазовых отделов мочеточников – 105 (38,5%), в том числе односторонний изоперистальтический уретероилеоцистанастомоз с замещением 1/2–1/3 дистальных отделов в мочеточниках 79, антиперистальтический 6, а двусторонняя U-образная илеоуретеропластика 20 больным. Мужчин было 118 (43,2%). Возраст больных варьировался от 18 до 70 лет, составив в среднем 45,3±8,7 года. Рассматриваемые группы по полу и возрасту статистически значимо не различались (p>0,05).
Всем пациентам, как до, так и после операции, проводили уродинамическое исследование, в которое входили урофлоуметрия, цистометрия наполнения и исследование давление–поток. Контрольные обследования выполняли через 10–14 дней, 3, 6 и 12 мес. после операции. При обследовании, проведенном по истечении 12 мес. после реконструктивно-пластических операций, оценивали отдаленные результаты. Уродинамические характеристики сравнивали с нормальными показателями здоровых людей согласно рекомендациям, принятым международным обществом по удержанию мочи [8].
Статистический анализ был выполнен с использованием программного средства пакета «STATISTICA». Различия считались статистически значимыми при значении p<0,05.
Результаты. Трое из 273 оперированных нами пациентов были исключены из сравнительного исследования по причине умеренно выраженных, но рефрактерных к терапии функциональных нарушений МП на этапе, предшествовавшем операции. У 238 (88,1%) из 270 пациентов нарушений уродинамики НМП перед реконструктивными вмешательствами не было. У 32 (11,9%) человек выявлена дисфункция НМП. В том числе у 25 (9,3%) пациентов диагностирована гиперактивность, у 7 (2,6%) – гипо- и атония мочевого пузыря.
Как видно из табл. 1, уродинамические показатели в группах были практически идентичными (p>0,05). В одном случае у пациента перед планируемой илеоуретеропластикой отмечена гиперактивность детрузора. Однако признаков снижения внутриуретрального давления и явлений инконтиненции не наблюдали. В ряде случаев выявлено умеренное снижение максимального внутриуретрального давления, но в целом уродинамические характеристики оказались в пределах референтных значений. Всем 32 пациентам с дисфункцией детрузора проводили консервативное лечение (диета, поведенческая терапия, медикаментозное лечение) в течение 3 мес. Всем больным удалось достигнуть стойкой клинической ремиссии. В результате проведенного на дооперационном этапе обследования все 270 пациентов были включены в исследование.

Выкраивание лоскута из стенки мочевого пузыря при проведении подобных операций сопровождается деваскуляризацией и денервацией органа. Последний в дальнейшем рубцуется, что с еще большей вероятностью способно утяжелить уже развившиеся уродинамические нарушения. После операции по методу Боари больные нередко жаловались на ургентные позывы к мочеиспусканию, дизурию. Более тяжелые нарушения функции мочевого пузыря наблюдались у двух пациентов. В первом случае усугубляющим фактором оказалась нейромышечная дисплазия мочеточника, во втором – выкраивание лоскута большой площади для замещения стриктуры мочеточника длиной 11 см.
Семьдесят пять (53%) из 142 пациентов с выполненной непрямой УЦА имели разной степени нарушения уродинамики МП. Наиболее выраженный характер они носили в течение 12 мес. после операции. Отмечалось статистически значимое уменьшение максимального объема мочевого пузыря, увеличение максимального давления детрузора в фазе наполнения и снижение объема первого позыва (p<0,05).
По нашему мнению, говорить о стойком нарушении функции мочевого пузыря после оперативного вмешательства можно не ранее чем через полгода после вмешательства. Только у 5 (6,7%) из 75 больных с подобными изменениями признаки гипотонии мочевого пузыря существенно уменьшились по прошествии 6 мес. после операции. Тем не менее снижение максимальной объемной скорости потока и замедление опорожнения сохранялись еще длительное время.
Показатели уродинамики МП после изоперистальтической кишечной пластики мочеточников практически соответствовали нормальным. Лишь у 2 (2,5%) из 79 пациентов имела место детрузорная гиперактивность. Группу заместительной пластики тазового отдела мочеточника аппендиксом составили 23 пациента. Посколько при аппендикоуретеропластике травма МП минимальна, а червеобразный отросток располагается изоперистальтически, результаты операции сравнили с данными, полученными после односторонней изоперистальтической кишечной пластики мочеточников (табл. 2).
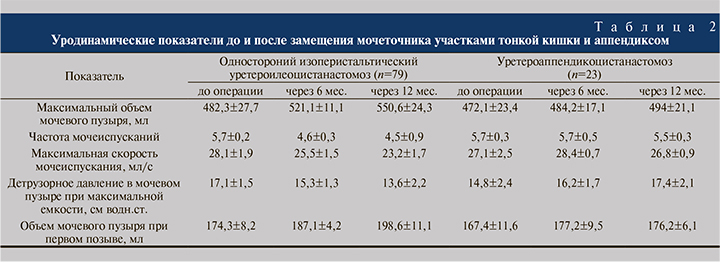
Установлено, что уродинамические показатели после изоперистальтического кишечного замещения мочеточников (n=79) и аппендикоуретеропластики (n=23) оставались такими же, какими были до хирургических вмешательств и в разные сроки после операций. Учитывая это, пациентов после этих двух видов вмешательств объединили в одну группу и сравнили их с больными, перенесшими непрямой УЦА (табл. 3).
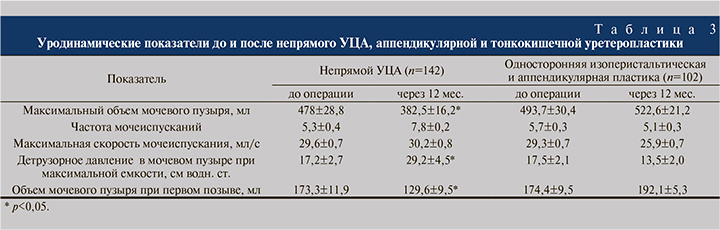
Как видно из табл. 3, уродинамические характеристики после пластики тазового отдела мочеточников сегментом кишки или червеобразным отростком существенно не изменялись. В группе пациентов, перенесших непрямой УЦА, особенно при двусторонних поражениях или протяженных стриктурах тазового отдела мочеточника, через 12 мес. после операции наблюдалось достоверное уменьшение максимального объема МП и объема появления первого позыва к мочеиспусканию. Отмечено повышение максимального детрузорного давления в МП с 17,2±2,7 до 29,2±4,5 см водн.ст., увеличение частоты мочеиспусканий с 5,3±0,4 до 7,8±0,2 (p<0,05).
Выраженность уродинамических нарушений оценивали в разные сроки после вмешательств. Дисфункции после аппендикулярной и изоперистальтических кишечных пластик наблюдались преимущественно на протяжении первых трех месяцев, а затем постепенно уменьшались и через 1 год прослеживались лишь у 2% пациентов. Среди больных с непрямым УЦА функциональные нарушения детрузора были более выражены и нарастали на протяжении 12 мес. Через год после операции они сохранились у 41,5% обследованных. В последующем отрицательной динамики не установлено, что, вероятно, обусловлено окончанием морфоструктурных изменений в МП.
В отличие от больных после односторонней изоперистальтической уретероилеопластики, у 13 (50%) из 26 пациентов, которым выполнена односторонняя антиперистальтическая или двусторонняя U-образная пластика, которая также подразумевает наличие с одной стороны антиперистальтической петли, наоборот, отмечали функциональные нарушения МП (табл. 4).

Как видно из табл. 4, у пациентов после антиперистальтических вариантов илеоуретеропластик достоверно уменьшались такие показатели, как максимальный объем МП и объем мочевого пузыря при первом позыве к мочеиспусканию, а также увеличилась частота мочеиспусканий (p<0,05). Аналогичные изменения наблюдали у всех пациентов, которым была проведена односторонняя антиперистальтическая пластика мочеточников (n=6). Однако в данной группе помимо нарушения уродинамики МП при комплексном обследовании отмечали также умеренно выраженные ретенционные изменения верхних мочевыводящих путей, что, вероятнее всего, связано с гипотонией мочеточника и лоханки, явлениями умеренной пиелоэктазии. Это обусловлено включением в мочевой тракт кишечного сегмента, препятствующего физиологичной уродинамике и, соответственно, нарушающего синхронную работу верхних и нижних отделов мочевого тракта.
Таким образом, среди 270 пациентов после восстановительных хирургических вмешательств на тазовых отделах мочеточников уродинамические нарушения функции НМП наблюдались достаточно часто – в 93 (34,4%) наблюдениях. Расстройства мочеиспускания при этом определялись особенностями проведенного вмешательства и объемом нанесенной мочевому пузырю травмы. Детрузорная гиперактивность была установлена 78 (28,9%) больным, явления гипо- и атонии детрузора –15 (5,6%) из них.
 Частота нарушений уродинамики в группе больных, перенесших непрямой УЦА, составила 53%, а среди пациентов, которым произведены изоперистальтические кишечные реконструкции, оказалась гораздо ниже (p<0,05), не превысив 2,5%. После аппендикулярных пластик изменения функции МП не наблюдали.
Частота нарушений уродинамики в группе больных, перенесших непрямой УЦА, составила 53%, а среди пациентов, которым произведены изоперистальтические кишечные реконструкции, оказалась гораздо ниже (p<0,05), не превысив 2,5%. После аппендикулярных пластик изменения функции МП не наблюдали.
Обсуждение. Непрямой УЦА и различные варианты данной операции – одни из наиболее часто выполняемых оперативных вмешательств при дефектах в тазовых отделах мочеточников [9, 10]. К ним можно отнести операции по методам Боари, Демеля и Psoas-Hitch. Лоскутные вмешательства довольно травматичны и способны вызывать деформацию мочевого пузыря, негативно отражаться на его функциональных характеристиках в результате нарушения его трофики и иннервации [11, 12]. Рассмотренные изменения уродинамики обусловлены, по нашему мнению, выкраиванием более длинного и широкого лоскута из мочевого пузыря, что приводит к ухудшению его функциональных показателей. У 2 больных с мегауретером (первый после вмешательства Демеля в сочетании с псоас-хитч, второй – после илеоуретеропластики) выявлены выраженные нарушения показателей уродинамики МП по типу атонии детрузора (см. рисунок).
При выполнении изоперистальтической кишечной и аппендикулярной пластик мочеточника после того, как измененная его часть была удалена, на ПВХ-трубке формировали анастомозы трансплантата с мочеточником и с мочевым пузырем. При этом основные этапы операции проводили трансперитонеально, а травма, наносимая мочевому пузырю, была незначительной. Это объясняет тот факт, что в группе больных, у которых формировали односторонний изоперистальтический уретероилеоцистанастомоз (n=79), достоверных различий уродинамических показателей МП до и после вмешательства выявлено не было (p>0,05). Считаем такое расположение кишечной петли идеальным, оно обеспечивает физиологичный пассаж мочи от почки к МП, что также обусловливает хорошую функцию МП.
Считаем возможным выполнять антиперистальтическую пластику в редких случаях, при относительно коротких, не более 12 см, стриктурах тазового отдела правого мочеточника и хорошими функциональными резервами МП (отсутствие лучевой терапии и операций на мочевом пузыре, микроцистиса). Наличие антиперистальтически расположенной кишечной петли, являющейся не только частью мочевого пузыря, но и своеобразным буфером для застаивающейся мочи, негативно сказывается на функционировании МП.
Заключение. К основным факторам в патогенезе нарушениям функции мочевого пузыря при выполнении лоскутных пластик относятся деформация, денервация и деваскуляризация детрузора. При одностороннем изоперистальтическом уретероилеоцистанастомозе и уретероаппендикоцистанастомозе расположение кишечной петли по ходу тока мочи обеспечивает ее физиологичный пассаж от почки к мочевому пузырю, что положительно влияет на его функцию. Включение в мочевой тракт антиперистальтически расположенной кишечной петли негативно отражается на функциональном состоянии МП.



