Аденома предстательной железы — одно из наиболее распространенных заболеваний мужчин, является самой частой причиной возникновения проблем с мочеиспусканием в пожилом возрасте, существенно снижая качество жизни [1, 2]. Частота гистологически доказанных случаев заболевания по результатам аутопсий у мужчин в возрасте 31–40 лет составляет 8%, 51–60 лет – около 50%, в возрасте 80 лет – более 80% [3, 4]. Радикальным методом лечения данного заболевания является операция. До недавнего времени основным методом лечения аденомы предстательной железы считалась чреспузырная аденомэктомия (ЧАЭ). С наступлением эры трансуретральной электрорезекции (ТУР) в урологическом обществе меняются взгляды и тенденции развития операций на предстательной железе, а доля открытых операций резко падает; в большинстве развитых стран ТУР заменяет ЧАЭ [5, 6]. ЧАЭ признается не как основной, а как альтернативный метод оперативного лечения, когда выполнение ТУР невозможно по техническим или анатомическим причинам. Ежегодно появляются публикации, где проводится сравнение ТУР аденомы предстательной железы с той или иной техникой открытой аденомэктомии. В этих исследованиях зачастую используются данные 20–25-летней давности, а в качестве операции сравнения выступает вмешательство, сопровождаемое обильным кровотечением, тяжелым послеоперационным периодом, высокой частотой осложнений и высокой летальностью, которое в отечественной и зарубежной литературе именуется операцией Федорова–Фрейера [7]. В 1977 г. на базе ГВКГ им. Н. Н. Бурденко был отработан метод экстрауретральной чреспузырной аденомэктомии (ЭУЧА) [8]. Данная операция выполняется при всех формах роста и разном объеме аденоматозных тканей. Минимальная кровопотеря позволяет выполнять радикальную аденомэктомию больным с сердечно-легочной недостаточностью и другими сопутствующими заболеваниями. В данной статье мы поделились с читателем опытом, накопленным за годы выполнения подобных операций в нашей клинике.
Материалы и методы. С 1996 по 2010 г. в урологическом отделении 2-го ЦВКГ им. П. В. Мандрыка 308
пациентам выполнена ЭУЧА по методике Н. Ф. Сергиенко. Средний возраст пациентов составил 68±7,6
года. Для предоперационной оценки состояния пациента выполнялись стандартные исследования: рентгенография органов грудной клетки, ультразвуковое исследование (УЗИ) почек, мочевого пузыря
(определение остаточной мочи), трансректальное УЗИ (ТРУЗИ) предстательной железы, экскреторная
урография, ЭКГ, анализ мочи, бактериологический анализ мочи с определением чувствительности выделенной микрофлоры к антибактериальным препаратам, клинический и биохимический анализы крови, анализ крови на простатспецифический антиген (ПСА). Дополнительные исследования (гастроскопия, ЭхоКГ, дуплексное сканирование сосудов нижних конечностей) проведены по показаниям. Кроме того, всем пациентам до операции выполнена урофлоуметрия.
Согласно результатам исследований, объем аденоматозной ткани варьировался от 65 до 380 см3. По
оценке международной системы при заболеваниях предстательной железы (IPSS) средний балл по
шкале составил 23,0±4,3, качество жизни (QоL) – 4,0 балла. Максимальная скорость мочеиспускания (Qmax) в среднем достигала 8 (3–9) мл/с, средний объем остаточной мочи – 90 мл, уровень общего ПСА был равен 3,5±4,2 нг/мл.
При постановке диагноза использована клиническая классификация аденомы предстательной железы Н. Ф. Сергиенко (1976). Вторая стадия заболевания была диагностирована 96 больным, III –178, IV –
34. Одноэтапная операция выполнена 196 пациентам, двухэтапная – 98.
Отдельную группу составили 14 пациентов, повторно оперированных по поводу рецидива аденомы после ранее перенесенных оперативных вмешательств на предстательной железе (10 пациентам выполнена ТУР предстательной железы, 4 – чреспузырная аденомэктомия).
Все пациенты имели сопутствующие урологические заболевания. 246 больным диагностирован хронический простатит, 102 – хронический пиелонефрит, 37 – конкременты мочевого пузыря, 27 – дивертикулы мочевого пузыря, у 10 пациентов при УЗИ были обнаружены папиллярные образования мочевого пузыря максимальным размером 2 см в диаметре.
С учетом пожилого возраста больных, наличия разнообразных сопутствующих неурологических заболеваний оценки общесоматического состояния проведены по шкале общего состояния больного (Performance status) – шкале Карновского. Исходно оценка по данной шкале составила в среднем 83,0±4,5 балла. При подозрении на онкологические заболевания предстательной железы по результатам пальцевого ректального исследования, ТРУЗИ и определения уровня ПСА пациентам выполнена трансректальная биопсия предстательной железы.
Функциональные результаты операции оценены посредством урофлоуметрии, измерения объема остаточной мочи и опросников IPSS, QоL.
Результаты. Операция выполнена по методике, описанной в руководстве по ЭУА [10]. Адекватное обезболивание во время операции и в послеоперационном периоде достигалось эпидуральной анестезией. Среднее время операции составило 95±15 мин, средний объем кровопотери — 350 мл (от 250 до 1150 мл). По нашим наблюдениям, объем кровопотери пропорционален объему удаляемых аденоматозных узлов: чем больше был объем аденоматозных узлов, тем больше времени приходилось затрачивать на их выделение и выполнение гемостаза. Во всех наблюдениях операция завершалась
дренированием мочевого пузыря посредством эпицистостомы и уретрального катетера. Через уретральный катетер налаживалась система проточно-промывного дренирования мочевого пузыря физиологическим раствором, в среднем продолжавшегося двое суток. Во время операции у 2 пациентов при ревизии мочевого пузыря были обнаружены новообразования его стенки. Таким образом, общее число пациентов с сочетанием аденомы предстательной железы и опухоли
мочевого пузыря составило 12. Пяти пациентам была выполнена плоскостная резекция мочевого пузыря, 7 – резекция стенки мочевого пузыря с опухолью. При гистологическом исследовании опухолей верифицирован переходно-клеточный рак мочевого пузыря без прорастания в мышечную ткань, степень дифференцировки G1–G2.
Таблица 1. Пери-и послеоперационные результаты ЭУЧА.
Таблица 2. Частота развития ранних и поздних послеоперационных осложнений у больных после ЭУЧА.
В ближайшем послеоперационным периоде у больных, перенесших ЭУЧА, отмечено окрашивание промывной жидкости кровью, интенсивность которой уменьшилась на 3–5-е сутки. При недостаточной анестезии в 1-е сутки после операции больных беспокоили резко болезненные спастические сокращения мочевого пузыря, отмечена макрогематурия, которая контролировалась назначением гемостатических препаратов, трансфузией одногруппной свежезамороженной плазмы, проведением спазмолитической терапии. Уретральный катетер удален на 3– 4-е сутки послеоперационного периода. Больному разрешался активный палатный режим. Заживление операционной раны и полное восстановление акта мочеиспускания наступали на 12–14-е сутки. Выписаны больные на 14–16-е
сутки послеоперационного периода (табл. 1). В течение 30 дней после операции умер один пациент, у которого на 2-е сутки развился обширный трансмуральный инфаркт миокарда. В 1-е сутки после операции у 4 больных развилось внутрипузырное кровотечение с тампонадой мочевого пузыря, что потребовало его ревизии, удаления сгустков и повторного ушивания ложа удаленной аденомы. Двоим пациентам причиной данного осложнения послужила редкая сосудистая аномалия (артериовенозная мальформация); в другом наблюдении кровотечение было связано с большим размером аденомы – 350 см3; у 1 пациента кровотечение развилось на фоне приема антикоагулянтов и неадекватного обезболивания, что привело к частым, болезненным спастическим сокращениям мочевого пузыря
и нарастанию макрогематурии (табл. 2). При выписке больного из стационара отмечено увеличение максимальной скорости мочеиспускания с 8,0 (3–9) до 20,1 (11–33) мл/с (р<0,05), остаточный объем мочи снизился с 90 (55–320) до 47 (0–110) мл (р<0,05). У остальных 81% пациентов отмечено совершенно неосложненное течение послеоперационного периода. Это подтверждается проведенными эндоскопическими и рентгенологическими исследованиями в послеоперационном периоде (рис. 1, 2).
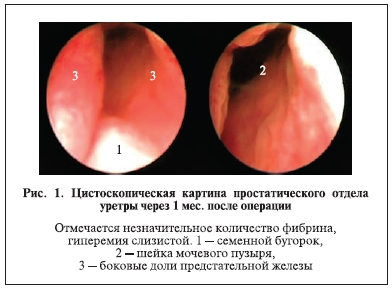
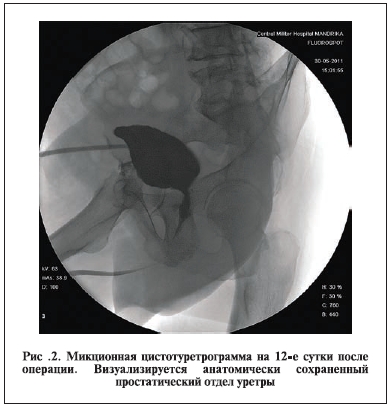
Результаты удовлетворенности лечением представлены в табл. 3.

Частота ранних послеоперационных осложнений составила 19%, при этом на долю ранних осложнений, связанных непосредственно с травмой предстательной железы, пришлось 14,3%, а на долю осложнений, обусловленных воздействием на организм операционной травмы и анестезиологического пособия, — 4,7%. На долю стрессового недержания мочи в структуре ранних
послеоперационных осложнений пришлось до 4,8%. По прошествии нескольких месяцев у 10 из 15 пациентов стрессовое недержание мочи на фоне противовоспалительной терапии прекратилось, у 5 пациентов, несмотря на проведение противовоспалительной терапии, физиотерапевтического воздействия, сохранялось умеренное стрессовое недержание, что заставляло больных использовать от 2 до 3 прокладок в день.
В позднем послеоперационном периоде осложнения составили 4,4%. Основная часть приходилась на стриктуры уретры и недержание мочи, причем 2,7% осложнений в ходе дальнейшего лечения удалось устранить. Хотелось бы также отметить, что в послеоперационном периоде у пациентов довольно рано (в сроки от 1,5 до 2,0 мес.) купировалась дизурия, что свидетельствует о достаточной регенерации тканей и купировании воспаления в зоне операции. При выборочной цистоскопии
у пациентов, перенесших ЭУЧА, через 3 мес. после операции отмечено полное восстановление слизистой без признаков воспаления (рис. 3).
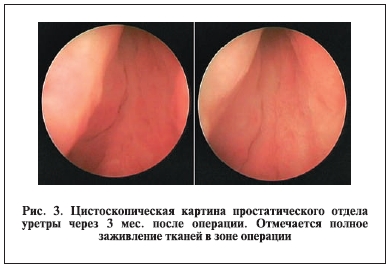
Пяти пациентам в различные сроки, от 3 до 6 мес., был установлен диагноз стриктуры мочеиспускательного канала различной локализации (у 3 –непротяженная стриктура луковичного отдела, у 2 – стриктура мембранозного отдела уретры). Всем им была выполнена внутренняя оптическая уретротомия. Положительный результат был достигнут для троих пациентов, двоим потребовались повторные оперативные вмешательства, одному из них в итоге проведена операция Хольцова.
Обсуждение. В настоящее время стандартом оперативного лечения аденомы предстательной железы считают ТУР, а также новые высокотехнологичные методы трансуретральных операций на предстательной железе, которые могут быть использованы и при больших (>60 см3) объемах аденомы. Однако любое эндохирургическое вмешательство может повлечь за собой возникновение интраоперационных осложнений, требующих перехода на открытую операцию и выполнения
устойчивого гемостаза. Техническая невозможность выполнить трансуретральную операцию также требует выполнения ЧАЭ. Освоение молодыми урологами только эндоскопических вмешательств без отработки навыков открытых операций делает их в экстренных ситуациях отчасти беспомощными, что впоследствии может создать угрозу жизни пациента или привести к развитию функциональных нарушений, обусловленных непрофессиональными действиям молодого специалиста. Выполнение ЧАЭ – сложный вопрос в оперативной урологии и камнем преткновения является “щадящее” для предстательной железы удаление аденоматозных узлов с максимальным сохранением нормальной анатомии простатической части уретры и выполнение гемостаза.
Об этом свидетельствует масса предложенных методик гемостаза, хотя при этом принципы удаления аденоматозных узлов оставались прежними, что влекло за собой частое развитие осложнений в виде склероза шейки мочевого пузыря, стриктуры уретры, недержания мочи. Использование методики ЭУЧА в нашей клинике позволило значительно снизить интраоперационную травму, сохранить целостность передней полуокружности и боковых поверхностей пузырно-уретрального сегмента, что обеспечило раннюю реабилитацию поврежденных тканей и способствовало существенному уменьшению количества ранних и поздних послеоперационных осложнений.
Заключение. Необходимость в открытых операциях по поводу аденомы предстательной железы будет
всегда, пока это заболевание существует, несмотря на достигнутые успехи в оперативном и медикаментозном лечении. Считаем, что оперирующий уролог должен владеть методом исполнения малотравматичной ЧАЭ. Также надеемся, что приведенные нами результаты в дальнейшем помогут коллегам в анализе и оценке эффективности открытых операций по поводу аденомы предстательной железы.



