Трансуретральная резекция (ТУР) предстательной железы с использованием принципов как монополярной, так и биполярной электрохирургии, пришедшая на смену открытой аденомэктомии, является признанным “золотым стандартом” оперативного лечения инфравезикальной обструкции, обусловленной аденомой предстательной железы. Несмотря на высокую эффективность, ТУР простаты может сопровождаться некоторыми осложнениями, в связи с чем не прекращается поиск новых малоинвазивных и высокотехнологичных методов, которые по эффективности не уступали бы ТУР, но позволили бы уменьшить количество осложнений и неудач. Такие методики, как роторезекция и игольчатая аблация, трансуретральная термотерапия, введение этилового спирта или ботокса
в аденому простаты, не нашли широкого применения в силу либо недостаточной эффективности, либо
высокой частоты развития осложнений [1].
Наибольшее развитие и применение в настоящее время нашли трансуретральные оперативные эндоскопические вмешательства с использованием различных типов лазеров – лазерная вапоризация, резекция и энуклеация аденомы простаты, причем методика энуклеации аденомы по своей эффективности и радикальности сопоставима с открытой аденомэктомией при значительно меньшем количестве осложнений [1–3]. Суть методики в эндоскопической энуклеации узлов аденомы с помощью лазерной энергии, смещении узлов в полость мочевого пузыря и их последующей морцелляции тем или иным способом [2]. Среди типичных интраоперационных осложнений трансуретральной лазерной энуклеации аденомы предстательной железы описаны лишь повреждение слизистой мочевого пузыря (1,9–8,3%), перфорация стенки мочевого пузыря (до 0,6%) и, как это ни странно, практически нет указаний на повреждение предстательной железы или шейки мочевого пузыря. Лишь в одной работе мы нашли указание на повреждение капсулы простаты в процессе энуклеации у 7% больных [3]. В послеоперационном периоде могут развиваться такие осложнения,
как кровотечение (2,0–6,5%), инфекционные осложнения (3,8–8%), стриктура уретры (1,7–3,2%), склероз шейки мочевого пузыря (0,6–3,9%) [1–3].
В ГКУБ № 47 Москвы с 2008 по 2011 г. проведено 84 лазерных энуклеаций аденомы простаты с использованием гольмиевого лазера (Ho-YAG) мощностью 50 Вт. На этапе освоения метода мы встретились с осложнением, описания которого не нашли в литературе.
Б о л ь н о й Ш. 74 лет находился на лечении в ГКУБ № 47 Москвы в декабре 2008 г. с диагнозом “аденома простаты”, ИБС, “атеросклеротический кардиосклероз”. Больной предъявлял жалобы на учащенное, затрудненное мочеиспускание вялой струей, чувство неполного опорожнения мочевого пузыря, ноктурию до 4–5 раз на фоне приема α-адреноблокаторов. На предоперационном этапе больному проведено стандартное обследование, включившее опрос и осмотр пациента, анализы крови
и мочи (включая определение уровня простатспецифического антигена – ПСА), обзорную урографию, ультрасонографию и урофлоуметрию (УФМ). Состояние, оцененное по шкале IPSS, соответствовало 25 баллам, качество жизни по шкале QoL оценивалось в 6 баллов. Под данным УЗИ, почки и верхние мочевыводящие пути не изменены; объем простаты – 70 см3, узел аденомы – 50 см3, имеющий смешанную форму роста с наличием выраженной средней доли, объем остаточной мочи – 120
мл. Уровень ПСА – 2,2 нг/мл. По результатам УФМ установлен обструктивный тип мочеиспускания с максимальной скоростью потока мочи 5,2 мл/с. В анализах крови и мочи показатели в пределах нормы, инфекции мочевыводящих путей не выявлено.
В плановом порядке больному выполнена трансуретральная лазерная энуклеация аденомы простаты по методике, принятой в клинике [2]. Были использованы лазерный резектоскоп диаметром 26 Fr, гольмиевый лазер мощностью 50 Вт, лазерное многоразовое волокно переднего прижигания диаметром 600 мкм, эндоскопический морцеллятор. Ирригация осуществлялась физиологическим раствором. В ходе операции выявлено, что среди долей аденомы наиболее выражена средняя, которая
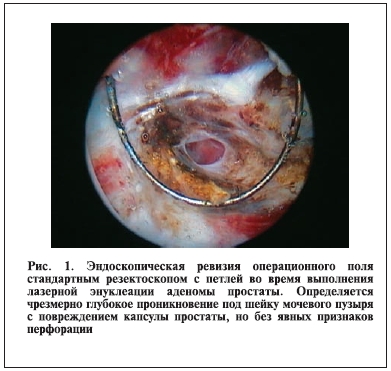
распространялась не только в полость мочевого пузыря, но и глубоко под его шейку (смешанная внутрипузырно-подпузырная форма роста аденомы), в связи с чем энуклеация выполнена с техническими трудностями. В ходе энуклеации средней доли периодически терялся “слой” из-за трудностей правильного расположения и визуализации “режущего” дистального конца лазерного волокна, который все время прикрывался свисающей в операционное поле тканью массивной средней доли. Из-за потери эндоскопической анатомической ориентации рабочий элемент лазерного резектоскопа временно был заменен на более привычный стандартный рабочий элемент с петлей для эндоскопической ревизии операционного поля. Эндоскопическая картина после удаления средней доли была представлена большой “ямой”, расположенной под шейкой мочевого пузыря с наличием тонкой стенки в области дна ложа и признаков повреждения простатической капсулы, но без явных признаков перфорации (рис. 1). Последующая энуклеация боковых долей прошла без особенностей. Ткань аденомы, смещенная в мочевой пузырь, была подвергнута морцелляции. Удалено около 60 г ткани, мочевой пузырь дренирован катетером Фолея № 20 Fr, баллон раздут на 40 мл, натяжения не потребовалось ввиду отсутствия гематурии. Длительность операции составила 75 мин. Больной
переведен в реанимационное отделение в удовлетворительном состоянии, однако по прошествии 30 мин стал предъявлять жалобы на боли в животе, появились перитонеальные симптомы, по данным ультрасонографии выявлена свободная жидкость в брюшной полости. С учетом клинической картины и данных ультразвукового обследования решено было взять больного в экстренном порядке в операционную, где была выполнена ревизия брюшной полости и мочевого пузыря. При ревизии в брюшной полости и паравезикальной клетчатке выявлено около 2 л жидкости, представленной ирригационным раствором с незначительной примесью крови. Повреждений кишечника, брюшины и перфорации мочевого пузыря не выявлено. Операция закончена дренированием брюшной полости и цистостомией. В дальнейшем послеоперационный период протекал гладко, страховые дренажи удалены на 2-е сутки, уретральный катетер – на 3-и после операции, цистостомический дренаж – на 8-е; восстановилось адекватное самостоятельное мочеиспускание.
При контрольном обследовании через 6 мес. индекс по шкале IPSS составил 5, оценка качества жизни по шкале QoL – 2 балла, максимальная скорость мочеиспускания – 22,8 мл/с; остаточной мочи нет.
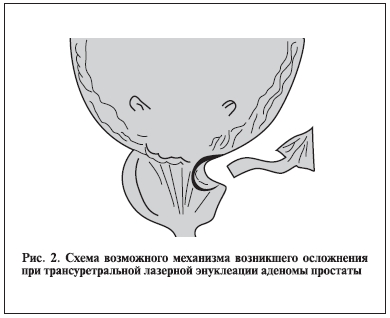
Учитывая отсутствие явных перфораций при ревизии брюшной полости и мочевого пузыря, мы полагаем, что возникшее осложнение могло быть следствием микроперфорации (или прикрытой перфорации) в области ректовезикального пространства, не найденной во время ревизии, что привело к развитию гидроперитонеума (рис. 2). Говоря о лечебной тактике при подобном осложнении, необходимо указать, что помимо ревизии существуют и другие пути решения подобных проблем.
Во-первых, это лечебно-диагностическая лапароскопическая операция и, во-вторых, если на выполненной уретроцистограмме нет явных затеков контрастного вещества за пределы мочевого пузыря, возможно динамическое наблюдение и консервативное лечение, так как жидкость в брюшной полости стерильна.
Таким образом, несмотря на то что трансуретральная лазерная энуклеация является эффективным и малотравматичным методом лечения аденомы простаты, во время операции всегда следует учитывать особенности роста аденоматозных узлов и в случае возникновения трудностей и потенциального риска перфорации необходимо строго и очень аккуратно придерживаться хирургического “слоя” или предпринимать другое оперативное вмешательство с целью предотвращения осложнений (ТУР, аблацию и др.).


