Аденома предстательной железы (АПЖ) – широко распространенное патологическое состояние, возникающее у мужчин преимущественно среднего и пожилого возраста. Данное заболевание
сопровождается обструктивными и ирритативными симптомами, существенно снижающими качество
жизни пациентов. Признаки АПЖ встречаются более чем у 50% пациентов в возрасте 51–60 лет и у 85–90% мужчин старше 80 лет [1, 2]. Несмотря на то что истинная этиология АПЖ до настоящего времениостается неясной, важную роль в развитии данного состояния отводят стромальной и железистой пролиферации клеток в периуретральной зоне предстательной железы [3]. С одной стороны, наблюдаются нарушение оттока мочи за счет увеличения массы предстательной железы и связанная с этим симптоматика заболевания. Увеличение объема ткани предстательной железы в некоторой степени вызывается замедлением апоптоза (программированной клеточной гибели), что приводит к клеточной пролиферации [4]. С другой стороны, симптомы АПЖ связаны с увеличением тонуса гладкомышечных структур за счет стимуляции α-адренорецепторов [5]. В связи с имеющимися данными о патогенезе АПЖ в настоящее время интерес представляют две группы препаратов: α-адреноблокаторы и антиандрогены [6, 7]. Лечение АПЖ при помощи α-адреноблокаторов позволяет снижать выраженность расстройств мочеиспускания, улучшать качество жизни пациента, предотвращать прогрессирование заболевания, его осложнений (в частности, острой задержки мочеиспускания) и необходимости оперативного вмешательства [8]. Альфа-адреноблокаторы снижают васкуляризацию опухоли, а также стимулируют апоптоз в клетках последней [9]. Согласно результатам включенных в обзор контролируемых исследований [10], α-адреноблокаторы позволяют добиваться заметного снижения выраженности расстройств мочеиспускания, существенно улучшают показатели урофлоуметрии по сравнению с плацебо.
Также отмечено снижение абсолютного риска прогрессирования АПЖ в течение 4 лет наблюдения на 6,9% по сравнению с плацебо. Наиболее часто отмечаемые побочные эффекты терапии АПЖ α-адреноблокаторами – головокружение, усталость, головная боль. Эти симптомы одинаково часто встречались в группах пациентов с гипертензией и нормальным артериальным давлением [11]. Появление побочных эффектов, очевидно, не зависит от возраста, пола, времени приема или длительности лечения.
К настоящему времени накоплено довольно много экспериментальных и практических данных, свидетельствующих о том, что индол-3-карбинол (I3C) и эпигаллокатехин-3-галлат (EGCG) являются соединениями, обладающими противоопухолевыми свойствами, которые эффективны в отношении большого числа опухолей эпителиального происхождения [12–16]. Экспериментально и клинически обоснованная уникальность данных соединений обусловлена их способностью осуществлять множественное блокирование молекулярных механизмов, стимулирующих патологическую клеточную пролиферацию и последующий канцерогенез. Комбинированное использование I3C и EGCG эффективно нормализует гормональный баланс, блокирует все основные (в том числе гормоннезависимые) сигнальные пути, приводящие к патологической клеточной пролиферации, устраняет воспалительную реакцию, стимулирует апоптотическую гибель трансформированных клеток, подавляет патологический рост кровеносных сосудов. На сегодняшний день идентифицировано большое число биологически активных молекулярных мишеней, ингибируемых I3C и EGCG и опосредующих неопластические процессы в эпителиальных тканях [17, 18].
На основании представленных выше данных о патогенезе АПЖ перспективным видится комбинированный подход, включающий терапию α-адреноблокаторами. а также I3C и EGCG. Изучению безопасности и эффективности этой комбинации препаратов и посвящено данное клиническое исследование.
Цель исследования – изучить безопасность и эффективность комбинации доксазозина, а также I3C
и EGCG в терапии больных АПЖ I–II стадий.
Материалы и методы. Исследование проводилось в 8 клинических центрах (см. таблиу) с сентября 2009 г. Исследование проводилось с сентября 2009 г. в 8 ведущих клинических центрах Москвы, Санкт-
Петербурга, Екатеринбурга, Нижнего Новгорода, Новосибирска, Саратова и Уфы.
Таблица. Основные клинико-лабораторные показатели у пациентов в различные сроки наблюдения.
В исследование были включены 100 пациентов с АПЖ I–II стадий, в том числе с сопутствующей
простатической интраэпителиальной неоплазией, в возрасте 45–80 лет. Доксазозин назначали в дозе до 8 мг (1–4 таблетки) перед сном перорально, начиная с дозы 2 мг и проводя титрование дозы. Индигал (“МираксБиоФарма”, Москва), содержащий не менее 90 мг I3C и 15 мг EGCG в одной капсуле, назначали по 2 капсулы 2 раза в день.
Критерии включения пациентов в исследование: наличие симптомов АПЖ по шкале IPSS более 10
баллов и длительностью более 3 мес; максимальная скорость мочеиспускания (Qmax)<15 мл/с; объем предстательной железы более 30 см3; объем мочеиспускания (Vcom) от 100 до 350 мл; объем остаточной мочи (Vres) менее 150 мл; уровень простатспецифического антигена (ПСА) в сыворотке крови менее 10 нг/мл.
Критерии исключения: диагностированный рак предстательной железы либо иные злокачественные
новообразования; Qmax<5 мл/с; терапия АПЖ в течение 3 мес, предшествовавших исследованию, или
лечение хронического простатита в течение месяца перед исследованием; острая задержка мочеиспускания; нейрогенные дисфункции и дивертикулы мочевого пузыря; наличие конкрементов в мочевом пузыре; стриктура уретры, склероз шейки мочевого пузыря; наличие в анамнезе оперативных пособий на органах малого таза; инфекции мочеполовой системы в фазе активного воспаления; систематический прием средств, влияющих на функцию мочевого пузыря и мочеотделение; тяжелые сопутствующие заболевания сердечно-сосудистой и нервной систем, психические заболевания, клинически значимая почечная и печеночная недостаточность либо иные тяжелые заболевания.
Основные критерии оценки безопасности: жалобы и данные физикального осмотра; показатели общего
и биохимического анализа крови, общего анализа мочи; жизненно важные показатели (АД, ЧСС, ЧДД);
регистрация нежелательных реакций и случаев приема сопутствующих препаратов на всем протяжении исследования до 360-го дня.
Дополнительные критерии: изменение качества жизни и интенсивности обструктивной, а также
ирритативной симптоматики (по результатам заполнения опросников [IPSS+QoL]; изменения показателей уродинамики (Qmax, средняя скорость потока мочи [Qave], Vcom, Vres); изменение объема предстательной железы по данным ТРУЗИ; изменение уровня ПСА в сыворотке крови.
Длительность терапии и активный период наблюдения составили 6 мес, период отдаленного наблюдения – 6 мес после окончания лечения. Через 6 мес после включения последнего пациента был проведен предварительный анализ полученных данных, через 12 мес – окончательный анализ данных. Полученные данные представлены в виде M±m (средняя арифметическая и стандартное отклонение).
Для оценки статистической значимости отличий данных использовали парный критерий Стьюдента
(при нормальном распределении данных) и критерий Вилкоксона (при распределении, не соответствующем нормальному). С учетом поправки Бонферрони принят уровень значимости отличий 0,025, так как данные сравнивались попарно через 6 и 12 мес наблюдения с данными скрининга.
Результаты и обсуждение. Из отобранных в исследование 100 пациентов в настоящий анализ включены данные 84 пациентов, завершивших курс лечения (6 мес), и 50 пациентов, завершивших исследование (12 мес). Данные скрининга и результаты наблюдений через 6 и 12 мес представлены в таблице.
Влияние комбинации индигала и доксазозина на субъективную динамику симптомов нарушения функции нижних мочевыводящих путей и качество жизни больных представлено на рис. 1.
Рисунок 1. Данные по шкалам IPSS и QoL до лечения, через 3, 6 и 12 мес наблюдения.
Из рис. 1 видно, что отмечается четкая тенденция к снижению баллов по всем вопросам опросников IPSS и QoL в течение всего периода наблюдения.
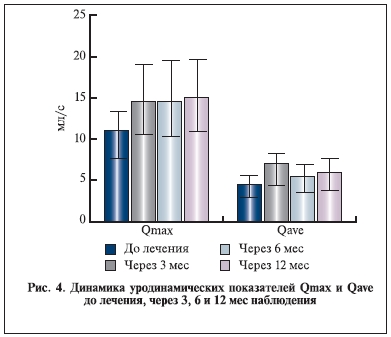
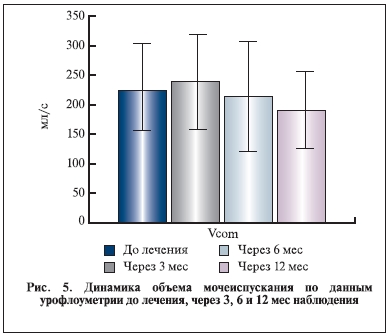
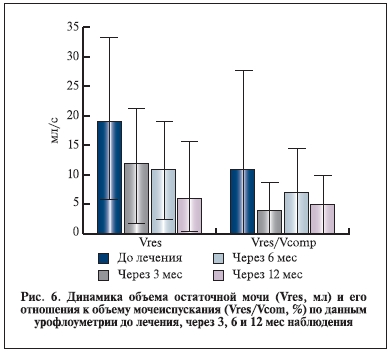
Влияние комбинации индигала и доксазозина на основные уродинамические показатели, динамику
ПСА и объем предстательной железы представлено на рис. 2–6.
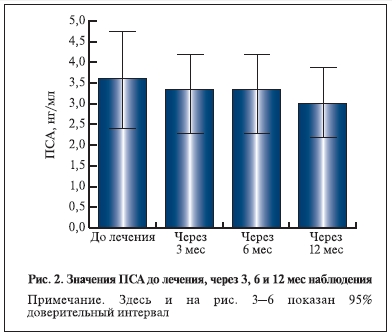
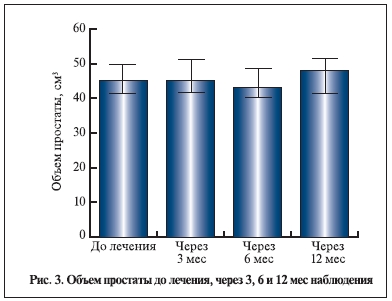
Уровень ПСА и объем предстательной железы к концу наблюдения значимо не изменились. Таким образом, данные настоящего исследования указывают на отсутствие значимого прироста объема простаты и уровня ПСА в сроки до 6–12 мес. Однако основные уродинамические показатели Qmax и Qave к концу наблюдения достоверно увеличились. Важно отметить, что в течение всего исследования, в том числе в период отдаленного наблюдения, пациенты дополнительно не получали никаких препаратов, которые могли бы повлиять на объем простаты, уровень ПСА и уродинамические показатели.
К настоящему времени получены данные нескольких многоцентровых исследований, посвященных
изучению влияния доксазозина на течение АПЖ. В крупнейшее из них исследование MTOPS, проходившее в 1993–2003 гг., были включены 3047 пациентов [19]. Средняя длительность наблюдения составила 4,5 года. Только доксазозин получали 756 человек, средний возраст которых составил 62,7±7,2 года, исходный объем простаты – 36,9±21,6 см3, а уровень ПСА – 2,4±2,1 нг/мл. За период наблюдений (4,5 года) увеличение объема простаты в группах пациентов, получавших доксазозин и плацебо, было одинаковым и составило 18%. Таким образом, был подтвержден вывод об отсутствии влияния доксазозина на объем предстательной железы. Естественное прогрессирование АПЖ, отмеченное в группах, принимавших доксазозин или плацебо, приводило к статистически значимому приросту объема простаты на 29±36% за 4,5 года, т.е. в среднем на 6,4% в год. Уровень ПСА вырос
в среднем на 13% за 4 года, что составляет 3,25% в год.
Исходный объем предстательной железы у пациентов, включенных в настоящее исследование (ИнгУро-157), составил 45,6±13,9 см3, что выше, чем в исследовании MTOPS. Однако, несмотря на это,
статистически значимого прироста объема простаты не наблюдалось: отмечались уменьшение объема
простаты на 4,2±20,5% за полгода и прирост на 2,3±27,5% за 1 год. Уровень ПСА у наших пациентов
до лечения составлял 3,6±4,1 нг/мл, что также заметно выше, чем в исследовании MTOPS. Тем не менее
достоверного увеличения содержания ПСА в данном исследовании у пациентов также не произошло.
В ходе исследования было зафиксировано 2 нежелательные реакции: тошнота и изжога у одного больного и кожная аллергическая реакция (крапивница) у другого. Их связь с приемом препарата мы расценили как “вероятную”.
Выводы
1. Индигал препятствует прогрессированию АПЖ, стабилизируя объем предстательной железы.
2. Индигал не влияет на уровень ПСА у пациентов с АПЖ.
3. Комбинированное применение индигала с доксазозином позволяет стабилизировать состояние на
достигнутом уровне в течение 6 мес после отмены терапии, чего не удается достичь при монотерапии
доксазозином.
4. Индигал является безопасным средством в профилактике и лечении АПЖ.


