Введение. Для большинства пациентов с местнораспространенными первичными или рецидивирующим злокачественными новообразованиями малого таза эвисцерация остается лучшим вариантом лечения. Тотальная эвисцерация органов малого таза (ЭОМТ) – удаление единым блоком всех органов малого таза, включая прямую кишку, мочевой пузырь, а также органов репродуктивной системы, которое заканчивается формированием коло- и уретеростом на передней брюшной стенке (в исключительных случаях ортотопической пластикой мочевого пузыря и низким ректальным анастомозом [1–4]). В 1950 г. Bricker разработал технику уретероилеостомии, которая остается одним из самых часто используемых методов реконструктивной пластики нижних мочевыводящих путей после ЭОМТ [1, 2].
В случаях, когда в опухолевый процесс вовлечены половые органы (у женщин – стенки влагалища и большие половые губы), оперативное лечение приводит к образованию обширных дефектов промежности, закрыть которые только посредством сведения краев раны невозможно. Применение современных методик реконструктивной хирургии при образовании дефектов промежности – необходимая процедура для снижения осложнений, связанных с эвисцерацией органов малого таза [1, 2, 5, 6]. Использование кожно-мышечных лоскутов или пересадка свободного лоскута на микрососудистых анастомозах открывает новые возможности в закрытии практически любого дефекта мягких тканей.
В литературе описано несколько вариантов кожно-мышечного лоскута для замещения дефекта промежности. Хирургические методы восстановления тазового дна у таких пациентов изучены довольно хорошо [4]; в некоторых случаях возможна даже реконструкция влагалища, позволяющая сохранять сексуальную функцию и улучшать качество жизни [5, 8].
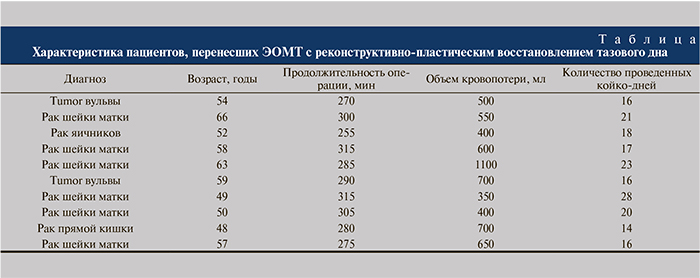
Материалы и методы. С ноября 2013 по декабрь 2014 г. в отделении онкологии клиники БГМУ 10 пациенткам с местнораспространенными опухолями малого таза была выполнена ЭОМТ с реконструктивно-пластическим восстановлением тазового дна с использованием кожно-мышечного лоскута тонкой мышцы бедра. Наиболее частым диагнозом являлся рак шейки матки (см. таблицу). Средний возраст пациенток составил 55 лет, средняя продолжительность операции – 285 мин, объем кровопотери в среднем – 595 мл. Среднее пребывание пациентки в стационаре – 19 дней. Все пациентки были проинформированы о предстоящей операции и получили рекомендации специалиста по вопросу ранних и поздних послеоперационных осложнений. Срок наблюдения за пациентками составил 12 мес после операции. Ранних осложнений, связанных с заживлением кожно-мышечного лоскута, не было отмечено; у одного из пациентов был зафиксирован некроз дистального отдела лоскута. Заживление раневого дефекта у этого пациента произошло вторичным натяжением.
Клинический пример
У одной из пациенток был диагностирован рецидивный рак влагалища с распадом опухоли (см. рисунок, а), вследствие чего возникла необходимость в проведении широкой резекции кожи промежности.
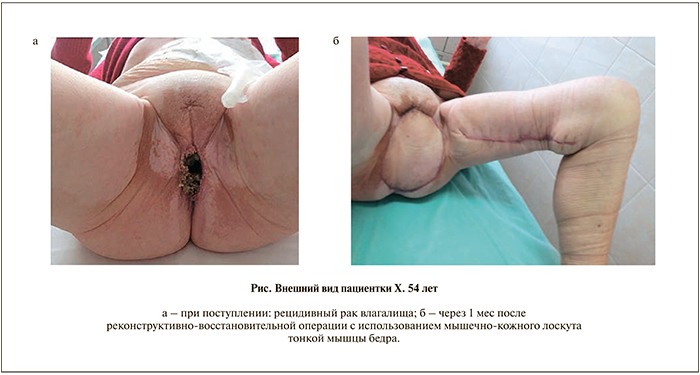
П а ц и е н т к а Х. 54 лет поступила в отделение онкологии Клиники БГМУ с диагнозом: tumor вульвы T3N1M0. Состояние после комбинированной химиолучевой терапии. Прорастание в матку, прямую кишку, мочевой пузырь. В анамнезе в 2008 г. выявлено злокачественное новообразование влагалища, в том же году было выполнено иссечение новообразования с последующей дистанционной лучевой терапией на паховые лимфоузлы СОД 44,5 Гр, ложе опухоли 39 Гр. В 2010, 2011, 2012 г. по поводу рецидива трижды было выполнено иссечение образования, в 2012 г. – с последующей дистанционной лучевой терапией (паховые лимфоузлы СОД 30 Гр, ложе опухоли 33 Гр). В 2013 г. по поводу рецидива опухоли проведена химиолучевая, а также местная химиотерапия с использованием салфеток Колетекс-фтор с 5-фторурацилом 3 мг/см. В сентябре 2014 г. по результатам рентгенкомпьютерной томографии, в ходе которой выявлено прорастание опухоли в матку, прямую кишку и мочевой пузырь, была выполнена эксплоративная лапаротомия, наложена двуствольная сигмостома. После дополнительного обследования в ноябре 2014 г. проведена ЭОМТ с реконструктивно-пластическим восстановлением тазового дна кожно-мышечным лоскутом тонкой мышцы бедра.
Техника операции и результаты. Операция ЭОМТ была выполнена в соответствии с рекомендациями, представленными в современной литературе, и включала удаление дистальных отделов мочевыводящих путей, матки с придатками и прямой кишки [1, 2, 12, 13]. Заключительным этапом резекции стало удаление в составе единого блока больших половых губ, мягких тканей промежности и перианальной области. В результате резекции размер дефекта кожи промежности составил 250х160 мм. Кожно-мышечный лоскут правой тонкой мышцы бедра шириной 110 и длиной 220 мм был сформирован в виде вертикального островка по стандартной методике от дистальной границы к проксимальной. Сосудистая ножка рассечена на составляющие, чтобы увеличить ее длину и предупредить перегиб питающих артерий. В подкожной клетчатке паховой области был сформирован тоннель, по которому кожно-мышечный лоскут проведен к месту дефекта промежности. Затем лоскут был ротирован на 180°, чтобы полностью закрыть данный дефект. Дефект, сформированный в результате забора кожно-мышечного лоскута, был ушит с установлением дренажей. В дополнение к обычным процедурам послеоперационного ухода больная находилась в лежачем положении с отведением левой ноги на 20°.
Состояние кожно-мышечного лоскута оценивали по показателям микроциркуляции: цвету кожи, температуре поверхности; с помощью ультразвукового допплеровского сканирования визуализировали перфорантные артерии в лоскуте. Контроль микроциркуляции осуществлен методом лазерной допплеровской флоуметрии. В послеоперационном периоде проведена профилактическая терапия препаратами простагландина E1 (вазапростан 40 мкг внутривенно 1 раз в сут), низкомолекулярного гепарина (клексан 40 мг подкожно 1 раз в сут). Пациентка активизирована на 5-е сутки после операции. Спустя 20 сут после операции было достигнуто заживление раны, приживление лоскута на месте дефекта промежности и заживление донорского участка левого бедра без видимых осложнений.
В настоящее время пациентка получает лучевую терапию, поэтому оценка онкологических результатов не проводилась (см. рисунок, б).
Обсуждение. Кожно-мышечный лоскут тонкой мышцы бедра был описан Schoeller и соавт. для реконструктивной пластики груди, а также как свободный лоскут для использования в других областях [10, 11]. Кожно-мышечный лоскут тонкой мышцы бедра довольно давно вошел в практику реконструктивно-пластических хирургов и широко используется в настоящее время [3–5, 12]. Тем не менее на сегодняшний день в литературе представлены единичные работы, касающиеся возможностей использования кожно-мышечного лоскута тонкой мышцы для реконструкции больших дефектов аналогичных тем, для замещения которых используется лоскут прямой мышцы живота или широчайшей мышцы спины [11, 12]. Тонкая мышца бедра применяется в реконструктивно-пластической хирургии в виде свободного лоскута, а также в виде перенесенного лоскута на сосудистой ножке. Кожно-мышечный лоскут тонкой мышцы бедра используется при восстановлении тазового дна и реконструкции влагалища после онкологических операций, в лечении рецидивирующих пузырно-влагалищных, ректовагинальных свищей. Вертикальные и поперечные мышечно-кожные лоскуты тонкой мышцы бедра в последние годы стали использовать в виде свободных лоскутов для реконструктивно-пластического восстановления груди с заявленными размерами кожных островков 5–9 см в длину и 10–18 см в ширину [9, 11]. Ввиду близкого расположения донорского участка к малому тазу и половым органам представляется вполне обоснованным замещать дефект промежности кожно-мышечным лоскутом тонкой мышцы бедра после ЭОМТ. В свою очередь забор данного лоскута не создает функциональных проблем для пациентов, не ослабляет переднюю брюшную стенку пациентов и не приводит к проблемам, связанным с выведением стом на переднюю брюшную стенку.
Благополучное закрытие раневого дефекта произошло у всех пациентов в нашей небольшой серии. Однако не стоит забывать об очень высоком риске некроза кожной части лоскута, связанного с нарушением микроциркуляции кожи в сложном лоскуте. По нашему мнению, эти осложнения связаны с предшествующей хирургическому лечению лучевой и химиотерапии.
Заключение. Эвисцерация органов малого таза и ее модификации считаются одним из вариантов лечения пациентов с местнораспространенными опухолями малого таза. Прогресс, достигнутый в улучшении отбора пациентов, хирургической техники и интраоперационной помощи привел к снижению послеоперационных осложнений. Восстановление тазового дна после ЭОМТ продолжает оставаться серьезной проблемой в мировой хирургической практике. Использование кожно-мышечного лоскута тонкой мышцы бедра для реконструктивной пластики является важным дополнением к арсеналу хирурга. Как показал наш опыт, мышечная часть лоскута служит хорошей основой кровоснабжения кожного островка, чем снижает риск нарушения микроциркуляции кожи. Это объясняется тем, что мышца в составе лоскута неизменно остается жизнеспособной, совместно с большей частью подкожно-жировой клетчатки обеспечивая заживление раневого дефекта, что обусловливает наиболее частое использование кожно-мышечных лоскутов в реконструктивно-пластической хирургии.
Считаем, что реконструктивно-пластическое восстановление тазового дна с использованием кожно-мышечного лоскута тонкой мышцы бедра – обоснованна процедура и рекомендуем специалистам использовать эту технику в отношении соответствующих пациентов, подвергающихся ЭОМТ.


