Введение. Рак предстательной железы (РПЖ) среди онкологических заболеваний у мужчин является наиболее распространенным новообразованием и занимает второе место среди причин смерти от рака [1–3]. Доказано, что ранняя первичная диагностика любых типов злокачественных опухолей и точное прогнозирование их развития существенно повышают эффективность лечения. Однако в настоящее время для большинства наиболее распространенных видов опухолей, в том числе для рака предстательной железы, не идентифицированы достаточно информативные диагностические и прогностические маркеры вследствие высокой вариативности механизмов канцерогенеза и трудоемкости методов идентификации опухолевых маркеров. В связи с этим анализ молекулярных механизмов инициации и развития РПЖ как основы для идентификации новых маркеров диагностики и мониторинга лечения данного заболевания, новых метаболических «мишеней» терапии – одно из приоритетных направлений современной урологии и онкологии.
В настоящее время «золотым» стандартом скрининга, ранней диагностики, степени распространенности, мониторинга лечения РПЖ служит определение простатспецифического антигена (ПСА) – представителя мультигенного семейства тканевых калликреинов [4–6]. Однако общепризнанно, что канцерспецифичность ПСА крайне низка и составляет всего 20% [7, 8]. Использование ПСА как инструмента скрининга РПЖ привело к снижению стадийности и степени злокачественности заболевания на момент диагностики, а также к снижению смертности от РПЖ, с одной стороны, и гипердиагностике, с другой. Тот факт, что ПСА синтезируется всеми эпителиальными клетками простаты – нормальными, гиперпластическими либо опухолевыми, снижает его специфичность как биомаркера РПЖ. Поэтому, несмотря на огромное значение в практической урологии, ПСА нельзя признать идеальным маркером для диагностики и мониторинга рака предстательной железы.
Как известно, вазоактивные системы крови – калликреин-кининовая и ренин-ангиотензиновая – играют ведущую роль в реализации молекулярных механизмов гомеостаза при патологических состояниях разного генеза. За последние годы особое внимание исследователей было привлечено к калликреин-кининовой (ККС) и ренин-ангиотензиновой системам (РАС) и их роли в развитии неопластической трансформации [9, 10]. Существенным прорывом в понимании функций вышеобозначенных систем явилось открытие рецепторов к брадикинину и ангиотензину II [9–11].
Целью исследования стали анализ роли калликреин-кининовой и ренин-ангиотензиновой систем организма в молекулярных механизмах инициации РПЖ и идентификация новых маркеров РПЖ.
Материалы и методы. Объектом исследования послужили 36 пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ) и 58 пациентов с локальным и местнораспространенным РПЖ.
Работы с биологическими материалами, полученными от пациентов, проведены в соответствии с Национальным стандартом РФ «Надлежащая клиническая практика» (Good Clinical Practice; GCP) (ГОСТ Р 52379-2005), международным этическим и научным стандартом планирования и проведения исследований с участием человека в качестве субъекта [12].

В секрете предстательной железы определяли следующие показатели: активность калликреина (КФ 3.4.21.8) (К) и содержание прекалликреина (ПК) после отделения от других сериновых протеиназ с помощью ионообменной хроматографии на ДЭАЭ-сефадексе А-50 по скорости гидролиза N-бензоил-1-аргинин этилового эфира (БАЭЭ) [13], ингибиторную активность α1-протеиназного ингибитора (α1-ПИ) и α2-макроглобулина (α2-МГ) унифицированным энзиматическим методом [14], активность ангиотензинпревращающего фермента (АПФ, КФ 3.4.15.1) с использованием в качестве субстрата фурилакрилоилфенилаланил-глицилглицина [15], общую аргининэстеразную активность по отношению к БАЭЭ [16].
Для иммуногистохимического исследования использован материал полифокальных пункционных биопсий 10 больных ДГПЖ и 10 больных РПЖ, а также следующий набор первичных антител: PSA (prostate spec. antigen), clone ER-PR8, mouse, 2:100 («Dako»); Cytokeratin, clone 34BE12, mouse, 2:100 («Dako»); P63, clone 4A4, mouse, 3:100 («Dako»); Androgen Receptor (AR), clone AR441, mouse, 2:100 («Dako»); Angiotensin II Type 2 Receptor (AT2), rabbit polyclonal, 1:100 («Abcam»); adykinin B1 Receptor (BDKRB1), rabbit polyclonal, 1:100 («Abcam»); Bradykinin B2 Receptor (BDKRB2), rabbit polyclonal, 1:1000 («Abcam»). В работе применены системы визуализации, промывочные и демаскировочные растворы производства «Dako» (Дания). Постановка иммуногистохимических реакций, интерпретация полученных результатов осуществлены в соответствии с общепринятыми правилами [17].
Статистический анализ проведен с использованием U-критерия Манна–Уитни, коэффициента корреляции Спирмана, дискриминантного анализа с применением программ STATISTICA («Stat Soft», США) [18]. В качестве порогового уровня статистической значимости принято значение 0,05.
Результаты. Для идентификации маркеров онкогенной трансформации простаты было сформировано две группы больных: группа сравнения, в которую вошли 36 пациентов с ДГПЖ, и клиническая группа, включившая по 29 больных локальным (Т1–Т2) и местнораспространенным (Т3–Т4) РПЖ (табл. 1).
Наиболее полно процессы неопластической трансформации простаты отражаются в изменении протеиназноигибиторного баланса в секрете предстательной железы. Сравнительный анализ особенностей нарушения протеолитических процессов при доброкачественных и злокачественных процессах в простате показал, что при РПЖ в секрете простаты активность калликреина на 116,4% (p<0,001) выше, а активность АПФ на 35% (p<0,001) ниже, чем при ДГПЖ (табл. 2).
При РПЖ содержание прекалликреина и общая аргининэстеразная активность, характеризующая суммарную активность трипсиноподобных протеаз в секрете простаты, не отличаются от таковых при ДГПЖ. Для процессов неопластической трансформации простаты характерно резкое увеличение ингибиторного потенциала секрета простаты. Так, активность α1-ПИ и α2-МГ в секрете простаты соответственно на 62,1% (p<0,001) и 55,6% (p<0,05) выше, чем при ДГПЖ.
Обращает на себя внимание снижение активности АПФ и увеличение активности калликреина в секрете простаты больных аденокарциномой простаты по сравнению с таковой у больных ДГПЖ, что, по-видимому, может значительно увеличить реальную концентрацию брадикинина в секрете предстательной железы и снизить содержание ангиотензина II.
На основе дискриминантного анализа определены наиболее значимые для диагностики РПЖ показатели протеолитических систем в секрете простаты, позволившие выделить группу пациентов с РПЖ и ДГП и на их основе построить «модель», позволяющую предсказывать, к какой группе относится конкретный пациент. К достоверным для дискриминации РПЖ и ДГПЖ диагностическим критериям относятся активность калликреина и АПФ в секрете предстательной железы. Анализ активности калликреина, АПФ в секрете простаты и уровня ПСА в сыворотке крови позволяет дискриминировать пациентов с РПЖ и ДГПЖ с чувствительностью 91,3% (р<0,001), специфичностью 96% (р<0,001) и точностью 93,8% (р<0,001). На основании этого разработан Способ определения показания для биопсии предстательной железы [19].

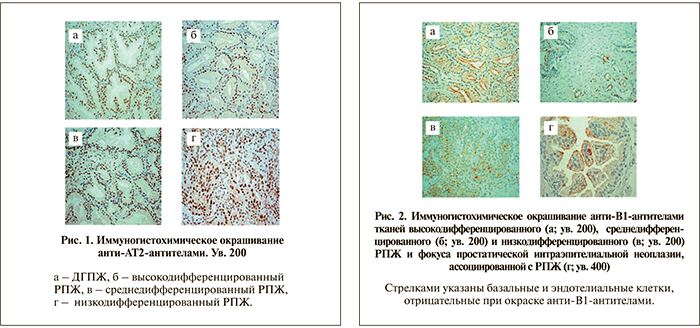
Многочисленные функции пептидных регуляторов канцерогенеза – ангиотензина II и брадикинина – реализуются через два вида рецепторов: брадикининовые и ангиотензиновые. Нами выявлена функциональная связь процессов онкогенной трансформации простаты и ключевых протеолитических систем организма. Так, во всех без исключения образцах при ДГПЖ нами выявлена ядерная экспрессия рецептора ангиотензина II (АТ2) в клетках эпителия предстательной железы (рис. 1а). Иммуноокрашивание с анти-АТ2-антителами присутствует и в ядрах нормальных клеток эпителия предстательной железы, и при неопластических процессах, причем интенсивность окрашивания не изменяется по мере снижения степени дифференцировки опухоли (рис. 1 б, г).
Необходимо отметить, что если локализация специфического окрашивания с анти-АТ2-антителами в клетках железистого эпителия при ДГПЖ и РПЖ была преимущественно ядерной, то экспрессия рецепторов брадикинина В1 и В2 имела совсем иной характер. В группе пациентов с ДГПЖ экспрессия В1-рецепторов практически полностью отсутствовала (рис. 2). Локализация окрашивания – цитоплазматическая, преимущественно в апикальной части клеток, что особенно заметно при большом увеличении (рис. 2 г). Иммуноокрашивание с анти-В2-антителами в группе РПЖ выявило экспрессию их преимущественно в строме ткани ПЖ. При большем увеличении определено полное отсутствие окрашивания в эпителии малигнизированных желез. Нами не обнаружено изменений экспрессии В2-рецепторов в строме низкодифференцированных карцином, в опухолях с наличием сосудистой инвазии. Окрашивание выявлялось во всех без исключения случаях РПЖ, и его интенсивность была примерно одинаковой.
Таким образом, показано, что в ткани предстательной железы эффекторное воздействие ККС и РАС при злокачественной и доброкачественной трансформации простаты реализуется через разные типы рецепторов. Отмечен противоположный характер экспрессии рецепторов В1 и В2 – в малигнизированном или диспластическом эпителии наблюдается экспрессия В1-рецепторов, тогда как В2-рецептор локализован преимущественно в строме и выявляется как при ДГПЖ, так и при РПЖ. АТ2-рецептор также выявлен нами и при ДГПЖ, и при РПЖ, причем локализация его везде была ядерной, что является необычным и неописанным ранее в ткани предстательной железы явлением для рецепторов, ассоциированных с G-белками.
Обсуждение. За последние годы накоплены данные об участии ККС и РАС в канцерогенезе при РПЖ [11, 20, 21]. Кинины выполняют разнообразные функции, в том числе участвуют в процессах клеточной пролиферации, активации лейкоцитов, миграции клеток, активации эндотелиальных клеток и ноцицепции. Особая роль в неоангиогенезе принадлежит кининам, которые как медиаторы воспаления, вызывающие вазодилатацию и увеличение сосудистой проницаемости, вносят вклад в инвазию, метастазирование [9, 22]. Биологическое действие кининов в ткани предстательной железы заключается в стимуляции ангиогенеза путем усиления экспрессии основного фактора роста фибробластов bFGF и сосудистого эндотелиального фактора роста VEGF [25]. Ангиотензин II как биологически активный пептид РАС участвует в контроле артериального давления, ремоделировании тканей и ангиогенезе, а также в сосудистых и воспалительных реакциях. Необходимо отметить, что основные функции ангиотензина II (воспаление, ангиогенез и миграция) также связаны с прогрессированием рака [23, 24]. Ангиотензин II оказывает как прямое митогенное действие на клетки эндотелия, стромы и эпителия предстательной железы, так и опосредованное – путем стимуляции синтеза или потенцирования действия факторов роста и цитокинов, в частности интерлейкина-6 и -8 [26]. Впервые показано, что ангиотензин II оказывает непосредственное воздействие на раковые клетки, способствуя росту опухоли, за счет влияния на адгезию, миграцию и подвижность клеток, ускоряя прогрессирование метастазирования [10].
Анализ ключевых показателей калликреин-кининовой и ренин-ангиотензиновой систем в секрете простаты показал, что при РПЖ отмечается увеличение активности калликреина и снижение активности АПФ на фоне снижения ингибиторного потенциала секрета простаты. Увеличение активности ключевого кининобразующего фермента калликреина и снижение активности АПФ, разрушающего брадикинин, свидетельствуют о накоплении брадикинина [27]. Таким образом, на основе оценки показателей калликреин-кининовой и ренин-ангиотензиновой систем, участвующих в метаболизме пептидных регуляторов канцерогенеза – ангиотензина II и брадикинина в секрете простаты, нами идентифицированы перспективные маркеры онкогенной трансформации предстательной железы.
Плейотропность брадикинина и ангиотензина II определяется передачей сигналов через два типа рецепторов – брадикининовые и ангиотензиновые [11]. Нами показано, что у пациентов с ДГПЖ экспрессия В1-рецепторов полностью отсутствовала. При РПЖ специфическая реакция с анти-В1-антителами в железистом эпителии имела место в малигнизированных ацинусах и фокусах простатической интраэпителиальной неоплазии. Экспрессия В2-рецепторов отмечена в строме как при ДГПЖ, так и при РПЖ независимо от стадии и суммы баллов по шкале Глисона. Обнаруженные нами данные о характере экспрессии В1-рецепторов свидетель-ствуют о потенциальной возможности использовать его как маркер РПЖ. Таким образом, в отличие от физиологически активных В2-рецепторов патологически индуцируемые В1-рецепторы участвуют в процессах онкогенной трансформации простаты [28]. В связи с этим исследование антагонистов В1-рецепторов в качестве целевых кандидатов для разработки альтернативных походов к терапии РПЖ весьма перспективно.
Полученные в результате исследования данные о нарушении метаболизма брадикинина в секрете простаты и высокой экспрессии брадикининовых рецепторов в ткани предстательной железы при РПЖ подтверждают концепцию об участии калликреин-кининовой и ренин-ангиотензиновой систем в онкогенной трансформации клеток простаты. Снижение активности АПФ и как следствие – уменьшение содержания ангиотензина II в секрете простаты при РПЖ, локализация АТ2-рецептора ангиотензина II в ядрах клеток железистого эпителия ткани предстательной железы, вероятно, свидетельствует о переходе на интракринный путь регуляции [29].
Сложность процессов, происходящих при активации РАС и ККС, требует комплексной оценки показателей, отражающих функциональную активность этих систем у больных ДГПЖ и РПЖ. Такой подход позволит выявить возможную зависимость экспрессии отдельных компонентов этих систем от характера процесса (доброкачественный или злокачественный), а также уровня дифференцировки опухоли. Это может служить основой для разработки методов адекватной и точной диагностики неопластических процессов, а также терапевтических подходов к коррекции активности РАС и ККС при ДГПЖ и РПЖ.
Заключение. Для оптимизации ранней диагностики РПЖ необходимо рассматривать не один маркер, а «портрет» опухоли в целом. Решение этой задачи возможно только на основе комплексного исследования количественного и качественного изменения целого спектра различных соединений, что позволит судить об инициации и прогрессировании РПЖ. Решение проблемы ранней диагностики РПЖ и мониторинга эффективности терапии связано, по нашему мнению, с изучением протеолиза как особой формы биологического контроля при развитии РПЖ. Таким образом, определение активности ферментов ККС и РАС в секрете и брадикининовых рецепторов в ткани простаты обладает значительным диагностическим потенциалом и представляется многообещающим.
В статье представлены результаты работ, выполненных при финансовой поддержке Министерства образования и науки Российской Федерации в рамках Соглашения о предоставлении субсидии № 14.607.21.0099, уникальный идентификатор прикладных научных исследований и экспериментальных разработок (проекта) RFMEFI60714X0099, ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы».



