Введение. Хронический простатит (ХП) – распространенное, но при этом недостаточно изученное, плохо поддающееся лечению социально значимое заболевание у мужчин репродуктивного и трудоспособного возраста 25–50 лет, доля которого среди всех урологических болезней составляет 9–11%. Частота хронического бактериального простатита доходит до 10%, абактериального – 90% [1–3].
В настоящее время общепризнанна классификация простатита, предложенная в 1995 г. Национальным институтом здоровья США (NIH), согласно которой хронический абактериальный простатит, или синдром хронической тазовой (СХТБ), относят к категории III, ведущим клиническим симптомом которого является болевой синдром на протяжении более 3 мес в отсутствие патогенных микроорганизмов в секрете простаты, эякуляте и моче, полученный после массажа простаты. Критерием разделения на IIIA (воспалительная форма) и IIIB (невоспалительная) служит наличие повышенного количества лейкоцитов. При категория IIIA отмечают повышенное содержание лейкоцитов (>+10–15 в поле зрения) в секрете предстательной железы (ПЖ), порции мочи, эякуляте, а при категории IIIB имеет место наличие болевого синдрома и симптомов простатита, но отсутствует повышенное количество лейкоцитов и не выявляются стандартными методами патогенные микроорганизмы в секрете простаты, моче, полученном после массажа простаты эякуляте [4]. При длительно текущем ХП основным звеном в патогенезе заболевания считают повреждение структуры клеточной стенки и ДНК эпителиальных клеток ПЖ за счет снижения макрофагального оксида азота в ее тканях, ведущего к нарушению трофики железистой ткани, расстройству нейрогуморальной регуляции железы, застою секрета в ацинусах, нарушению микроциркуляции в альвеолах и даже к активации неопластических процессов в ней [5–7].
У 30–50% пациентов с ХП нарушается половая функция, в том числе и репродуктивная, с ухудшением показателей спермограмм [8–11].

В настоящее время единый подход к лечению больных хроническим абактериальным простатитом (ХАП), или синдромом хронической тазовой боли (СХТБ), еще не достаточно сформирован, несмотря на значительное количество публикаций, методических рекомендаций, диссертаций. Среди лекарственных средств, используемых в лечении этого заболевания, применяют антибактериальные препараты, растительные экстракты, микроэлементы, витамины.
Европейская ассоциация урологов (EAU) предлагает включать в комплексное лечение заболеваний ПЖ фитопрепараты, которые снижают симптомы нижних мочевыводящих путей. В ряде работ отечественных ученых отмечено положительное влияние фитопрепаратов, особенно экстрактов serenoa repens, в лечении пациентов с аденомой предстательной железы, хронического простатита (ХП) [12–15, 16, 17].
Не теряет своей актуальности вопрос о патогенетическом и профилактическом лечении ХП у больных с нарушением половой функции фармакологическими средствами, фитопрепаратами, которые были бы наиболее безопасны, эффективны и без побочных действий. Таким средством могут быть компоненты комплекса Простатинол.

Компоненты комплексного средства (БАД) Простатинол (ООО «ВИС», Санкт-Петербург) состоят из экстрактов: serenoa repens, pygeum africanum, семян тыквы, перца, элеутерококка, женьшеня, аминокислот, группы витаминов В и Е, цинка, которые совместно могут воздействовать на функциональное состояние ПЖ, облегчать симптомы простатита, улучшать половую функцию и показатели эякулята. Наиболее благотворное патогенетическое действие оказывают растительные экстракты: плодов пальмы сабаль, коры пиджеума, семян тыквы, лечебный эффект которых обусловлен подавлением фермента 5α-редуктазы, ароматазы и факторов роста. Обладая антиандрогенными свойствами, эти экстракты снижают пролиферацию клеток ПЖ, нормализуя ее функцию, улучшая микроциркуляцию и оказывая противовоспалительное действие. Экстракт семян тыквы содержит цинк, который оказывает противовоспалительное, иммуномодулирующее, метаболическое действия, активно участвуя в синтезе тестостерона, функционировании половых желез и процессах сперматогенеза. Семена тыквы содержат массу токоферолов, каратиноидов, угнетающих перекисное окисление липидов в мембранах клеток, обладая антиоксидантными свойствами. Экстракты элеутерококка и женьшеня обладают адаптогенным эффектом, повышают неспецифическую резистентность организма, действуют тонизирующе на ЦНС. Дефицит аминокислот, особенно аргинина, приводит к снижению оксида азота и нарушению половой функции. Витамины группы В участвуют в синтезе половых и гонадотропных гормонов, а витамин Е улучшает микроциркуляцию в простате, гонадах, стабилизируя гормональный баланс в организме. Экстракт перца обладает антиоксидантными и бактерицидными свойствами. Экстрагирование биологически активных компонентов комплекса Простатинол – сложный технологический процесс промышленного производства (получено свидетельство РФ о государственной регистрации Простатинола № KZ. 16.01.79.003.E.003198.12.14 от 26.12.2014).
Цель исследования: оценить эффективность и безопасность Простатинола в патогенетическом лечении хронического абактериального простатита, осложненного сперматологическими нарушениями.
Материалы и методы. Больные были обследованы как в консультативно-диагностическом центре урологической клиники Северо-Западного государственного медицинского университета им. И.И. Мечникова, расположенном в Александровской больнице, являющейся базой кафедры урологии СЗГМУ им. И. И. Мечникова, так и в прикрепленных поликлиниках за период с января по апрель 2015 г. Проанализированы результаты обследования 45 пациентов в возрасте от 23 до 45 лет (средний возраст – 34 года) с диагностированным хроническим абактериальным простатитом (ХАП) категории IIIB в соответствии с классификацией, предложенной Национальным институтом здоровья (NIH, 1995).
Пациенты были разделены на две группы. В основную группу вошли 25 пациентов, принимавших биологически активную добавку Простатинол по 1 таблетке 2 раза в день в течение 30 дней. Группу сравнения составили 20 пациентов, которые получали только традиционную противовоспалительную (неантибактериальную) терапию с такой же продолжительностью.
К традиционной противовоспалительной терапии ХАП мы относим применение препаратов растительного происхождения (спеман, тентэкс); ректальных микроклизм с растворами ромашки, шалфея; сидячие теплые ванны; лечебную физкультуру; массаж ПЖ; применение ректально суппозиториев с прополисом, тыквеолом, нестероидными препаратами (индометацин); физические методы: ультразвук, электрофорез, диадинамические токи и др. Все они оказывают противовоспалительное, противоотечное, противозастойное действия, уменьшают болевые ощущения, дискомфорт в области ПЖ, улучшают качество мочеиспускания, сперматологические показатели, сексуальную функцию.
Обследование больных включило сбор анамнеза с применением шкалы индекса симптомов хронического простатита Национального института здоровья США (NIH-CPSI. В данной шкале три раздела, характеризующих боль (0–21 балла), расстройства мочеиспускания (0–10) и влияние заболевания на качество жизни (0–12). Суммарный показатель шкалы варьируется от 0 до 43 баллов. По количеству баллов определена выраженность симптомов: 0–14 баллов – мало выраженная симптоматика; 15–29 – умеренная; 30–43 баллов – выраженная. Кроме того, мы применяли шкалу Международного индекса эректильной функции (МИЭФ).
 Исследование спермы осуществлено до лечения и в отдаленные сроки через 12 нед после прекращения лечения (с учетом того, что продолжительность сперматогенеза составляет 72–75 дней) с помощью счетных камер Маклера, Горяева в соответствии с требованием ВОЗ [18–20]. Всем пациентам выполнены общий анализ мочи, клинические и биохимические анализы крови, определен уровень половых и гонадотропных гормонов, уровень простатспецифического антигена (ПСА) в сыворотке крови, бактериологические посевы из уретры, секрета предстательной железы или 3-й порции мочи после массажа ПЖ, эякулята на инфекции, передаваемые половым путем (ИППП), методом ПЦР и условно-патогенную флору. Выполнено пальцевое ректальное исследование предстательной железы (ПЖ), УЗИ почек и мочевого пузыря, исследование ПЖ трансректальным датчиком (ТРУЗИ) с допплерографией, а также допплерографию сосудов полового члена и урофлоуметрию. Микроскопия секрета ПЖ, эякулята выполнена на бинокулярном микроскопе при увеличении в 400 раз.
Исследование спермы осуществлено до лечения и в отдаленные сроки через 12 нед после прекращения лечения (с учетом того, что продолжительность сперматогенеза составляет 72–75 дней) с помощью счетных камер Маклера, Горяева в соответствии с требованием ВОЗ [18–20]. Всем пациентам выполнены общий анализ мочи, клинические и биохимические анализы крови, определен уровень половых и гонадотропных гормонов, уровень простатспецифического антигена (ПСА) в сыворотке крови, бактериологические посевы из уретры, секрета предстательной железы или 3-й порции мочи после массажа ПЖ, эякулята на инфекции, передаваемые половым путем (ИППП), методом ПЦР и условно-патогенную флору. Выполнено пальцевое ректальное исследование предстательной железы (ПЖ), УЗИ почек и мочевого пузыря, исследование ПЖ трансректальным датчиком (ТРУЗИ) с допплерографией, а также допплерографию сосудов полового члена и урофлоуметрию. Микроскопия секрета ПЖ, эякулята выполнена на бинокулярном микроскопе при увеличении в 400 раз.
Критерии включения в исследования: возраст от 20 до 45 лет, больные с установленным диагнозом «хронический абактериальный простатит» и сперматологическими нарушениями с длительностью заболевания не менее 6 мес, наличие симптомов хронического простатита, оценка симптомов по шкале I-PSS (от 8 до 14 баллов), желание повысить качество жизни, улучшить мочеиспускание, сперматологические показатели и качество эрекции, а также отсутствие микроорганизмов в бактериологических посевах патогенной флоры (в концентрации менее 103 КОЕ/мл) и инфекции, передаваемой половым путем (ИППП): хламидий, микоплазм, уреаплазм, трихомонад, гонококков, гарднерелл, полученных в мазке из уретры, секрета предстательной железы (ПЖ) или 3-й порции мочи после массажа ПЖ, эякулята методом ПЦР и отсутствием повышенного количества лейкоцитов (менее 10 в поле зрения) при микроскопии секрета ПЖ, или 3-й порции мочи после массажа ПЖ, эякулята (при 400-кратном увеличении).
Критериями исключения стали оперативные вмешательства в области ПЖ, малого таза, ИППП, острый простатит, уретрит, камни в предстательной железе, экскреторная форма бесплодия, стриктуры уретры, повышение уровня ПСА свыше 4 нг/мл, рак ПЖ, новообразования мочевого пузыря, варикоцеле, почечно-печеночная недостаточность, психические заболевания и прием α-адреноблокаторов.
Результаты исследований обработаны общепринятыми статистическими методами с вычислением среднего значения, доверительного интервала при доверительной вероятности α=0,95 (вероятность ошибки, p<0,05). Статистическую обработку материала проводили с использованием пакета программ прикладной статистики SPSS 12.0.
Результаты. До лечения пациенты обеих групп предъявляли жалобы на периодические боли в промежности, периодическую поллакиурию, ухудшение показателей эякулята, ослабление адекватных эрекций. Продолжительность заболевания в обеих группах составляла от 6 мес до 3 лет. У всех пациентов диагностирован ХАП категории IIIВ. До лечения у них были исключены уретрит, ИППП.
В секрете ПЖ или 3-й порции мочи после массажа ПЖ в эякуляте отмечено нормальное содержание лейкоцитов с уменьшением числа лецитиновых зерен. Уровень половых и гонадотропных гормонов у всех больных находился в пределах нормы, а концентрация ПСА не превышала 2 нг/мл.
Изменение состояния больных в динамике оценивали по шкале NIH-CPSI. Так, через 4 нед лечения Простатинолом и традиционными методами в обеих группах отмечено снижение интенсивности боли, но в основной группе более заметно – с 10,4±3,7 до 6,3±2,9 балла (p<0,05), чем в контрольной, – с 9,8±3,7 до 7,8±3,5 балла (p<0,05). Однако в отдаленные сроки наблюдения через 12 нед после прекращения лечения в основной группе значительно снизилась выраженность боли до 2,8±1,0 балла (p<0,05), а в контрольной группе боли возобновились, выраженность которых составила 7,2±3,2 балла (p<0,05; табл. 1, рис. 1). Динамика расстройств мочеиспускания по шкале I-PSS была следующей: в основной группе исходно этот показатель составил 9,2±3,9 балла, через 4 нед уменьшился до 5,2±2,6, а через 12 нед снизился более чем в 4 раза – до 2,1±0,9; в контрольной группе – до 9,8±3,6, 7,2±3,1, 6,0±2,8 балла соответственно и расстройства мочеиспускания уменьшались значительно медленней, чем у больных основной группы. Качество жизни в динамике у пациентов основной группы улучшалось быстрее, чем в контрольной группе. Так, исходно этот показатель в основной группе составил 4,0±2,0 балла, через 4 нед – 3,4±1,8, через 12 нед после прекращения лечения качество жизни этих больных значительно улучшилось и составило 2,0±0,9 балла, в контрольной же группе ухудшение качества жизни до 4,5±1,9, 4,3±2,1, 3,6±1,9 балла соответственно, это связано с применением традиционных методов лечения.
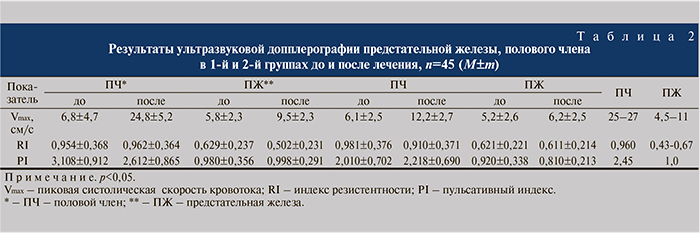
До лечения при пальцевом ректальном исследовании ПЖ у больных обеих групп была болезненной, несколько уплотненной с участками рубцевания и уменьшенной в объеме. По данным ТРУЗИ и допплерографии ПЖ, была диффузно неоднородной консистенции с гиперэхогенными участками, исходно несколько уменьшена в объеме до 19,2±4,9 см3 в основной группе, в контрольной группе до 19,8±4,3 см3 и сниженным кровотоком в субкапсулярных и парауретральных артериях до 5,8±2,3 см/с в основной группе и до 5,2±2,6 см/с – в контрольной (табл. 1, 2).
Через 4 нед у больных основной группы после приема Простатинола при пальцевом ректальном исследовании отмечено значительное уменьшение болезненности, уменьшение рубцовых участков в ПЖ, появление участков с мягкоэластической консистенцией, что подтверждали данные трансректальной ультразвуковой допплерографии, по которой определялись участки с нормальной зернистой эхоструктурой и незначительным увеличением ПЖ в объеме до 23,2±5,2 см3, а в контрольной группе положительных изменений в ПЖ при пальцевом ректальном исследовании, ТРУЗИ с допплерографией нами не отмечено и объем ПЖ составил 20,1±4,8 см3.
В отдаленные сроки наблюдения больных через 12 нед после прекращения лечения в основной группе объем ПЖ приближался к нормальным ее размерам и сохранялся до 23,8±4,9 см3 при исходном -19,2±4,9 см3 (p<0,05), а в контрольной группе больных, получавших традиционное лечение, нами отмечено некоторое увеличение объема ПЖ – с 19,8±4,3 до 21,8±4,7 см3 (p<0,05), что, возможно, связано с применением физических методов лечения.
В отдаленные сроки, через 12 нед после прекращения лечения, трансректальной допплерографией ПЖ определялось улучшение кровотока в сосудах предстательной железы с повышением максимальной систолической скорости (Vmax), увеличение участков с нормальной зернистой эхоструктурой у больных основной группы, что не наблюдалось в контрольной группе (см. табл. 2).
Максимальная скорость потока мочи (Qmax) до лечения в обеих группах была снижена, в основной группе она составила 13,2±3,8 мл/с, в контрольной -13,4±3,78 мл/с. Через 4 нед (Qmax) достоверно увеличивалась до 14,8 мл/с в основной группе и нормализовалась через 12 нед после прекращения лечения также у больных основной группы до 15,9±3,68 мл/с (p<0,05). В контрольной группе незначительное увеличение (Qmax) отмечено только после лечения (p<0,05). У больных обеих групп до лечения определена остаточная моча от 20 до 24 мл, через 4 нед после лечения Простатинолом объем остаточной мочи (Vres) в основной группы уменьшился в 2 раза, а через 12 нед после лечения остаточная моча в основной группе вообще не определялась, в контрольной группе уменьшение объема остаточной мочи было незначительным (см. табл. 1).
Через 4 нед, а особенно через 12 нед после прекращения лечения у больных основной группы при микроскопии нативного препарата секрета ПЖ, эякулята отмечено увеличение количества лецитиновых зерен, однако в контрольной группе оставалось их отсутствие или периодическое появление, что связано с функциональными нарушениями в ПЖ.
До лечения у больных обеих групп оценка по шкале МИЭФ не достигала 21 балла. Через 4 нед после лечение в обеих группах отмечено достоверное повышение МИЭФ более 21 балла, но выше в основной группе до 22,6±4,7, контрольной – до 21,3±4,0 балла. По данным ультразвуковой допплерографии сосудов полового члена определялось снижение максимальной систолической скорости (Vmax) кровотока, индексов периферического сопротивления: резистентности (RI) и пульсативности (PI) в кавернозных артериях (см. табл. 2). В динамике у больных основной группы через 12 нед после прекращения лечения констатировали статистически значимое повышение суммы баллов по МИЭФ до 24,2±4,5, в контрольной группе этот показатель составил 21,8±3,9 балла, а также отметили увеличение в 4 раза максимальной систолической скорости кровотока в сосудах полового члена, при том что в контрольной группе последний показатель увеличился лишь в 2 раза (p<0,05), (см. табл. 1, 2).
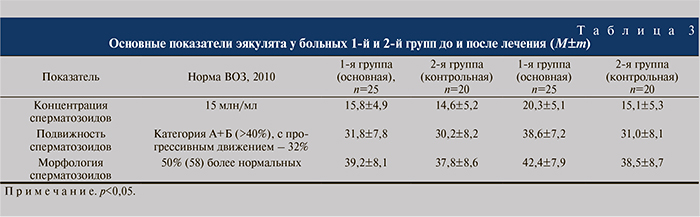
Для оценки фертильности выполняли анализ эякулята по стандартам ВОЗ 2010 г. До лечения у больных основной группы в спермограмме выявлена нормальная концентрация сперматозоидов (нормазооспермия) и снижение их подвижности (астенозооспермия), а в контрольной группе одновременно определялось умеренное снижение концентрации сперматозоидов и снижение их подвижности (олигоастенозооспермия). В обеих группах морфологических нарушений сперматозоидов не обнаружено. Через 12 нед после прекращения лечения в спермограммах (они выполнялись с учетом сперматогенеза 72–75 дней) больных основной группы, получавших Простатинол, значительно увеличилась концентрация и подвижность сперматозоидов, в контрольной же группе, получавших традиционные методы лечения, эти показатели повысились незначительно (p<0,05), (см. табл. 3).
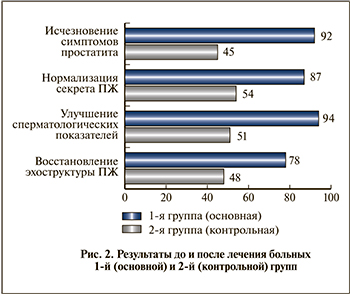
В результате проведенного обследования и лечения нами отмечен положительный клинический эффект (исчезновение симптомов простатита) констатирован у 92% пациентов, получавших Простатинол, а среди прошедших курс традиционного лечения – в 2 раза реже, т.е. лишь у 45% больных (рис. 2).
У 5 жен пациентов основной группы наступила беременность. Ни у одного пациента основной группы не отмечено побочных реакций на фоне приема Простатинола.
Обсуждение. Как показали результаты исследования, высокая эффективность и хорошая переносимость компонентов комплекса Простатинол возрастали при его постоянном приеме в патогенетическом лечении больных хроническим абактериальным простатитом, осложненным сперматологическими нарушениями, что оказало положительное действие на все основные симптомы заболевания, значительно улучшило кровообращение в предстательной железе, половом члене, повысило концентрацию, подвижность сперматозоидов и репродуктивные показатели супружеской пары. Все вышеперечисленное подтверждалось субъективной и объективной симптоматикой по шкалам NIH-CPSI, IPSS, QOL, МИЭФ, данными урофлоуметрии, ТРУЗИ, допплерографии предстательной железы, полового члена, спермограммами. С учетом эффективности данной методики ее можно рекомендовать к применению больным не только при хроническом абактериальном простатите с нарушением половой функции, но и для профилактики заболеваний предстательной железы.
Заключение. Таким образом, синергизм действия компонентов комплекса Простатинол, особенно экстрактов: плодов пальмы сабаль, коры пиджеума, семян тыквы, более активно воздействуют на все звенья патогенеза хронического простатита, нормализуют функциональное состояние предстательной железы, уменьшают пролиферативные процессы за счет действия на ростковые факторы. Ежедневный прием Простатинола значительно облегчает симптомы простатита, снижает риск повреждения структуры клеточной стенки эпителиальных клеток ПЖ улучшает качество жизни мужчин, повышает фертильность эякулята. Простатинол можно рекомендовать назначать в комплексном курсовом лечении (не менее трех раз в год) и для профилактики заболеваний ПЖ в любом возрасте больных с умеренно выраженными симптомами расстройства акта мочеиспускания, репродуктивными и сексуальными нарушениями.


