Введение. На сегодняшний день вопрос бесплодного брака остается значимой медико-социальной проблемой, что объясняет повышенное внимание исследователей к состоянию репродуктивного здоровья как женщины, так и мужчины [1, 2]. Наиболее сложной для лечения формой мужского бесплодия является обструктивная азооспермия (ОА), определяемая как полное отсутствие сперматозоидов в эякуляте вследствие нарушения проходимости семявыносящих путей [3, 4]. Вспомогательные репродуктивные технологии – основная возможность для пациентов с обструктивной азооспермией иметь собственных генетических детей. Однако применяемые пункционные методики биопсии яичка не всегда эффективны в плане получения пригодных для ИКСИ (от англ. ICSI – IntraCytoplasmic Sperm Injection, интрацитоплазматическая инъекция сперматозоида) сперматозоидов. В литературе вопрос сохранности сперматогенеза в тканях яичка при обструкции семявыносящих путей излагается весьма противоречиво [5–9].
Цель исследования: изучить влияние уровня и длительности обструкции семявыносящих путей на морфологическое и функциональное состояние ткани яичка.

Материалы и методы. Исследование проведено на 50 крысах-самцах линии Вистар массой 410–640 г с учетом правил использования экспериментальных животных и в соответствии с принципами биоэтики. Животные содержались при 12-часовом световом дне на стандартном рационе.
 В эксперименте создано 3 модели обструкции: 1-я группа (n=14) – обструкция проксимальной части семявыносящего протока (СП), 2-я (n=14) – обструкция дистальной части СП, 3-я (n=14) – обструкция на уровне придатка яичка. Четвертая группа (интактные животные; n=8) считалась контрольной. Животных наблюдали в течение 3 и 6 мес с момента формирования обструкции. В соответствии со сроками наблюдения животные 1–3-й групп были разделены на две подгруппы.
В эксперименте создано 3 модели обструкции: 1-я группа (n=14) – обструкция проксимальной части семявыносящего протока (СП), 2-я (n=14) – обструкция дистальной части СП, 3-я (n=14) – обструкция на уровне придатка яичка. Четвертая группа (интактные животные; n=8) считалась контрольной. Животных наблюдали в течение 3 и 6 мес с момента формирования обструкции. В соответствии со сроками наблюдения животные 1–3-й групп были разделены на две подгруппы.
Обезболивание достигали путем внутримышечного введения раствора золетил 100 в дозе 2 мг на 1 кг массы тела, рометара 2% 0,15 мл/кг. По вентральной поверхности мошонки производили продольный разрез до 2 см с переходом на паховую область. Животным 1-й группы выделяли семенной канатик до наружного отверстия пахового канала. Животным 2-й группы выделяли яичко, придаток и СП в области выхода из хвоста придатка яичка. Семявыносящий проток перевязывали двумя викриловыми лигатурами, затем пересекали. Животным 3-й группы между яичком и головкой придатка накладывали две викриловые лигатуры и придаток отсекали от яичка. Рану послойно ушивали непрерывным викриловым швом. Интраоперационно измеряли поперечные и продольные размеры яичек. Объем яичек рассчитывали путем умножения трех измерений яичка и коэффициента эллипсоидности (0,479). По окончании сроков наблюдения (3 или 6 мес) удаляли яички, придатки и СП, измеряли линейные размеры яичек. Полученный материал фиксировали в жидкости Боуэна в течение 24 ч.
Гистологические препараты готовили по общепринятой методике, окрашивали гематоксилином и эозином. На полученных препаратах подсчитывали 100 поперечных срезов семенных канальцев (СК). Был произведен подсчет количества СК, содержащих четыре стадии развития половых клеток (сперматогонии, сперматоциты, сперматиды и сперматозоиды), три стадии (сперматогонии, сперматоциты и сперматиды), две стадии (сперматогонии и сперматоциты), одну стадию (сперматогонии) и содержащие только клетки Сертоли. Определяли долю (в %) СК каждого из перечисленных типов, а также индекс сперматогенеза – сумму всех подсчитанных в 100 СК стадий клеток сперматогенеза, поделенную на 100 (в %).
Статистическую обработку данных проводили с помощью программы Statistica for Windows v. 7.0. Все количественные показатели представлены в форме среднее значение±стандартное отклонение. Анализ данных проводили с использованием критерия Вилкоксона.

Результаты и обсуждение. Изменения объема яичка (Vt) оценивали в зависимости от уровня и сроков обструкции (табл. 1). Во всех группах Vt достоверно был ниже исходных параметров (р<0,05). Наиболее выраженные изменения наблюдались при обструкции на уровне придатка яичка – объем был снижен более чем в 2 раза. В 3-й группе Vt достоверно отличался от Vt во 2-й группе (р<0,05). В свою очередь во 2-й группе Vt оказался достоверно меньше, чем в 1-й (р<0,05). Полученные данные демонстрируют, что снижение объема яичка – одного из прогностических факторов сохранности сперматогенеза – зависит от уровня обструкции семявыносящих путей.
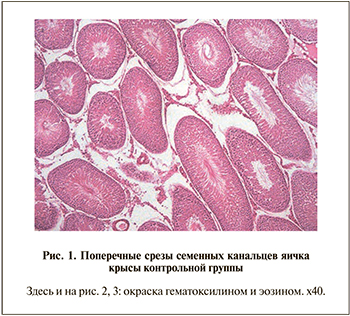
Результаты морфологической оценки ткани яичка (табл. 2) сравнивали с контролем и между группами. В группе контроля индекс сперматогенеза составил 3,98±0,01. Практически все СК (98,63±0,96%) содержали сперматозоиды (рис. 1). В остальных исследуемых группах отмечали снижение индекса сперматогенеза, количества СК с четырьмя стадиями развития герминогенных клеток, увеличение количества пустых СК и появление СК одной, двумя и тремя стадиями развития клеток.
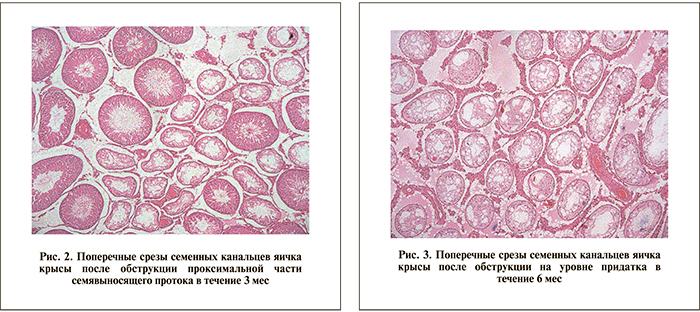
Через 3 мес обструкции проксимальной части СП наблюдали умеренное подавление сперматогенеза. Индекс сперматогенеза был достоверно ниже контроля и составил 2,87±0,62 (р<0,05). Герминогенные клетки на всех стадиях созревания отмечались в 51,93±21,87% СК (рис. 2). Отмечено появление канальцев с тремя, двумя и одной стадиями созревания. 15,43±11,34% СК содержали только клетки Сертоли. Спустя 6 мес изменения сперматогенеза были более выражены и по всем оцениваемым параметрам достоверно отличались от таковых спустя 3 мес наблюдения. Так, индекс сперматогенеза снизился до 1,71±1,27, 34,34±28,62%, СК содержали сперматозоиды в резко уменьшенном количестве. Увеличилось количество СК, содержащих только клетки Сертоли (50,57±33,09%). Таким образом, с увеличением сроков обструкции на уровне проксимальной части СП снижался индекс сперматогенеза и увеличивалось количество пустых канальцев, содержащих только клетки Сертоли.
Обструкция дистальной части СП (2-я группа) привела к достоверному снижению всех параметров сперматогенеза по сравнению с контролем. Индекс сперматогенеза составил лишь 0,95±0,23, единичные сперматозоиды обнаруживались в 14,29±3,65% канальцев. Больше половины СК содержали только клетки Сертоли. В отдаленном периоде (6 мес) были получены схожие данные (табл. 2), при этом статистически значимых различий по сравнению с таковыми по итогам 3-месячного наблюдения этой группы выявлено не было (р>0,05). Таким образом, установлено, что обструкция дистальной части СП сопровождается нарушением сперматогенеза и выраженным снижением всех его показателей, однако степень выраженности этих изменений не зависит от срока обструкции.
Наиболее выраженные изменения отмечали при обструкции на уровне придатка яичка (3-я группа). Через 3 мес обструкции индекс сперматогенеза снизился в 4 раза по сравнению с контролем и составил 0,85±0,24. Зрелые сперматозоиды наблюдали лишь в 9,29±2,73% СК. В 69,29±8,56% СК отсутствовали клетки герминогенного эпителия, они содержали только клетки Сертоли с утолщенной базальной мембраной с выраженными дистрофическими изменениями. По прошествии 6 мес эпидидимальная обструкция привела к атрофии семенных канальцев (рис. 3). Степень нарушения сперматогенеза была статистически значимо более выражена по сравнению с предыдущим сроком наблюдения (р<0,05). Индекс сперматогенеза составил 0,08±0,09%. Лишь у двух животных этой группы обнаружили единичные СК с вызреванием герминогенных клеток до трех, двух и одной стадий. Остальные СК практически не имели просвета и содержали только клетки Сертоли. При анализе зависимости индекса сперматогенеза от срока обструкции на уровне придатка яичка отмечалась сильная статистическая взаимосвязь, при этом связь носит «обратный характер» (r=-0,96; р<0,05) (рис. 3). То есть снижение индекса сперматогенеза зависит от длительности обструкции на уровне придатка яичка. Кроме того, отмечается сильная прямая корреляция (r=0,96, р<0,05) количества семенных канальцев (%), содержащих только клетки Сертоли, и сильная обратная корреляция (r=-0,96, р<0,05) количества канальцев с четырьмя стадиями созревания в зависимости от срока обструкции. Таким образом, увеличением срока обструкции на уровне придатка яичка увеличивалось количество пустых семенных канальцев, содержащих только клетки Сертоли, и уменьшалось количество канальцев, содержащих сперматозоиды.
После определения показателей сперматогенеза в группах мы оценили степень выраженности этих изменений в зависимости от уровня обструкции у наблюдаемых в течение 3 мес животных. Наиболее высокий индекс сперматогенеза и наименьшее количество пустых канальцев отмечали при обструкции проксимальной части СП (р<0,05). При этом у животных с более дистальным уровнем обструкции (2-я и 3-я группы) эти показатели существенно не различались. В то же время количество канальцев, содержащих сперматозоиды, было статистически значимо меньше в 3-й группе, чем во 2-й, а во 2-й группе меньше, чем в 1-й (р<0,05). Индекс сперматогенеза, количество пустых канальцев и канальцев, содержащих сперматозоиды, в группе с эпидидимальной обструкцией достоверно отличались от данных показателей других групп. Эти изменения также оказались более выраженными во 2-й, чем в 1-й, группе. Таким образом, полученные данные свидетельствуют о прогрессировании нарушений сперматогенеза в связи со сроками обструкции.
Заключение. Данные экспериментального исследования свидетельствуют о существенном влиянии уровня и длительности обструкции семявыносящих путей на морфологическое состояние ткани яичка и сперматогенез. Это выражается в снижении одного из важнейших показателей фертильности – индекса сперматогенеза, уменьшении количества СК, содержащих сперматозоиды, и увеличении числа канальцев, содержащих только клетки Сертоли. Значимое снижение клеточного компонента СК обусловливает регресс объема яичек – одного из прогностических факторов сохранности сперматогенеза. Следует подчеркнуть, что нарушение проходимости на уровне придатка яичка обусловливает наиболее тяжелое нарушение сперматогенеза. В отдаленные сроки наблюдения отмечается полная атрофия семенных канальцев. В то же время для более проксимальных уровней обструкции характерны менее выраженные изменения сперматогенеза. Таким образом, результаты экспериментальной работы объясняют неудачи пункционной аспирации сперматозоидов из яичка у пациентов с ОА. При выборе методики биопсии у пациентов с ОА следует учитывать длительность и уровень обструкции. На наш взгляд, при наличии длительной обструкции на уровне придатка яичка целесообразно выполнение «открытой» микрохирургической методики.


