Введение. Внутривенозное распространение почечно-клеточного рака служит частой хирургической проблемой, так как наблюдается более чем у 30% пациентов [1–6]. В 4–10% случаев опухолевые тромбы обнаруживаются в просвете нижней полой вены (НПВ). Одним из наиболее распространенных осложнений, возникающих при удалении внутривенозной части опухоли, считается массивное кровотечение. Общая кровопотеря во время оперативного вмешательства, включающего удаление неопластического тромба, определяется многими факторами и в основном является следствием кровотечений из поврежденных коллатеральных сосудов при выделении почки и НПВ, из просвета НПВ после удаления тромба, а также из полой вены, печеночных вен и паренхимы печени при их интраоперационной травме.
Современные хирургические подходы к удалению опухолевых внутривенозных тромбов основываются на технике васкулярной изоляции, которая препятствует эмболии легочной артерии опухолевыми массами и уменьшает вероятность массивного кровотечения из просвета вены [1, 3, 7–11]. Данная методика включает наложение зажимов на НПВ выше и ниже тромба, а также на контралатеральную почечную вену (техника трех турникетов). При «высоком» распространении опухоли применяется маневр Pringle для блокады печеночного кровотока [12, 13]. Тем не менее в ряде ситуаций при использовании классической васкулярной изоляции во время кавотомии отмечается активное выделение крови из просвета НПВ. Это связано с поступлением крови в зону операции из других притоков, которые в большинстве случаев представлены поясничными венами. Неполный васкулярный контроль может сопровождаться существенным кровотечением, затрудняющим обзор внутренней поверхности НПВ и препятствующим радикальному удалению опухоли.
Целью настоящего исследования было изучить клинические аспекты кровотечений из изолированного сегмента НПВ после кавотомии и эвакуации тромба.
Материалы и методы. В исследование вошли 13 пациентов с распространением почечно-клеточного рака в просвет НПВ, оперированных в Харьковском областном нефроурологическом центре им. В. И. Шаповала с 2012 по 2014 г. и имевших кровотечение из просвета НПВ при удалении опухолевого тромба.
Средний возраст больных составил 57,4 года (от 37 до 72 лет). Опухолевые тромбы в 3 (23,1%) наблюдениях достигали каворенального, в 5 (38,5%) – подпеченочного, в 3 (23,1%) – ретропеченочного отдела НПВ, а у 2 (15,4%) больных проникали в супрадиафрагмальный сегмент НПВ. Опухоли исходили из правой почки в 8 (61,5%) наблюдениях, из левой – в 5 (38,5%). Инвазия интралюминальной опухоли в стенку НПВ имела место в 3 (23,1%) случаях. У 4 (30,8%) пациентов были обнаружены синехии между тромбом и эндотелием, требовавшие кюретажа интралюминальной поверхности полой вены.
В ходе вмешательств использован доступ «шеврон» или трехлучевой доступ «Мерседес». Двенадцатиперстную кишку мобилизовывали по Кохеру. При подпеченочных и каворенальных опухолевых тромбах ограничивались выделением подпеченочного и инфраренального сегмента НПВ, а также дистальных отделов обеих почечных вен.
В дальнейшем выполняли тромбэктомию с помощью стандартной техники трех турникетов. В случаях ретропеченочной или супрадиафрагмальной локализации верхушки тромба прибегали к мобилизации печени в классическом и/или рiggyback-варианте. Рiggyback-мобилизацию осуществляли путем пересечения и перевязки дорсальных печеночных вен, дренирующихся в области передней поверхности ретропеченочного отдела полой вены. Нетронутыми оставались только главные печеночные вены. На этапе пересечения серповидной связки и медиальных частей корональных связок тщательно выделяли супрапеченочную инфрадиафрагмальную часть НПВ, а также устья и внепеченочные части главных печеночных вен. Вокруг супрапеченочной инфрадиафрагмальной части НПВ проводили сосудистый турникет и приступали к последовательному выполнению нескольких вариантов хирургического доступа к супрадиафрагмальному сегменту НПВ без вскрытия перикарда: поперечной диафрагмотомии, Т-образной диафрагмотомии и при необходимости – циркулярной диафрагмотомии.
Правую долю печени поворачивали и смещали в медиальную сторону. Вслед за этим выделяли подпеченочную и ретропеченочную части НПВ. Затем рукой обхватывали интраперикардиальный отдел НПВ, старались сместить опухолевый тромб ниже устьев главных печеночных вен и наложить верхний сосудистый зажим под ними. При невозможности данного маневра сосудистый зажим накладывали на интраперикардиальную часть НПВ. После этого затягивали турникеты на почечной вене здоровой почки, на НПВ ниже тромба и на гепатодуоденальной связке (маневр Pringle). В дальнейшем последовательно выполняли стандартные этапы тромбэктомии.
При правосторонних опухолях почечную артерию перевязывали в интераортокавальном промежутке. В случае левосторонних новообразований, а также, когда правую почечную артерию не удавалось перевязать в аортокавальном пространстве, сначала выполняли тромбэктомию и лишь потом контролировали почечную артерию пораженной почки.
У всех пациентов прицельно исследовали источники кровотечений во время тромбэктомии и анализировали хирургические методики их коррекции.
Источники кровотечения разделяли на вариантные поясничные вены и поясничные вены инфраренального отдела НПВ. К вариантным поясничным венам относили сосуды, дренирующиеся в НПВ по ее задней поверхности на супраренальном уровне, которые не являлись адренальными, диафрагмальными или печеночными венами. При оценке источников кровотечений из просвета НПВ особое внимание уделяли условной «зоне риска» попадания верхних поясничных вен субренального отдела НПВ в область васкулярной изоляции тромба. Эта «зона риска» включала участок протяженностью 10 мм ниже устьев почечных вен.
Объем кровопотери подсчитывали путем суммирования объема крови в вакуумном аспираторе и разницы массы операционных салфеток.
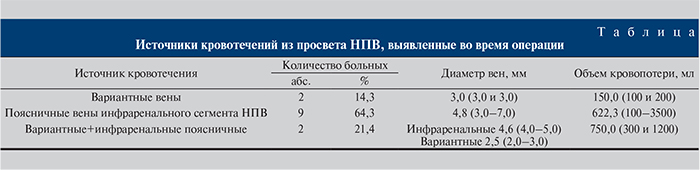
Результаты. Объем кровопотери из просвета изолированного сегмента НПВ при тромбэктомии варьировался от 100 до 3500 мл и составлял в среднем 507,3 мл (см. таблицу). К основным источникам кровотечений относились поясничные вены инфраренального отдела НПВ, расположенные на расстоянии менее 10 мм от устья правой почечной вены (85,7%). Вариантные вены встречались гораздо реже (35,7%). Диаметр их устьев и, соответственно, объем кровопотери из них были существенно меньше по сравнению с таковыми в группе кровотечений из инфраренальных поясничных сосудов.
Вариантные поясничные вены во всех случаях были единичными и дренировались в подпеченочном отделе НПВ. Инфраренальные поясничные вены из «зоны риска» в 6 (54,5%) из 11 наблюдений были множественными (2 вены).
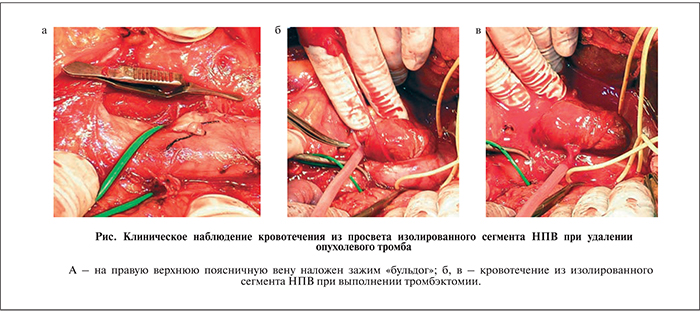
Среди всех 13 пациентов с опухолевыми тромбами НПВ 4 (30,8%) до этапа кавотомии на правую или левую поясничную вену из «зоны риска» накладывали сосудистый зажим либо ее перевязывали и пересекали. При этом источниками кровотечения в 2 наблюдениях стали вариантные вены, еще в 2 – контралатеральные поясничные вены инфраренального отдела НПВ (см. рисунок).
В 2 (15,4%) случаях устья венозных притоков были прошиты изнутри полой вены (2 вариантные вены). Шести (46,2%) пациентам для остановки кровотечения наложили зажим на поясничные вены уже после удаления тромба. В 4 (66,7%) наблюдениях этот маневр удалось выполнить успешно. В остальных 5 (38,5%) случаях купировать кровотечение пытались путем сдавления вероятной зоны локализации устья вариантной или поясничной вены пальцами или тупфером. При невозможности остановки кровотечения подобным способом кровь из просвета НПВ эвакуировали с помощью отсоса и пытались как можно быстрее ушить кавотомическую рану.
Обсуждение. Оценивая результаты использования представленных методов гемостаза, нужно отметить, что все они трудновыполнимы, зачастую неэффективны и могут сопровождаться тяжелыми осложнениями. Безусловно, оптимальный алгоритм профилактики этих кровотечений должен заключаться в получении информации о локализации и числе возможных источников кровотечения (дооперационная МДКТ), а также о давлении крови в изолированном сегменте НПВ во время операции (пункционная проба). Это позволит в большинстве случаев до этапа кавотомии выделить и пережать крупные вариантные и инфраренальные поясничные вены. Тем не менее при больших опухолях почки и массивных тромбах НПВ выполнить этот маневр далеко не всегда представляется возможным. К дополнительным осложняющим факторам относятся ограниченная подвижность НПВ из-за отека и склерозирования окружающей клетчатки, инвазии кавальной стенки или забрюшинной лимфаденопатии, а также развитие массивной сети венозных коллатералей. Попытка поиска и перевязки поясничных вен в данной ситуации может приводить к их травме и развитию кровотечения, которое очень трудно контролировать ввиду локализации устьев этих сосудов по задней поверхности полой вены.
Альтернативный подход, заключающийся в наложении зажима на поясничные вены после тромбэктомии, эффективен в 66,7% случаев по данным нашего исследования. Он также имеет недостатки, включающие необходимость поиска вены на фоне кровотечения, наложение зажима на вену вслепую и возможность повреждения НПВ или поясничной вены. Для эффективного выполнения данного маневра также необходима детальная информация о числе и локализации поясничных вен, которую можно получить на этапе предоперационного планирования. Ушивание устья вариантной или инфраренальной поясничной вены изнутри НПВ служит эффективным выходом из тяжелой ситуации, связанной с кавальным кровотечением. Этот вариант хирургической техники, несомненно, оправдан при отрыве поясничной вены от НПВ, при большой длительности этапа тромбэктомии, а также для быстрого достижения бескровного операционного поля.
Прижатие устья поясничной вены со стороны НПВ – простой и эффективный способ коррекции кровотечения. Однако при этом крайне сложно ушить кавотомическую рану, а также выполнить кюретаж просвета НПВ или ее резекцию.
Заключение. Кровотечения из просвета НПВ во время тромбэктомии имеют важное клиническое значение, так как сопровождаются большой кровопотерей и серьезно затрудняют ход операции.
С учетом низкой эффективности, высокой сложности и рискованности имеющихся методов коррекции кровотечения из просвета НПВ еще на дооперационном этапе целесообразно получать визуальную информацию о локализации и числе возможных источников кровотечения, а также о давлении крови в изолированном сегменте НПВ с помощью пункционной пробы во время операции. Такой подход позволит в большинстве случаев до этапа кавотомии выделить и пережать крупные вариантные и инфраренальные поясничные вены у пациентов, имеющих высокий риск кавального кровотечения.


